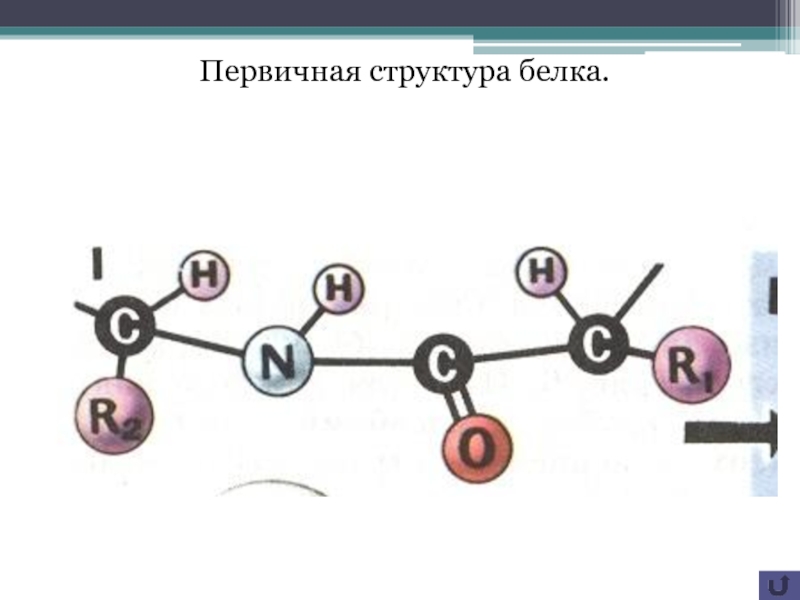
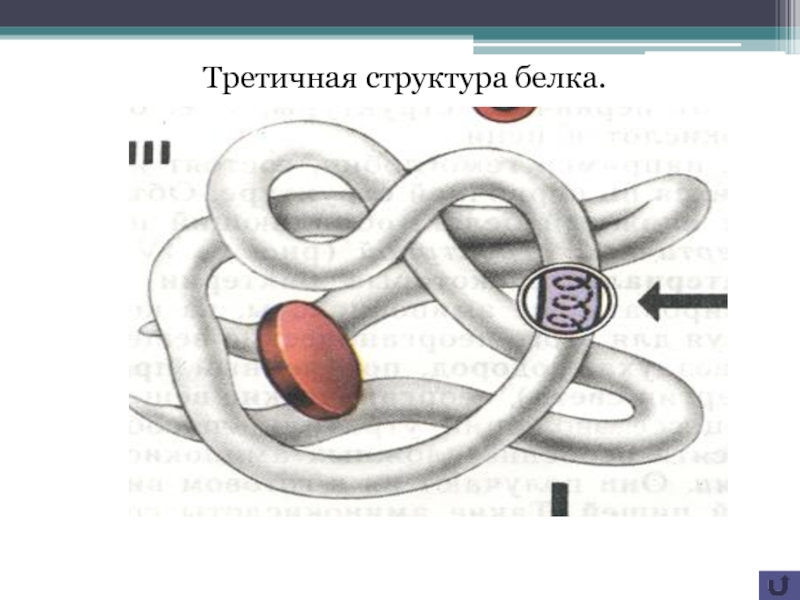
всех клеток являются белки. Белковая молекула является биополимером. Мономеры белка
- аминокислоты 20 разных типов. Если каждой конкретной аминокислоте условно присвоить определенный номер, то полипептидная ( белковая ) молекула может быть представлена , например , следующим образом:А3-А6-А12 –А9 – А17-……..А2