Слайд 1Презентация для 8 класса
Подготовила учитель физики МБОУ «Мальтинская СОШ»
Маклонова Е.В.
Аккумуляторы
Слайд 3Аккумуляторы
Созданы для накопления
электрического тока.
Предназначены для многократного
использования и имеют
достаточно
большой срок службы.
Простейший аккумулятор –
это два электрода которые
сделаны из разных металлов
и поглощены в раствор
электролита (кислоты).
Один из электродов называют катодом,
а другой анодом.
В практике чаще всего применяют
свинцовые и литиевые аккумуляторы.
Слайд 4Алесса́ндро Джузе́ппе Анто́нио Анаста́сио Во́льта
итальянский физик, химик и физиолог, один
из основоположников учения об электричестве; граф (1801).
Слайд 5Виды аккумуляторов:
Железно-воздушный аккумулятор
Железно-никелевый аккумулятор
Лантано-фторидный аккумулятор
Литиево-железно-сульфидный аккумулятор
Литиево-железно-фосфатный
аккумулятор
Литиево-ионный аккумулятор
Литиево-полимерный аккумулятор
Литиево-фторный аккумулятор
Литиево-хлорный аккумулятор
Литиево-серный
аккумулятор
Натриево-никелево-хлоридный аккумулятор
Натриево-серный аккумулятор
Никелево-кадмиевый аккумулятор
Никелево-металло-гидридный аккумулятор
Никелево-цинковый аккумулятор
Свинцово-водородный аккумулятор
Свинцово-кислотный аккумулятор
Серебряно-кадмиевый аккумулятор
Серебряно-цинковый аккумулятор
Цинково-бромный аккумулятор
Цинково-воздушный аккумулятор
Цинково-хлорный аккумулятор
Никель-водородный аккумулятор
Слайд 6Основные параметры аккумуляторов
тип электрохимической системы,
электрическое напряжение
электрическая емкость
внутреннее сопротивление
ток
саморазряда
срок службы
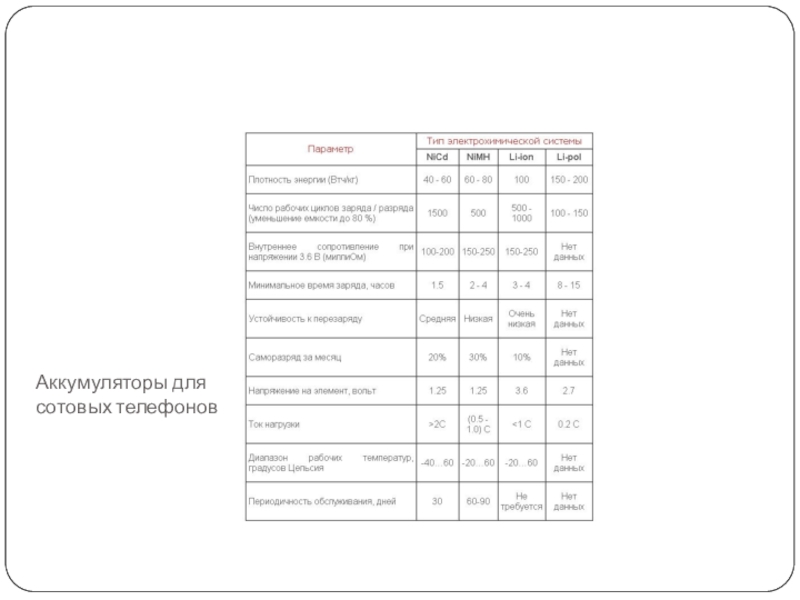
Слайд 7Аккумуляторы для сотовых телефонов
Слайд 8NiCd
NiCd аккумулятор - ветеран на рынке мобильных устройств связи. Отлаженная
технология и надежная работа обеспечили ему широкое распространение для питания
портативной техники и оборудования. Его основные достоинства:
- превосходная работоспособность в широком диапазоне температур, в том числе возможность заряда при отрицательных температурах;
- способность отдавать в нагрузку большой ток;
длительный срок службы - свыше тысячи циклов заряда / разряда при правильной эксплуатации и обслуживании;
- слабая чувствительность к неправильной эксплуатации;
- легкое восстановление при понижении емкости и после длительного хранения;
- низкая цена.
Среди недостатков - необходимость периодической полной разрядки аккумулятора для сохранения эксплуатационных свойств (устранения эффекта памяти), высокий саморазряд (до 10 % в течение первых 24-х часов) и большие габариты по сравнению с аккумуляторами других типов. Кроме того, аккумулятор содержит кадмий и требует специальной утилизации. Из-за больших габаритов и проблем с утилизацией NiCd аккумулятор постепенно покидает рынок сотовых телефонов.

Слайд 9NiMH
NiMH аккумулятор - пришел на смену NiCd. Но надо заметить,
что его шумно разрекламированные преимущества на деле не оправдали ожиданий
потребителей из-за сокращенного срока службы. Эта ситуация только-только сейчас начинает выправляться в связи с технологическим прогрессом в их производстве. Отличительные преимущества сегодняшних NiMH аккумуляторов:
- примерно на 30 % большая емкость по сравнению со стандартными NiCd аккумуляторами при тех же габаритах;
- меньшая склонность к эффекту памяти, чем у NiCd. Периодические циклы восстановления должны выполняться реже;
- меньшая токсичность. NiMH технология считается экологически чистой.
К сожалению, NiMH аккумуляторы имеют недостатки и по некоторым параметрам проигрывают NiCd. Это меньшее число циклов заряда / разряда (около 500), более высокий саморазряд (выше в 1.5 - 2 раза) и более высокая цена.
Слайд 10Li-ion
Li-ion аккумулятор - все более широко начинает применяться в мобильной
технике связи, что обусловлено:
- высокой плотностью электрической энергии, по крайней
мере, вдвое большей, чем у NiCd того же размера, а значит и вдвое меньшими габаритами при той же самой емкости;
- низким саморазрядом (примерно 2-5% в месяц плюс около 3 % на питание встроенной электронной схемы защиты);
- отсутствием, каких либо требований к обслуживанию, за исключением необходимости длительного хранения в заряженном состоянии.
Но есть и отрицательные моменты: для аккумуляторов некоторых производителей работа только при положительных температурах, высокая цена и подверженность процессу старения, даже если аккумулятор не используется. Ухудшение емкости наблюдается примерно после одного года. После двух лет, аккумулятор часто становится неисправным. Поэтому не рекомендуется хранить Li-ion аккумуляторы в течение длительного времени. Максимально наслаждайтесь ими, пока они новые.
Слайд 11Li-Pol
Li-Pol аккумулятор - только-только начинает появляться на рынке сотовых телефонов
и портативных компьютеров. Имея примерно такую же плотность энергии, как
и Li-ion аккумулятор, литий-полимерные допускают изготовление в пластичных разнообразных геометрических формах, нетрадиционных для обычных аккумуляторов, в том числе достаточно тонких по толщине, и способных заполнять любое свободное место.
Слайд 12Варианты маркировок аккумуляторов для сотовых телефонов
SEALED LEAD ASID BATTERY –
(или сокращенно SLA) герметичный свинцово-кислотный аккумулятор - используется в переносных
сотовых телефонах типа Attashe с выходной мощностью 3 Вт;
NICKEL-CADMIUM BATTERY - (или сокращенно NiCd) никель-кадмиевый аккумулятор – используется в портативных сотовых телефонах;
NICKEL METAL-HYDRIDE BATTERY - (или сокращенно NiMH) никель-металл гидридный аккумулятор – используется в портативных сотовых телефонах;
LITHIUM ION BATTERY - (или сокращенно Li-ion) литий-ионный аккумулятор – используется в портативных сотовых телефонах.
LITHIUM POLIMER BATTERY - (или сокращенно Li-Pol) литий-полимерный аккумулятор – используется в последних новинках на рынке сотовых телефонов.
Слайд 13Типы автомобильных аккумуляторных батарей
никель-кадмиевые,
никель-металлгидридные,
литий-ионные,
свинцово-кислотные аккумуляторы
Слайд 14В зависимости от добавок для материала электродов
автомобильные аккумуляторы делят
на:
Традиционные («сурьмянистые»)
Малосурьмянистые
Кальциевые
Гибридные
Гелевые, AGM
И дополнительно:
Щелочные
Литий-ионные
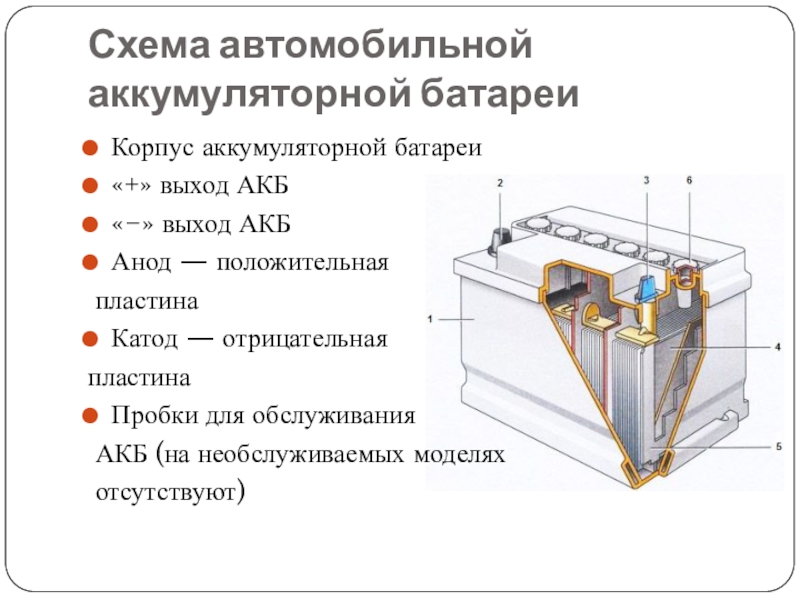
Слайд 15Схема автомобильной аккумуляторной батареи
Корпус аккумуляторной батареи
«+» выход АКБ
«−»
выход АКБ
Анод — положительная
пластина
Катод — отрицательная
пластина
Пробки для обслуживания
АКБ (на необслуживаемых моделях
отсутствуют)
Слайд 16Традиционные аккумуляторы («сурьмянистые»)
Слайд 22Гальванические элементы
Луиджи Гальвани
(итал. Luigi Galvani, 9 сентября 1737 — 4 декабря
1798) — итальянский врач, анатом, физиолог и физик, один из
основателей электрофизиологии и учения об электричестве, основоположник экспериментальной электрофизиологии. Первым исследовал электрические явления при мышечном сокращении («животное электричество»). Обнаружил возникновение разности потенциалов при контакте разных видов металла и электролита.
Химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока.
Слайд 25В состав гальванического элемента входят электроды. Электроды бывают:
Обратимые электроды
Электроды 1-го
рода — электроды, состоящие из металла, погруженного в раствор его соли;
Электроды
2-го рода — электрод, состоящий из металла, погруженного в раствор его нерастворимой соли, который содержит общий анион с нерастворимой солью (хлорсеребряный электрод, каломельный электрод, металл-оксидные электроды);
Электроды 3-го рода — электроды, состоящие из двух нерастворимых осадков электролитов, в менее растворимом есть катион, который образуется из металла электрода, а в более растворимом есть общий анион с первым осадком;
Газовые электроды — электроды, состоящие из неактивного металла в растворе и газа (кислородный электрод, водородный электрод);
Амальгамные электроды — электроды, состоящие из раствора металла в ртути;
Окислительно-восстановительные электроды — электроды, состоящие из неактивного металла (ферри-ферро-электрод, хингидронный электрод).
Ионоселективные мембранные электроды
Электроды с ионообменной мембраной с фиксированными зарядами — стеклянный электрод;
Электроды, состоящие из жидких ассоциированных ионитов;
Электроды с мембраной на основе мембраноактивных комплексонов;
Электроды с моно- и поликристаллической мембранами.

Слайд 26Классификация гальванических элементов
Гальванические первичные элементы — это устройства для прямого преобразования
химической энергии, заключенных в них реагентов (окислителя и восстановителя), в
электрическую
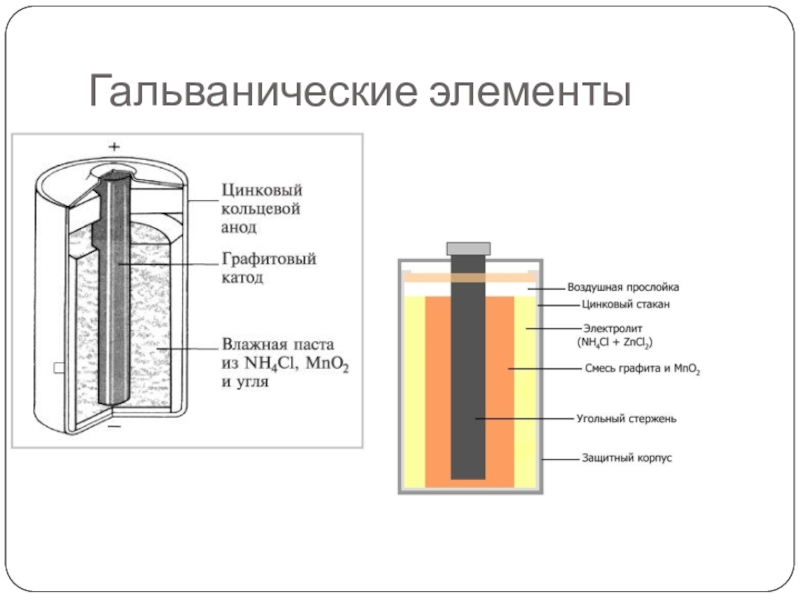
Широкое распространение получили марганцево-цинковые элементы, не содержащие раствора электролита (сухие элементы, батарейки). Так, в солевых элементах Лекланше цинковый электрод служит катодом, электрод из смеси диоксида марганца с графитом служит анодом, графит служит токоотводом. Электролитом является паста из раствора хлорида аммония с добавкой муки или крахмала в качестве загустителя.
Щелочные марганцево-цинковые элементы, в которых в качестве электролита используется паста на основе гидроксида калия, обладают целым рядом преимуществ, в частности существенно большей ёмкостью, лучшей работой при низких температурах и при больших токах нагрузки.
Солевые и щелочные элементы широко применяются для питания радиоаппаратуры и различных электронных устройств.
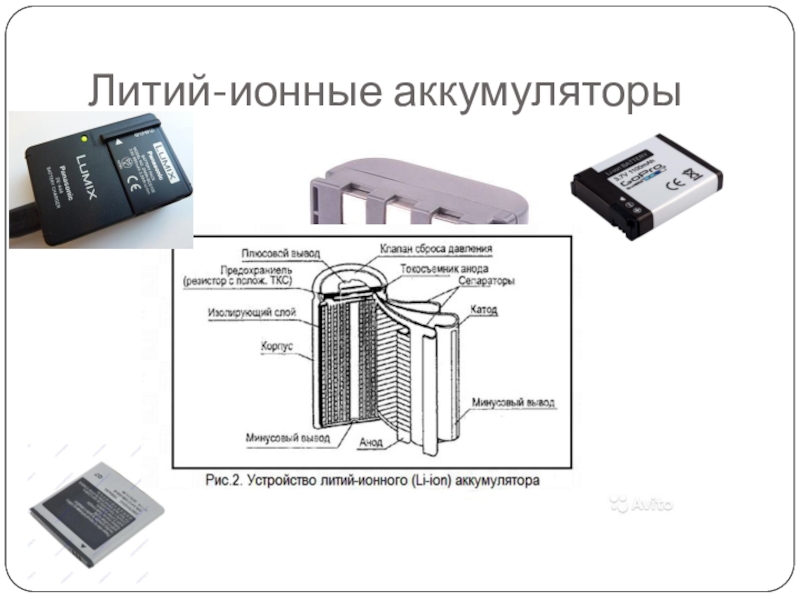
Литий-ионный аккумулятор сотового телефона
Вторичные источники тока (аккумуляторы) — это устройства, в которых электрическая энергия внешнего источника тока превращается в химическую энергию и накапливается, а химическая — снова превращается в электрическую.
Электрохимические генераторы (топливные элементы) — это элементы, в которых происходит превращение химической энергии в электрическую. Окислитель и восстановитель хранятся вне элемента, в процессе работы непрерывно и раздельно подаются к электродам. В процессе работы топливного элемента электроды не расходуются. Восстановителем является водород (H2), метанол (CH3OH), метан (CH4) в жидком или газообразном состоянии. Окислителем обычно является кислород воздуха или чистый. В кислородно-водородном топливном элементе со щелочным электролитом происходит превращение химической энергии в электрическую. Энергоустановки применяются на космических кораблях, они обеспечивают энергией космический корабль и космонавтов.

Слайд 29Практическое применение
Батарейки используются в системе сигнализации, фонарях, часах, калькуляторах, аудиосистемах,
игрушках, радио, автооборудовании, пультах дистанционного управления.
Аккумуляторы используются для запуска двигателей
машин, возможно так же и применение в качестве временных источников электроэнергии в местах, удаленных от населенных пунктов.
Топливные элементы применяются в производстве электрической энергии (на электрических станциях), аварийных источниках энергии, автономном электроснабжении, транспорте, бортовом питании, мобильных устройствах.