Слайд 1Урок-исследование по теме :
«Количество вещества. Моль. Молярная масса. Молярный объем.»
Слайд 2Задачи урока:
1. Продолжить формирование понятий: количество вещества, моль, молярная масса,
число Авогадро, молярный объем, закон Авогадро.
2. Выявить их взаимосвязь, пользоваться
ими при решении экспериментальных задач.
3. Вспомнить правила определения массы вещества и объема с помощью весов и измерительного цилиндра.
4. Закрепить навыки решения задач по данной теме.
Слайд 3Эпиграф:
О, физика – наука из наук!
Все впереди!
Как мало за плечами!
Пусть
химия нам будет вместо рук.
Пусть станет математика очами.
Не разлучайте этих
трех сестер
Познания всего в подлунном мире,
Тогда лишь будет ум и глаз остер
И знанье человеческое шире.
(отрывок из поэмы М. Алигер
“Ленинские горы”)
Слайд 4 1. Что такое количество вещества?
2. Что такое моль?
4. Сколько структурных единиц содержится в 1 моле?
5. Через
какие величины можно определить количество вещества?
6. Что такое Молярная масса, с чем численно совпадает?
Масса 3 моль H2O составляет ______________
Масса 20 моль СО2 составляет ____________
7. Что такое молярный объем?
Экспресс-опрос:
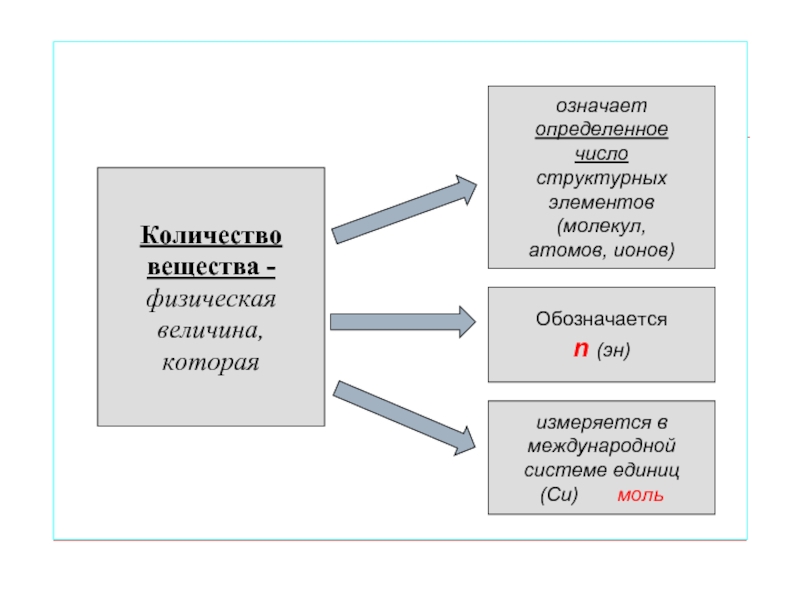
Слайд 5
Количество
вещества -
физическая
величина,
которая
означает
определенное
число
структурных
элементов
(молекул,
атомов, ионов)
Обозначается
n (эн)
измеряется в
международной
системе единиц
(Си) моль
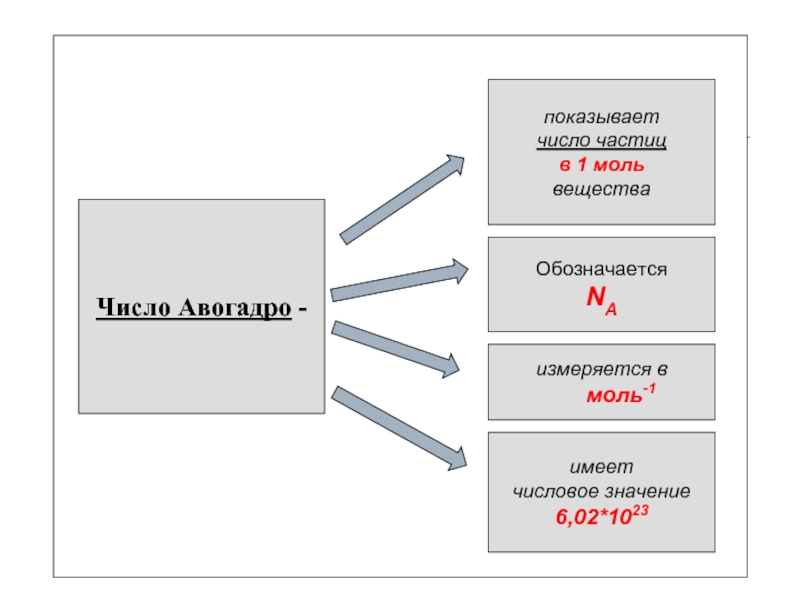
Слайд 6
Число Авогадро -
показывает
число частиц
в 1 моль
вещества
Обозначается
NA
измеряется
в
моль-1
имеет
числовое значение
6,02*1023
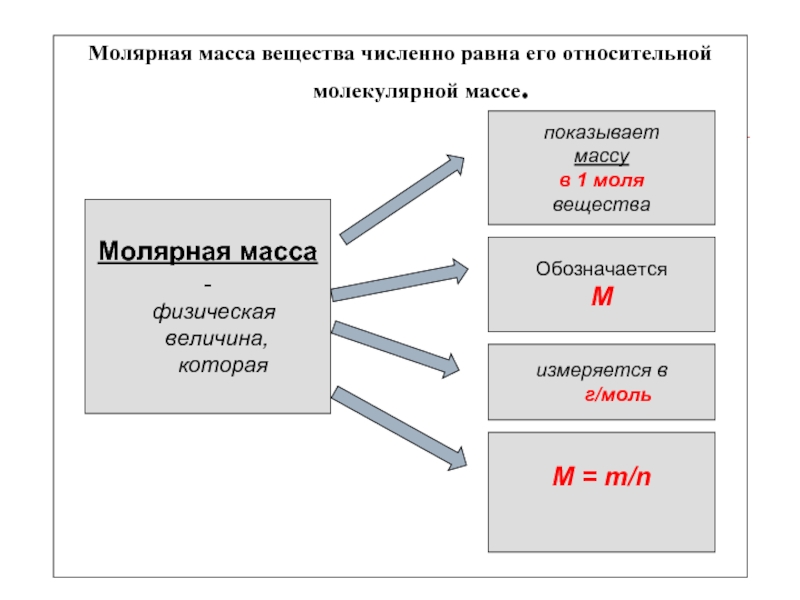
Слайд 7
Молярная масса вещества численно равна его относительной молекулярной
массе.
Молярная масса -
физическая
величина,
которая
показывает
массу
в 1
моля
вещества
Обозначается
М
измеряется в
г/моль
М = т/n
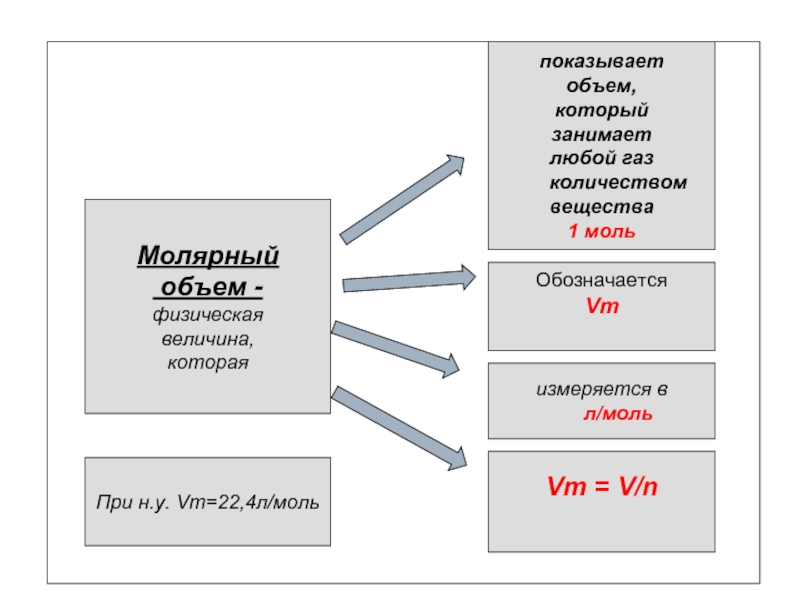
Слайд 8
Молярный
объем -
физическая
величина,
которая
показывает
объем,
который
занимает
любой газ
количеством
вещества
1 моль
Обозначается
Vm
измеряется в
л/моль
Vm = V/n
При н.у. Vm=22,4л/моль
Слайд 9Теоретическое исследование
Задача 1.
В стратосфере на высоте
20-30 км находится слой озона О3, защищающий Землю от мощного
ультрафиолетового излучения Солнца. Если бы не «озоновый экран» в атмосфере, то фотоны с большой энергией достигали бы поверхности Земли и уничтожали на ней все живое. Подсчитано, что в среднем на каждого жителя Саранска в воздушном пространстве над городом (вплоть до верхней границы стратосферы) приходится по 10 моль озона. Сколько молекул 03 и какая масса озона приходится в среднем на одного жителя Саранска?
Слайд 10Теоретическое исследование
Задача 2.
Рассчитайте объем, который занимает (при
н. у.) порция газа, необходимого для дыхания, если в
этой порции содержится 2,69 • 1022 молекул этого газа. Какой это газ?
Слайд 11Практическое исследование
Задание №1.
Каждый день мы употребляем сахар,
например, когда пьем
чай.
Но вы когда-нибудь задумывались:
1. сколько моль сахара содержится
в кусочке рафинада?
2. какое количество сахарозы вы выпиваете с чаем?
Слайд 12
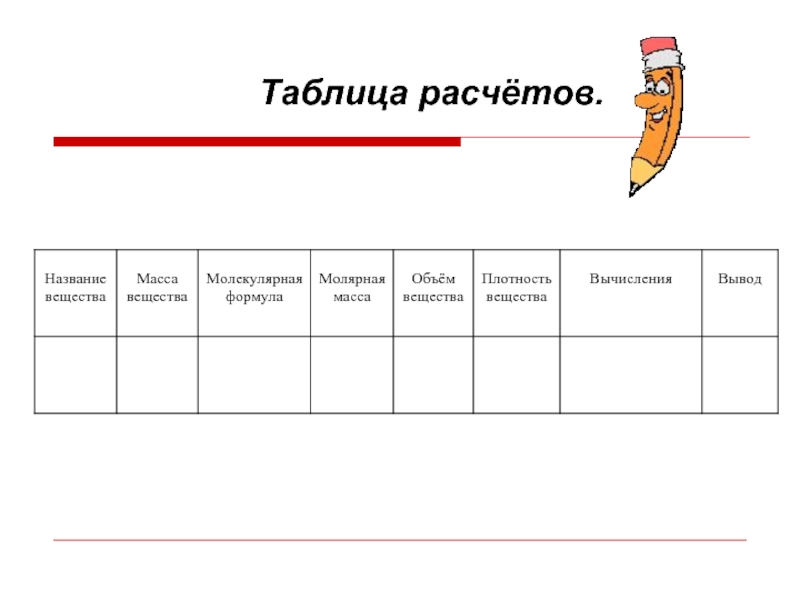
Карта исследования по теме:
«Количество вещества. Моль. Молярная масса».
Оборудование: Весы
с разновесами, мерный цилиндр, химический стакан, столовая ложка, фильтровальная бумага.
Вещества: Вода, сахар рафинад.
Порядок выполнения работы:
Вспомните правила взвешивания (см. Приложение 1).
В таблице расчетов запишите молекулярную формулу сахара, если известно, что в состав её молекулы входят двенадцать атомов углерода, двадцать два атома водорода, и одиннадцать атомов кислорода.
Подсчитайте её молекулярную массу и результат запишите в таблицу.
На весах взвесьте 1 кусочек рафинада, сделайте соответствующие расчёты в таблице и определите, какое количество сахарозы вы выпиваете с чаем.
Слайд 14Карта исследования по теме:
«Количество вещества. Моль. Молярная масса».
В мерный цилиндр
отмерьте 70 мл воды. Определите, какое количество моль воды содержится
в этом объёме.
Вспомните правила определения объёма жидкости (см. Приложение 2).
Посчитайте количество молекул напитка, если известно, что в стакане 50 мл.
Сделайте вывод по работе.
Слайд 15Практическое исследование
Задание №2.
Вам нужно приготовить сахарный
сироп, например, для десерта (он готовится в отношении сахара к
воде 2:1).
Слайд 16Практическое исследование
Задание №3.
Пока вы проводили расчёты, я вам
разлила в стаканчик минеральную воду, объемом 50 мл. Вы можете
выпить её и ответить на вопрос: Сколько молекул этого напитка вы сейчас проглотили?
Что нужно для этого знать?
Слайд 17Вывод:
Зная массу вещества и
объём, можно найти количество вещества, а по количеству вещества можно
определить m, N, V, т.е. все эти величины взаимосвязаны.
Слайд 18 Домашнее задание:
Повторить п.13-16, задача 5 на стр.58
Слайд 20
Презентация разработки темы в курсе
8 класса.
Подготовила учитель
химии
ОГРИНА
СВЕТЛАНА ЮРЬЕВНА