Слайд 1
Автор учитель физики
МОУ Остафьевская школа
Антюхина В.Д.
О том, как работает атом
Слайд 2Цели и задачи
1. Познакомить учащихся с взглядами на строение атома,
существовавших до начала XIX века.
2. Рассказать о ядерной модели атома
Резерфорда
3.Показать, чем отличаются друг от друга атомы различных химических элементов.
4. Показать строение атомов водорода, дейтерия, трития.
Слайд 3Взгляды учёных на строение атома
В начале XIX века в физике
бытовали самые разные и часто фантастические представления о строении атома.
Например, ректор Мюнхенского университета Фердинанд Линдеман в 1905 году утверждал, что « атом кислорода имеет форму кольца, а атом серы – форму лепёшки».
Слайд 4Модель атома по Дж. Томсону.
Дж. Томсон в
1898 году предложил модель атома в виде положительно заряженного шара
радиусом 10-10 м, в котором « плавают» отрицательные электроны, размеры которых 10-13 м. Сам Томсон относился к своим моделям без энтузиазма.
Слайд 5Русские физики
Вопрос о строении атома изучали и русские физики:
Пётр Николаевич Лебедев
И известный учёный – народник Николай Морозов
Слайд 6Атом, атомная физика, атомный век…
Мы чуть не
с пелёнок слышим со всех сторон: атом, атомная физика, атомная
энергия, атомная электростанция, атомная подводная лодка, атомный век…
Известно, что атомы – это крошечные частички, из которых состоит всё на свете: воздух, вода, земля, еда, Солнце, звёзды…
Слайд 7Опыты Резерфорда.
В 1911 году Резерфорд со своими сотрудниками провёл
ряд опытов по исследованию состава и строения атомов.
Слайд 8Строим модель атома. Как выглядит атом? Что у него внутри?
Если
изобразить «детали» из которых состоит атом, пластилиновыми шариками:
Красный –
протон,
зелёный – нейтрон,
синий - электрон
Слайд 9Модель самого простого атома.
Возьмём красный шарик - протон и синий
– электрон и соединим их ниткой.
Протон – частица неповоротливая, он
в две тысячи раз тяжелее электрона. Неудивительно, что протон «сидит»в центре атома, а легкий и непоседливый электрон крутится вокруг него, словно спутник вокруг Земли.
Слайд 10Модель атома самого лёгкого газа.
Самый лёгкий газ – водород. Он
в 15 раз легче воздуха, поэтому наполненный водородом дирижабль всплывает
в воздушном океане, словно поплавок
Слайд 11« Воздушные шарики»
Шары, которые подняли в воздух одного из героев
сказки Юрия Олеши «Три толстяка», были наполнены водородом…
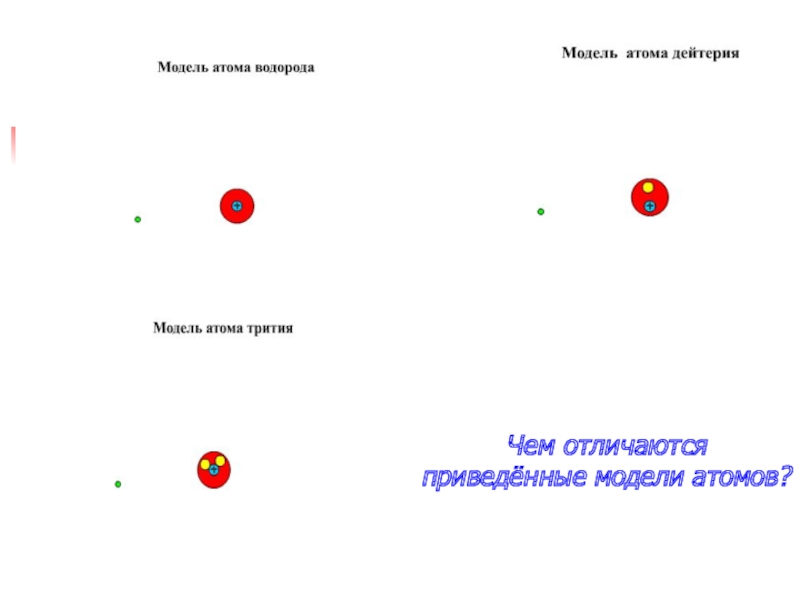
Слайд 12Дейтерий
Лёгкий водород можно сделать потяжелее, если присоединить к протону нейтрон.
Вот теперь в атоме все три детали: протон, нейтрон и
электрон. Это тяжёлый водород - дейтерий.
Слайд 13Тритий
Но можно сделать водород ещё тяжелее, присоединив к протону
не один, а два нейтрона – получаем сверхтяжёлый водород –
тритий.
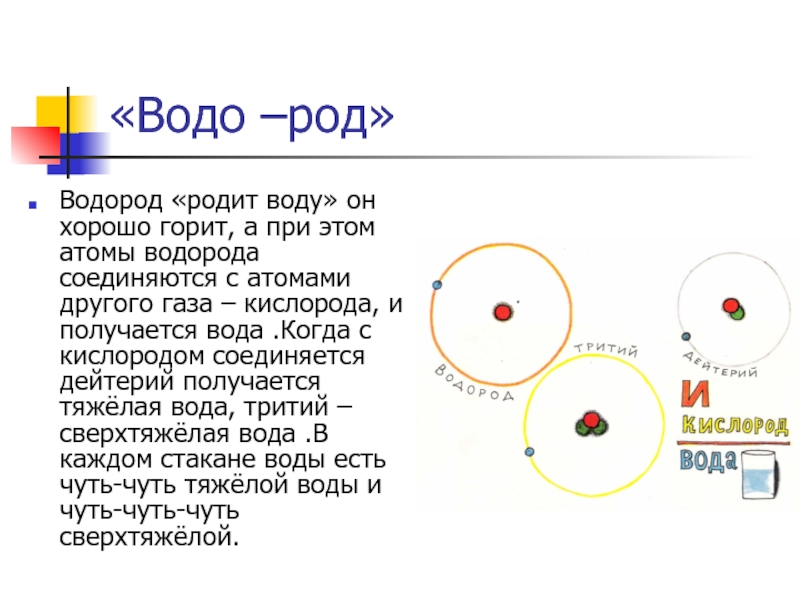
Слайд 14«Водо –род»
Водород «родит воду» он хорошо горит, а при этом
атомы водорода соединяются с атомами другого газа – кислорода, и
получается вода .Когда с кислородом соединяется дейтерий получается тяжёлая вода, тритий – сверхтяжёлая вода .В каждом стакане воды есть чуть-чуть тяжёлой воды и чуть-чуть-чуть сверхтяжёлой.
Слайд 15Модель атома гелия
Если теперь в ядре атома будет два протона,
два нейтрона, а вокруг них будут вращаться два электрона, то
получим модель атома совсем другого газа – гелия.
Слайд 17Чем отличаются приведённые модели атомов?
Слайд 18Источники информации
Константиновский М.А. О том, как устроен атом .Издательство «Малыш»1978г.
Полянский
С.Е. Поурочные разработки по физике. Москва. «ВАКО» 2004г.
Перышкин А.В. Физика-8.
«Дрофа» 2001
Мякишев Г.Я Буховцев Б.Б. Физика -11 «Просвещение»