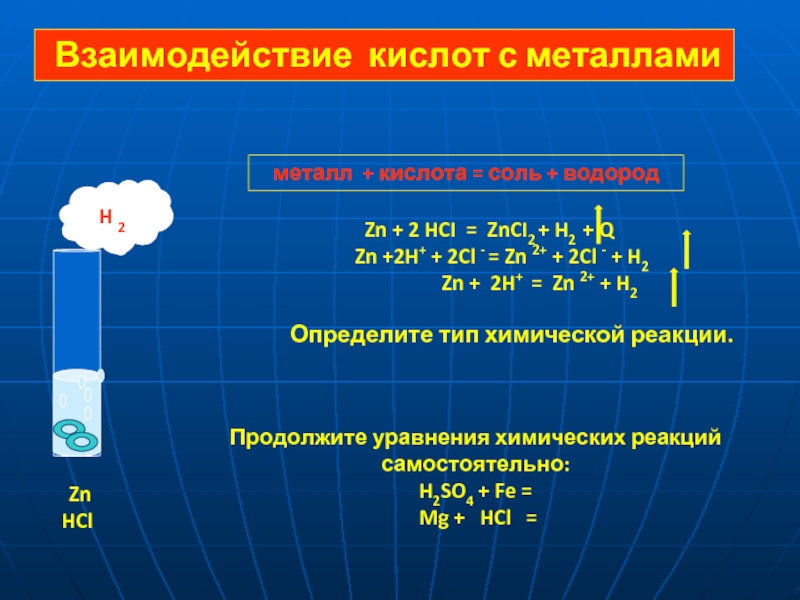
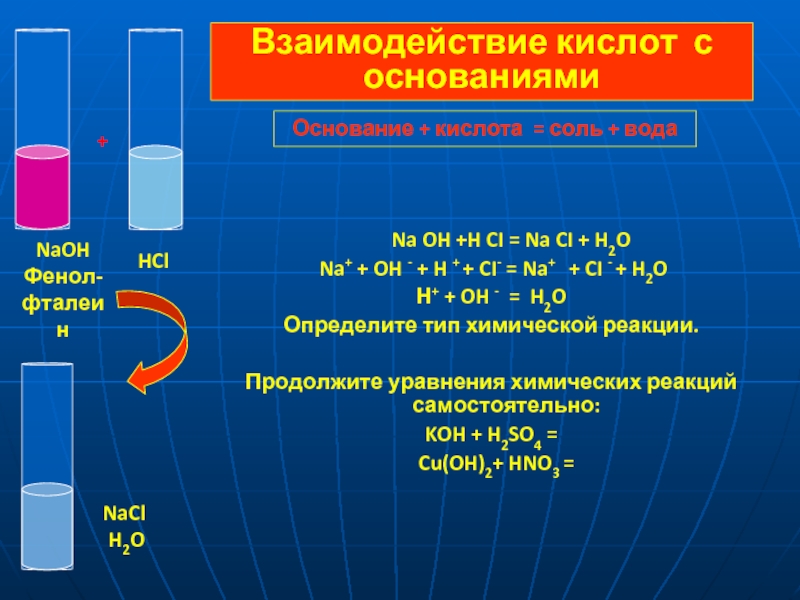
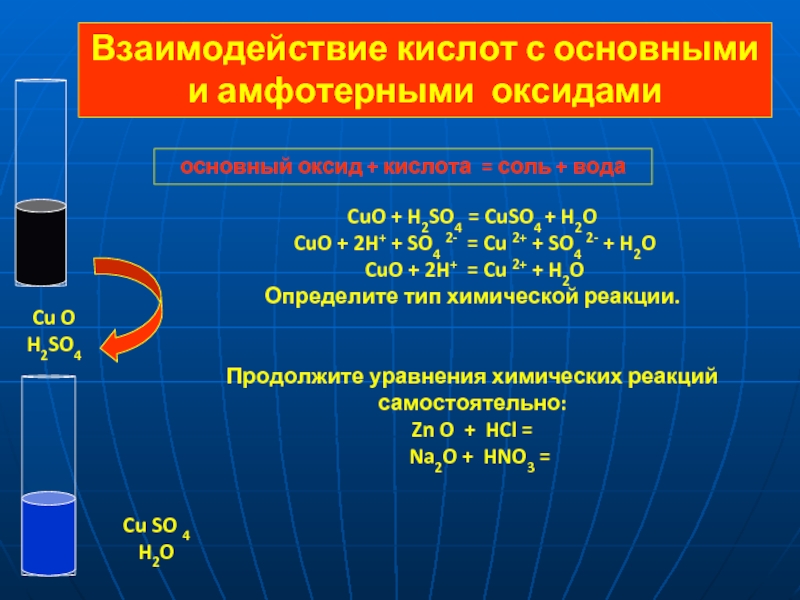
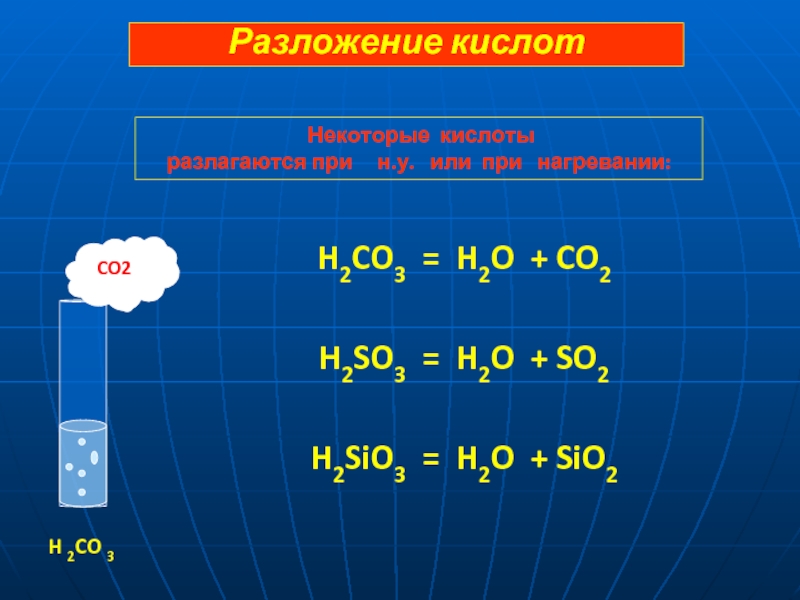
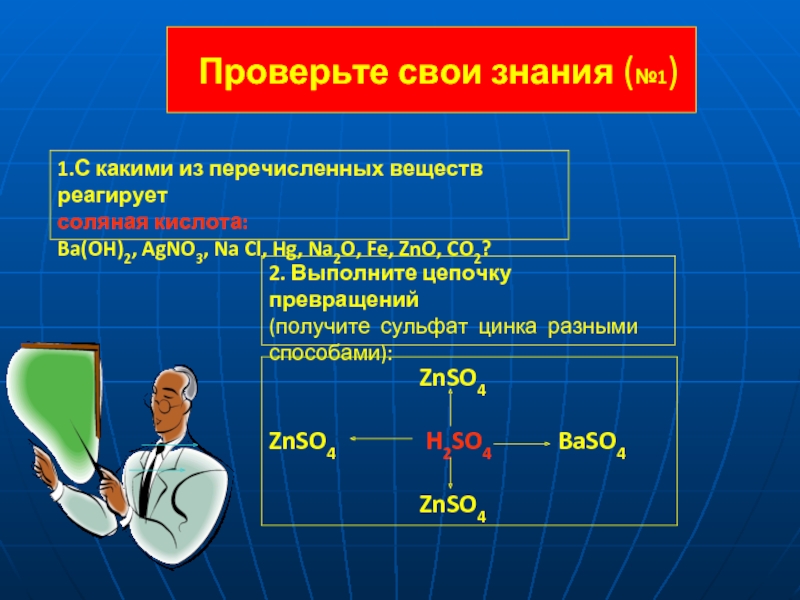
= 2 H+ + SO42-
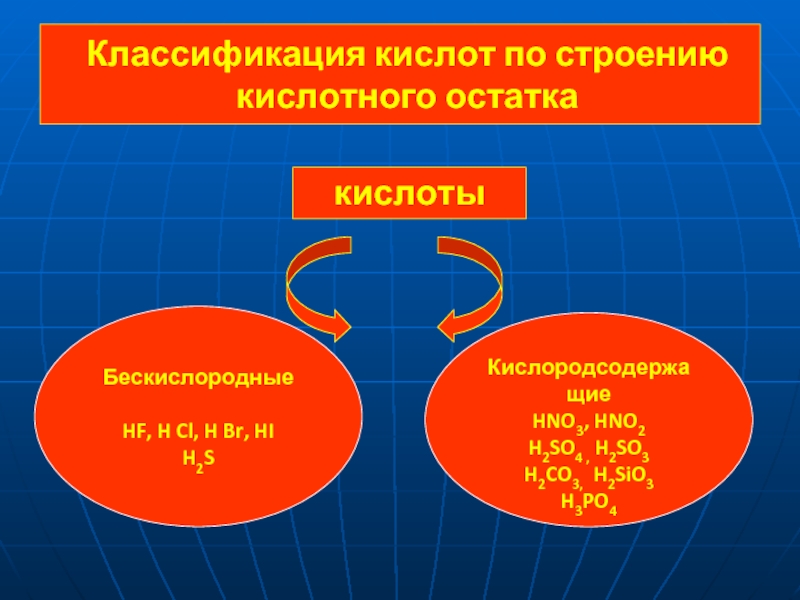
Кислоты – это электролиты,
которые
при диссоциации образуют катионы водородаи анионы кислотного остатка.
Что такое кислоты?
Кислотами называют сложные вещества, молекулы которых состоят из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков.