Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Жёсткость воды и здоровье человека
Содержание
- 1. Жёсткость воды и здоровье человека
- 2. Вода .Одно из самых распространённых веществ в
- 3. Без воды невозможно существование живых организмов. Около
- 4. В природных водах постоянно присутствуют ионы Ca2+
- 5. Общая жёсткость воды определяется содержанием в ней
- 6. Жёсткость бывает временной и постоянной. Временную жёсткость
- 7. Постоянная жёсткость обусловливаются присутствием в природной воде растворимых хлоридов и сульфатов кальция и магния.
- 8. По содержанию в воде ионов Ca2+ и
- 9. Жёсткость воды в различных городах разная. И
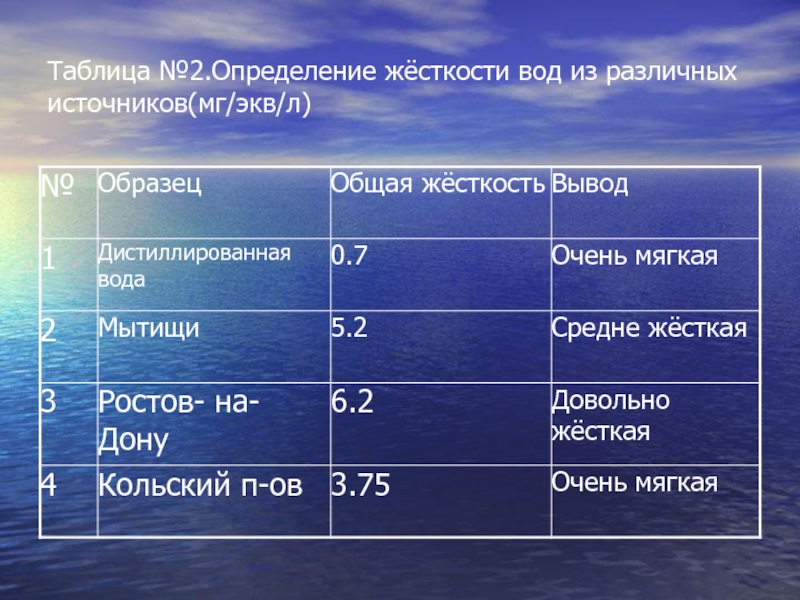
- 10. Таблица №2.Определение жёсткости вод из различных источников(мг/экв/л)
- 11. В последнее время появилось множество смягчителей воды,
- 12. Для этого мы определили жёсткость воды с
- 13. Как видно из полученных данных «Калгон» действительно
- 14. Во многих семьях используют фильтры для очистки
- 15. Таблица№4. Изменение жёсткости воды под действием фильтров(мг/экв/л)
- 16. Выводы1.В ходе нашей работы мы выяснили, что
- 17. Скачать презентанцию
Вода .Одно из самых распространённых веществ в природе. Гидросфера занимает 71% поверхности Земли. Воде принадлежит важнейшая роль в геологической истории планеты. Она- обязательный компонент практически всех технологических процессов как промышленных так
Слайды и текст этой презентации
Слайд 2Вода .Одно из самых распространённых веществ в природе. Гидросфера занимает
71% поверхности Земли. Воде принадлежит важнейшая роль в геологической истории
планеты. Она- обязательный компонент практически всех технологических процессов как промышленных так сельско- хозяйственных.Слайд 3Без воды невозможно существование живых организмов. Около 65% человеческого тела
составляет вода
А какую красоту она нам подарила! Водопады, гейзеры,
океаны, моря, реки- за всё это мы должны благодарить воду. Дождь, снег, град- всё это вода.Почему же вода из разных источников имеет разный вкус, в ней по разному пенится мыло и на стенках чайников оседает разная накипь?
Слайд 4В природных водах постоянно присутствуют ионы Ca2+ и Mg2+, которые
обуславливают общую жёсткость. Основной источник их поступления в воду- растворение
пород, содержащих известняки, доломит, гипс, сложные алюмосиликаты. Жёсткая вода образует плотные слои накипи на внутренних стенах паровых котлов и кипятильников, в ней плохо развариваются пищевые продукты, при стирке белья в жёсткой воде расходуется больше мыла.Слайд 5Общая жёсткость воды определяется содержанием в ней ионов Ca2+ и
Mg2+.В сумме карбонатная и некарбонатная жёсткость воды даёт жёсткость общую.
Слайд 6Жёсткость бывает временной и постоянной. Временную жёсткость обуславливают в растворимом
виде гидрокарбонаты металлов, остающихся в воде. При кипячении воды гидрокарбонаты
разлагаются и выпадают в осадок. Нарастания таких осадков на стенках паровых котлов, труб неминуемо ведёт к авариям. Это является серьёзной причиной необходимости устранения жёсткости воды.Слайд 7Постоянная жёсткость обусловливаются присутствием в природной воде растворимых хлоридов и
сульфатов кальция и магния.
Слайд 8По содержанию в воде ионов Ca2+ и Mg2+ воды делятся
на следующие группы: Таблица№1.Типы вод в зависимости от содержания ионов
Ca2+ и Mg2+ («Основы химического анализа»В. И. Астафуров).Слайд 9Жёсткость воды в различных городах разная. И чтобы это проверить
мы собрали образцы водопроводной воды из 3-ёх городов России. Естественно
что содержание ионов Ca2+ и Mg2+ в водопроводной воде отражает их содержание в природных водах. После анализа мы получили следующие данныеСлайд 11В последнее время появилось множество смягчителей воды, защищающих стиральные машины
от накипи. Одновременно производители стиральных порошков ввели компоненты предотвращающие образование
накипи, в состав большинства стиральных препаратов.Так стоит ли, покупая стиральный порошок, приобретать ещё и смягчитель воды к нему?
Слайд 12Для этого мы определили жёсткость воды с добавкой- «Калгон» и
с 4-мя различными видами стиральных порошков без добавления «Калгона». Также
в один из образцов добавили соду.Результаты опыта предоставлены в таблице. Таблица №3.Изменение жёсткости воды под действием стиральных порошков и смягчителей воды (мг/экв/л)Слайд 13Как видно из полученных данных «Калгон» действительно снижает жёсткость воды.
Стиральные порошки типа «Ваниш», «Персил» и «Красная цена» тоже неплохо
умягчают воду.Слайд 14
Во многих семьях используют фильтры для очистки воды.Мы решили проанализировать
пропущенную через фильтры воду. Результаты предоставлены в таблицы.
Слайд 16Выводы
1.В ходе нашей работы мы выяснили, что воды из различных
источников значительно различаются по содержанию солей кальция и магния, так
жёсткость на юге (Ростов-на-Дону) почти в 2 раза выше, чем на севере (Кольский п-ов)2.В современных стиральных порошках содержатся компоненты (полифосфаты), снижающие жёсткость воды.
3.Бытовые фильтры достаточно хорошо умягчают воду, снижая содержание кальция и магния почти в 2 раза
Теги