Слайд 1Вода и ее жизненно-важные свойства
Автор: Леванова Анастасия, ученица 8 класса
МОКУ СОШ п. Зенгино.
Слайд 2 Вода - наиболее распространенное на Земле вещество. Ее
количество достигает 1018 тонн, и она покрывает приблизительно четыре пятых
земной поверхности. Это единственное химическое соединение, которое в природных условиях существует в виде жидкости, твердого вещества (лед) и газа (пары воды). Вода играет жизненно важную роль в промышленности, быту и в лабораторной практике; она совершенно необходима для поддержания жизни. Приблизительно две трети человеческого тела приходятся на долю воды, и многие пищевые продукты состоят преимущественно из воды.
Слайд 3 Вода представляет собой прозрачную бесцветную жидкость, обладающую целым
рядом аномальных физических свойств. Например, она имеет аномально высокие температуры
замерзания и кипения, а также поверхностное натяжение. Ее удельные энтальпии испарения и плавления (в расчете на 1 г) выше, чем почти у всех остальных веществ. Редкой особенностью воды является то, что ее плотность в жидком состоянии при 4°С больше плотности льда. Поэтому лед плавает на поверхности воды. Наиболее полно изучены свойства воды, благодаря которым возникла жизнь. Эти свойства сделали возможным существование живой природы в том диапазоне температур, который характерен для Земли как космического тела. Какие же это свойства?
Слайд 4
Плотность воды
Одно из важнейших свойств
воды - ее плотность. Максимальную плотность пресная вода имеет при
4 °С. При этой температуре один килограмм воды занимает минимальный объем (рис. 1). При понижении температуры от 4 °С до 0 плотность воды уменьшается, т. е. вода с температурой 4°С находится внизу, а более холодная поднимается наверх, где и замерзает, превращаясь в лед.
Слайд 5 Плотность обычного льда - твердой кристаллической фазы воды
- меньше плотности воды, поэтому лед плавает на поверхности, предохраняя
воду от дальнейшего охлаждения. Он выступает в роли ледяной «шубы», защищающей пресноводный объект от полного промерзания. Так формируются условия для жизни обитателей водоемов при низких температурах.
Слайд 6Термодинамические свойства воды
Вода имеет особенные, аномальные свойства. В
первую очередь это касается таких термодинамических констант, как теплоемкость воды,
теплота парообразования, скрытая теплота плавления льда. Аномальный характер этих величин определяет большинство физико-химических и биологических процессов на Земле.
Слайд 7 Удельная теплоемкость воды составляет 4,1868 кДж/(кг-К), что почти
вдвое превышает удельную теплоемкость таких веществ, как этиловый спирт (2,847),
растительное масло (2,091), парафин (2,911) и многие другие. А это значит, что при нагревании на одинаковое количество градусов вода способна воспринять почти вдвое больше тепла, чем перечисленные жидкости. Но и при остывании вода отдает больше тепла, чем другие жидкости. Поэтому при нагревании вод Мирового океана под воздействием солнечных лучей и их остывании при отсутствии энергии солнечной радиации теплоемкость выступает как свойство, обеспечивающее минимальные колебания температуры воды днем и ночью, летом и зимой.
Слайд 8 Вода имеет аномально высокие значения и других констант.
Вещества, образованные соединением водорода со стоящими в одном ряду периодической
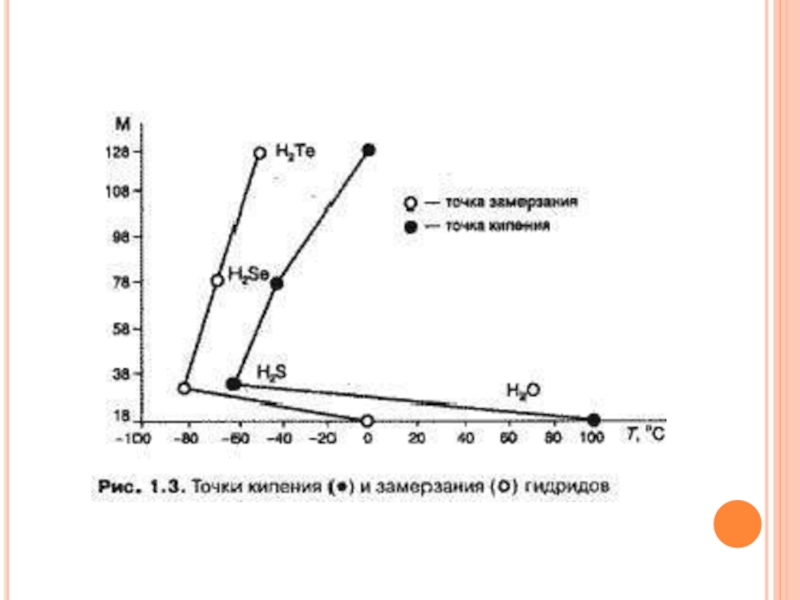
таблицы кислородом, серой, селеном, теллуром, называются гидридами. Гидрид кислорода называется водой. Необычность свойств гидрида кислорода, по сравнению со свойствами других гидридов, заключается в том, что, в отличие от них, вода в обычных условиях (при нормальном давлении и температуре от 0 до 100 °С) находится в жидком состоянии, а не в газообразном. На рис. 2 представлены точки кипения и замерзания гидридов. Если бы вода не обладала аномальными значениями температуры кипения и замерзания, то эти процессы происходили бы при значительно более низких отрицательных температурах, и вода в жидком виде присутствовала бы на более холодных планетах. И следовательно, жизни на Земле не было бы.
Слайд 10Сила поверхностного натяжения воды
Есть и другие особые свойства
воды, которые позволяют назвать ее поистине удивительнейшим соединением. Речь идет
о поверхностном натяжении жидкости. Силы взаимодействия молекул, составляющих воду, притягивают их друг к другу, и разорвать эту связь не так просто.
Слайд 11 Большинству людей известен школьный опыт, когда осторожно положенная
в блюдце с водой иголка плавает на поверхности. Многие видели
интереснейший фокус, когда в полный стакан воды опускают значительное количество монет и вода, не переливаясь через край, поднимается небольшим куполом. Наконец, известна библейская легенда о том, как Христос шел по воде. Все эти явления и легенды связаны с большим поверхностным натяжением воды. Благодаря поверхностному натяжению, вода поднимается по капиллярным каналам в грунте на поверхность Земли, поступает в ткани и клетки растений и живых организмов. Из всех известных жидкостей только у ртути сила поверхностного натяжения выше, чем у воды. Известна очень интересная особенность воды, связанная с распространением в ней звуковых волн. Скорость распространения звука в воде аномально высока, она превышает скорость его распространения в воздухе почти в 6 раз.
Слайд 12 Это были особенные свойства воды. Каковы же ее
основные свойства при нормальном, пониженном и повышенном атмосферном давлении?
Слайд 13Свойства чистой воды
Чистая вода представляет собой прозрачную жидкость
без цвета и запаха. При давлении 1 атом вода замерзает
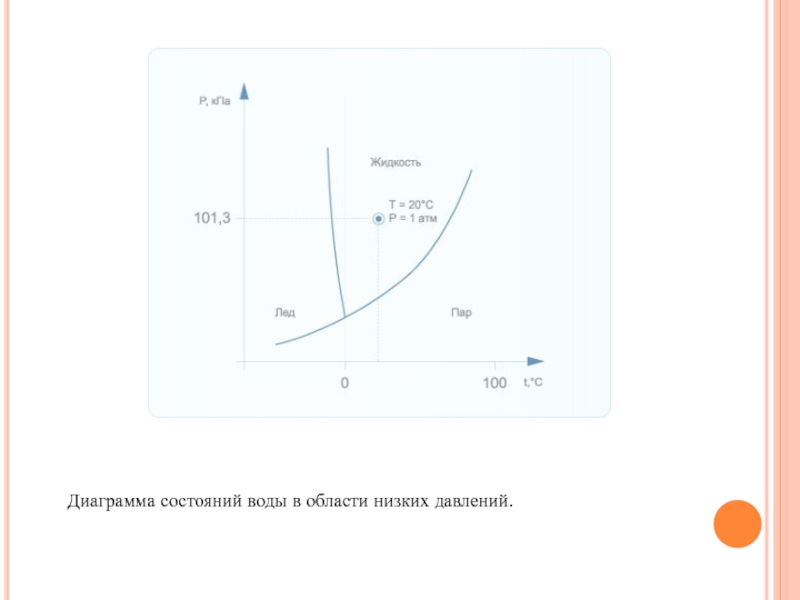
при температуре 0, а кипит при 100 °С. При повышении давления вдвое вода закипает при температуре 120 °С, а при понижении вдвое - при 81 °С. Однако при уменьшении давления температура плавления льда (или замерзания воды) повышается. Диаграмма состояний воды в области низких давлений представлена на рис. 3. Видно, что при низких давлениях вода может существовать только в виде льда или пара, а при высоких температурах - только в виде пара. Существуют также критические значения давления и температуры воды. При давлении свыше 22,1 атм. и температуре свыше 374,4°С исчезает разница между жидкостью и паром вода существует в газообразном состоянии.
Слайд 14Диаграмма состояний воды в области низких давлений.
Слайд 15Удивительные значения давления и температуры атмосферы сложились на Земле, так
как именно при этих значениях вода присутствует на планете в
жидком виде, обеспечивая развитие всех существующих форм жизни. При этих параметрах происходит растворение в воде кислорода, необходимого для жизни водных организмов, а также для протекания процессов самоочищения воды. На протяжении многих тысячелетий наличие атмосферы, гидросферы и солнечного излучения создавало незначительный перепад температур летом и зимой, днем и ночью, обеспечивая условия для существования жизни.
Слайд 16Способность воды к растворению
Самая удивительная особенность воды -
ее способность растворять другие вещества и ковалентные соединения. Вода широко
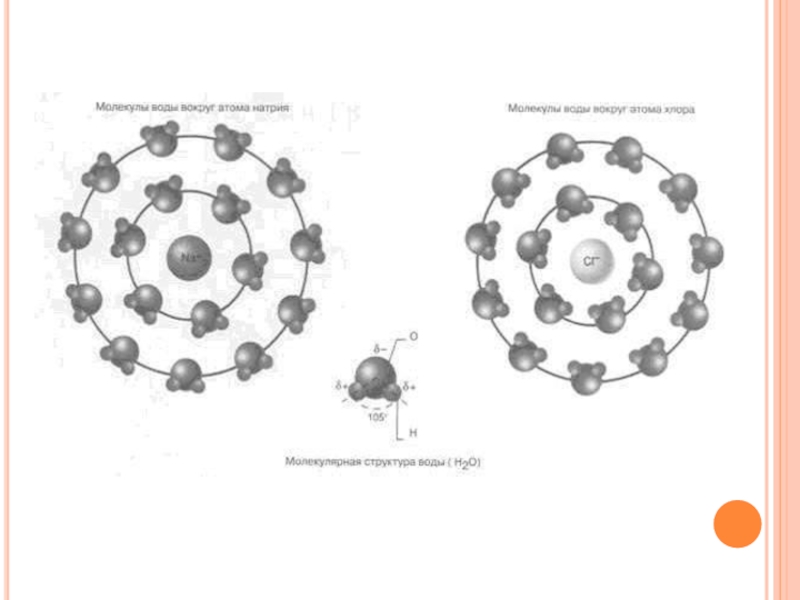
используется в качестве растворителя в химической технологии, а также в лабораторной практике. Она представляет собой универсальный растворитель, необходимый для протекания биохимических реакций. Способность воды хорошо растворять многие вещества обусловлена полярностью ее молекул. Молекула воды обладает сравнительно большим дипольным моментом. Поэтому при растворении в ней ионных веществ молекулы воды ориентируются вокруг ионов, т.е. сольватируют их. Водные растворы ионных веществ являются электролитами.
Слайд 18 Растворимость ковалентных соединений в воде зависит от их
способности образовывать водородные связи с молекулами воды. Водородные связи -
это диполь - дипольные взаимодействия между атомами водорода в молекулах воды и электроотрицательными атомами молекул растворенного вещества. Простые ковалентные соединения, как, например, диоксид серы, аммиак и хлороводород, растворяются в воде. Кислород, азот и диоксид углерода плохо растворяются в воде. Многие органические соединения, содержащие атомы электроотрицательных элементов, как, например, кислорода или азота, растворимы в воде. В качестве примера укажем этанол С2Н5ОН, уксусную кислоту СН3СООН, сахар С12Н22О6 и диэтиламин (C2H5)2NH. Присутствие в воде нелетучих растворенных веществ, например хлорида натрия или сахара, понижает давление пара и температуру замерзания воды, но повышает ее температуру кипения.
Слайд 19 В земной воде всегда что-то растворено. Это
могут быть газы, молекулы или ионы химических элементов. Считается, что
в водах Мирового океана могут быть растворены все элементы таблицы периодической системы элементов, по крайней мере, на сегодня их обнаружено более 80. Вода в природных условиях всегда содержит растворённые соли, газы и органические вещества. Их количественный состав меняется в зависимости от происхождения В. и окружающих условий. При концентрации солей до 1 г/кг воду считают пресной, до 25 г/кг - солоноватой, свыше - солёной. Наименее минерализованными водами являются атмосферные осадки (в среднем около 10-20 мг/кг), затем пресные озёра и реки (50-1000 мг/кг). Солёность океана колеблется около 35 г/кг; моря имеют меньшую минерализацию (Чёрное 17-22 г/кг; Балтийское 8-16 г/кг; Каспийское 11-13 г/кг). Минерализация подземных вод вблизи поверхности в условиях избыточного увлажнения составляет до 1 г/кг, в засушливых условиях до 100 г/кг, в глубинных артезианских водах минерализация колеблется в широких пределах.
Слайд 20 В пресных водах обычно преобладают ионы HCO3-, Са2+
и Mg2+. По мере увеличения общей минерализации растет концентрация ионов
SO42-, Cl-, Na+ и К+. В высокоминерализованных водах преобладают ионы Cl- и Na+, реже Mg2+ и Ca2+. Прочие элементы содержатся в очень малых количествах, хотя почти все естественные элементы периодической системы найдены в природных водах.
Слайд 21 Из растворённых газов в природных водах присутствуют азот,
кислород, двуокись углерода, благородные газы, редко сероводород и углеводороды. Концентрация
органических веществ невелика - в среднем в реках около 20 мг/л, в подземных водах ещё меньше, в океане около 4 мг/л. Исключение составляют воды болотные и нефтяных месторождений и вод, загрязнённые промышленными и бытовыми стоками, где количество их бывает выше. Качественный состав органических веществ чрезвычайно разнообразен и включает различные продукты жизнедеятельности организмов, населяющих вод, и соединения, образующиеся при распаде их остатков.
Слайд 22Структура молекулы воды
С чем же связана высокая растворяющая способность
воды? Какова структура воды. Как устроена молекула воды? Очевидно, что
все особенности воды определяются теми химическими элементами, которые входят в ее состав. Эти элементы - водород и кислород - широко распространены как в Космосе, так и на Земле. Вода - ковалентное молекулярное соединение. Молекула воды полярна; угол -104,5; связь O-H ковалентная полярная. Вода является дипольным растворителем (растворяет многие газы, жидкие и твёрдые вещества). В каждой ее молекуле атом кислорода имеет две неподелённые пары электронов. Это объясняет изогнутую структуру молекулы воды с тетраэдрическим углом между связями.
Слайд 23Строение атома водорода
Наиболее распространенным во Вселенной элементом является
водород. Атом водорода состоит из одного положительного заряда - протона,
который находится в ядре, и одного отрицательного - электрона, который располагается на орбите. В ядре атома водорода может также находиться несколько нейтральных частиц - нейтронов, Их количество определяет «тяжесть» водорода. На рис. 4 представлено схематическое изображение атома водорода. Водород имеет три изотопа: протий 1H, дейтерий 2Н (или D) и тритий 3Н (или Т). Массовое число, обозначаемое верхним индексом, характеризует количество тяжелых частиц - нуклонов (протонов и нейтронов) - в ядре протия один протон, у дейтерия - один протон и один нейтрон, у трития - один протон и два нейтрона. В природной воде протий и дейтерий содержатся в соотношении 6800:1. Трития в природе ничтожно мало. Хотя положительный заряд ядра равен отрицательному заряду электрона, тем не менее один атом водорода способен заполнять свою единственную оболочку двумя электронами (создавать так называемые водородные связи) или отдавать этот электрон и становиться положительно заряженным ионом Ион водорода постоянно присутствует в воде, и его концентрация определяет один из важнейших показателей качества воды - активную реакцию воды рН.

Слайд 24Схематическое изображение атома водорода
Слайд 25Строение атома кислорода
Кислород - тоже замечательный элемент. Благодаря
незаполненности электронной оболочки, на которой не хватает двух электронов, он
обладает способностью вступать в реакции с другими элементами, являясь одним из самых активных химических элементов. Связанный кислород составляет более 85% гидросферы, более 45% литосферы и более 23% атмосферы. Кислород стоит на первом месте по числу образуемых минералов (1364), в живых организмах содержится около 70% кислорода, он входит в состав важнейших органических соединений - белков, жиров, аминокислот и т. д., в состав скелета. Исключительно велика роль кислорода в биохимических и физиологических процессах, особенно вдыхании. Практически все животные, растения и микроорганизмы (за исключением микробов-анаэробов) получают необходимую для жизнедеятельности энергию за счет биологического окисления различных веществ при помощи кислорода. Все окислительные процессы в природных водах, приводящие к самоочищению водных объектов, также протекают благодаря присутствию в воде кислорода.
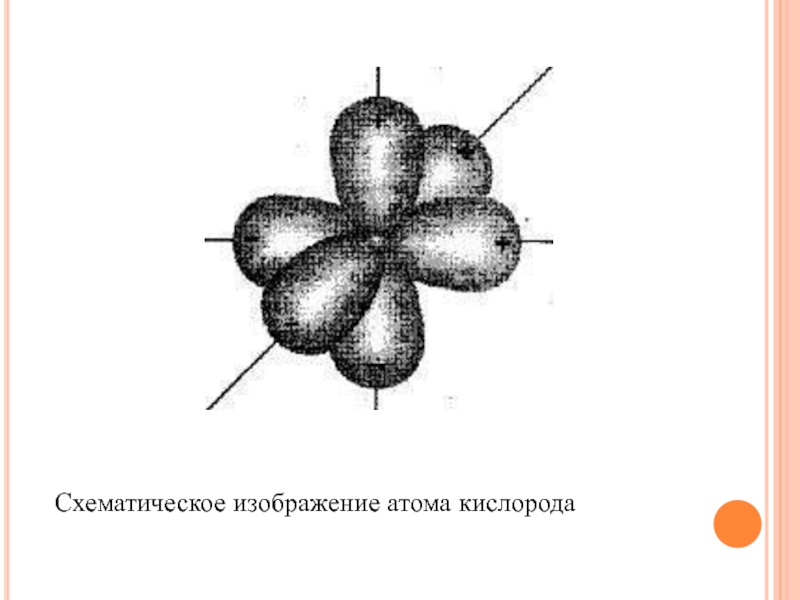
Слайд 26 В природе известны три разновидности кислорода - три
стабильных изотопа кислорода: 16О, 18О (тяжелый) и 17О, среднее содержание
которых составляет соответственно 99,759; 0,204 и 0,037% от общего числа атомов кислорода на Земле. Зги изотопы различаются количеством нейтральных частиц (нейтронов), входящих в состав ядра, при этом количество протонов в ядре одинаково и равно восьми. На рис. 5 приведено схематическое изображение атома кислорода. Особенностью атома кислорода является незаполненность внешней электронной оболочки; для этого не хватает двух электронов. Конфигурация атома кислорода записывается как 1s22s22р4 . Число электронов в атоме кислорода равно сумме верхних индексов при обозначении s- и p-орбиталей. На s-орбитали может присутствовать не более 2 электронов, на трех p-орбиталях - не более 6. S-орбитали у атома кислорода заняты полностью, на одной р-орбитали расположены два парных электрона, а двум p-орбиталям до заполнения не хватает 2 электронов. Способность атома кислорода к взаимодействию с другими веществами определяется именно этим.

Слайд 27Схематическое изображение атома кислорода
Слайд 28Строение молекулы воды
Эти два элемента - водород и
кислород - являются антагонистами. Один из них господствует в Космосе,
другой - на Земле. Один (водород) стремится отдать единственный электрон своей электронной оболочки, а другой (кислород) стремится заполучить два электрона от других химических элементов. Анализируя состав молекулы воды (рис. 6), можно сказать, что в ней два атома водорода и один атом кислорода «нашли друг друга».Таким образом, в составе воды, химическая формула которой записывается как Н20 теоретически могут присутствовать девять различны) стабильных видов воды (число перестановок из 5 по 3) Однако 99,97% всей води - в гидросфере представлено обычной водой вида 1Н2160. доля тяжелой воды 2Н2160 составляет менее 0,02
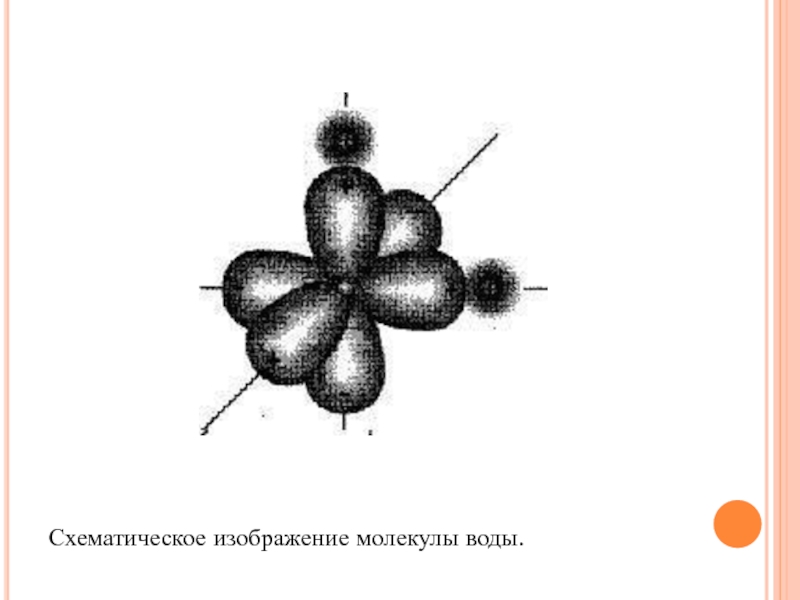
Слайд 29
Схематическое изображение молекулы воды.
Слайд 30
Датский ученый Н. Бьеррум в 1951 г.
предложил модель молекулы воды с точечным распределением зарядов. В соответствии
с современными представлениями, молекула воды представляет собой тетраэдр (или пирамиду), в середине которого размещен центр молекулы, а в углах - электрические заряды.
Слайд 31 Два положительных заряда соответствуют двум атомам водорода, каждый
из которых «предоставил» свои электроны атому кислорода, и т отрицательных
заряда, соответствующих «непарным» электронам кислорода. Таким образом, молекула воды представляет собой диполь, один из полюсов которого имеет положительный заряд, а другой - отрицательный. Полюсы диполя разнесены на некоторое расстояние, поэтому в электростатическом поле диполь воды разворачивается вдоль линий напряженности электрического поля. Если электростатическое поле образовано отрицательно заряженным ионом, то диполь воды разворачивается к этому иону своим положительным полюсом, и наоборот. Свойства воды как растворителя во многом определяются поляризованным строением ее молекулы. Высокая полярность молекул является причиной активности воды при химических взаимодействиях, при растворении в ней солей, кислот и оснований, т. е. при образовании электролитов. Вода способна растворять многие вещества, создавая с ними однородные физико-химические системы переменного состава. Растворенные в природных водах соли находятся в ионном состоянии, т. е. подвергнуты электролитической диссоциации.

Слайд 32
Современной науке известно несколько моделей, с помощью которых можно
разрешить многие аномальные свойства воды. Считается, что некоторые свойства определяются
количеством ассоциаций молекул мономеров (Н2О)1, димеров (Н2О)2 и тримеров (Н2О)3, которые преимущественно присутствуют в воде при различных температурах.
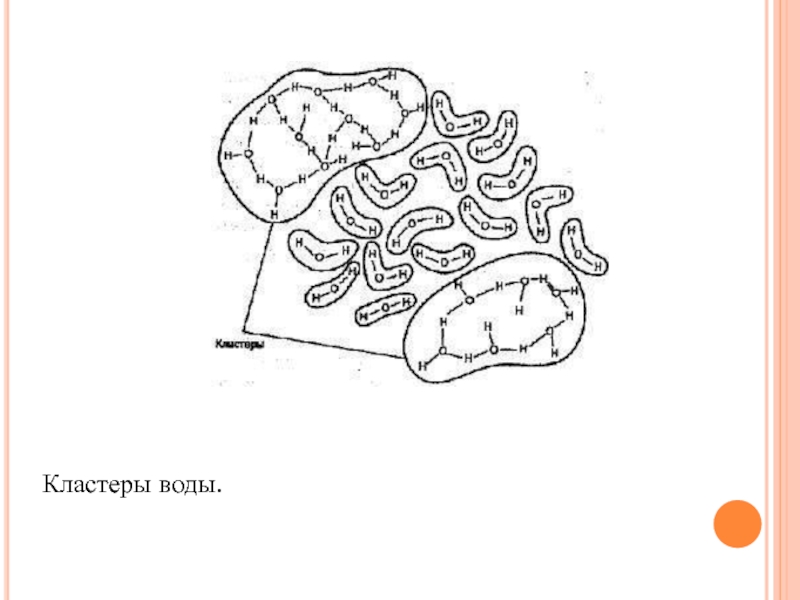
Слайд 34 Так, при температуре около нуля градусов Цельсия в
воде присутствуют в основном тримеры, при температуре около 4°С -
димеры, а в газообразном состоянии вода содержит главным образом мономеры. Иногда эти ассоциации называют тригидролями. Некоторые ученые предлагают рассматривать воду как совокупность ассоциаций молекул, включая при этом в каждую ассоциацию от одной до восьми молекул. Другие считают, что структура воды представляет собой пространственное «кружево», образованное различными «мерцающими кластерами» (рис. 8). Третьи предлагают исследовать свойства воды с учетом особенностей строения ее молекулы, которые, в свою очередь, определяются особенностями составляющих молекулу воды элементов. В соответствии с современными представлениями, молекула воды похожа на маленький магнит.