наука о ферментах, изучающая их строение, свойства, механизмы каталитического действия,
а также пути регуляции ферментативной активности в живых организмах;(Энзимология выделена в самостоятельную науку в 17 веке)
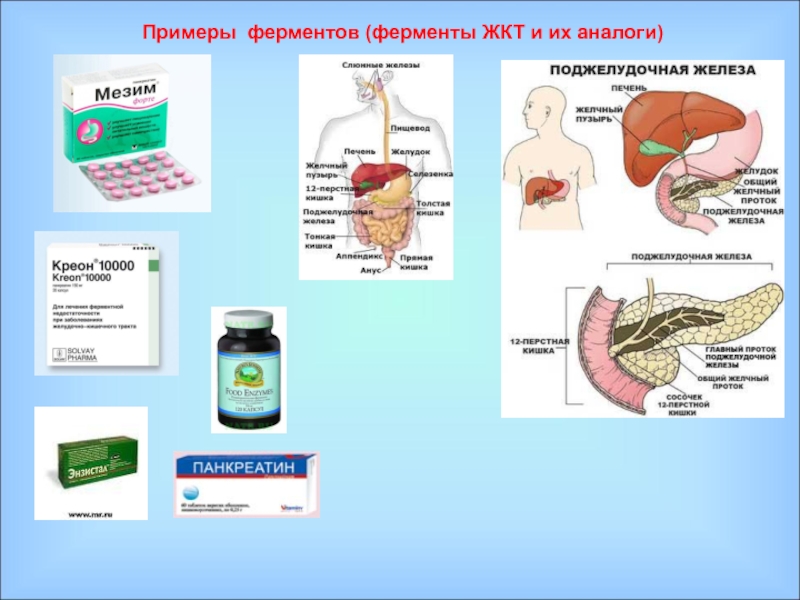
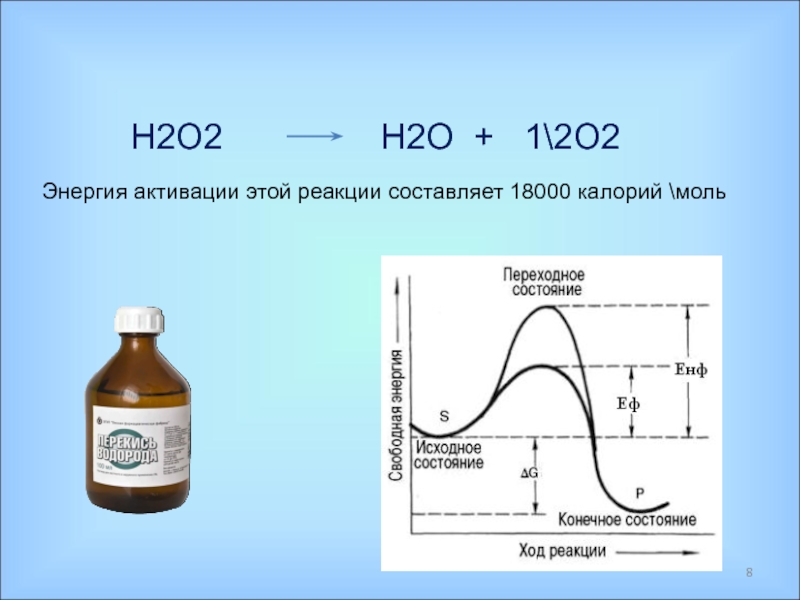
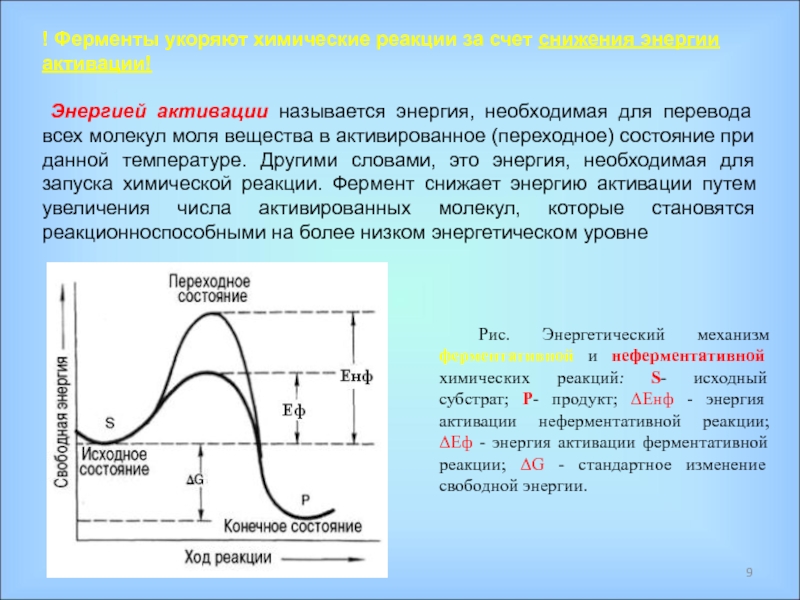
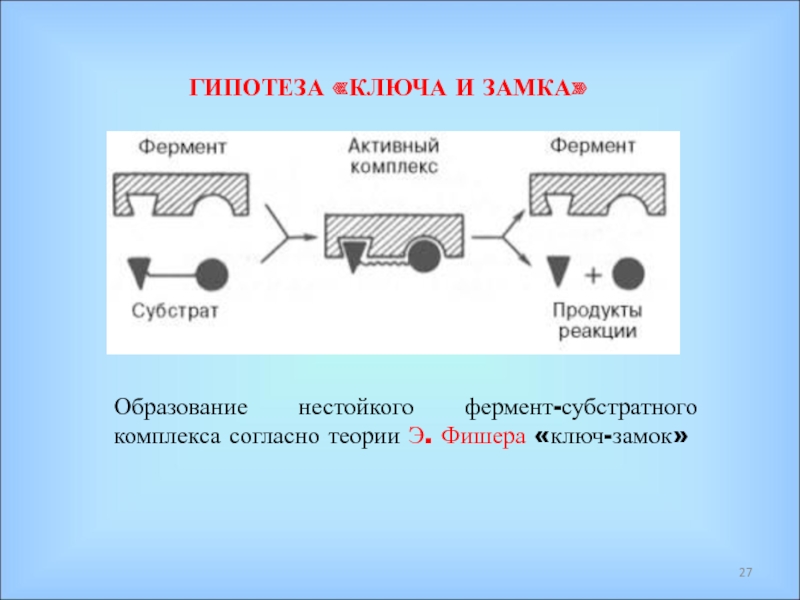
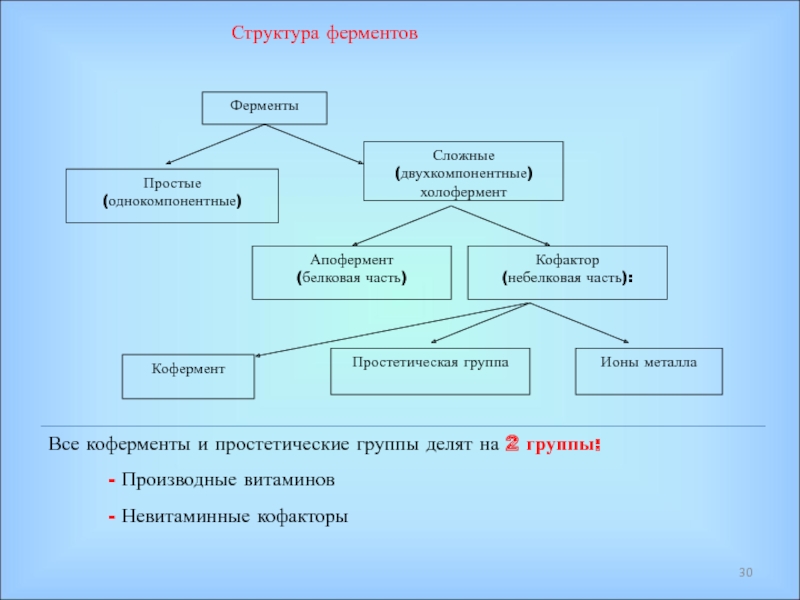
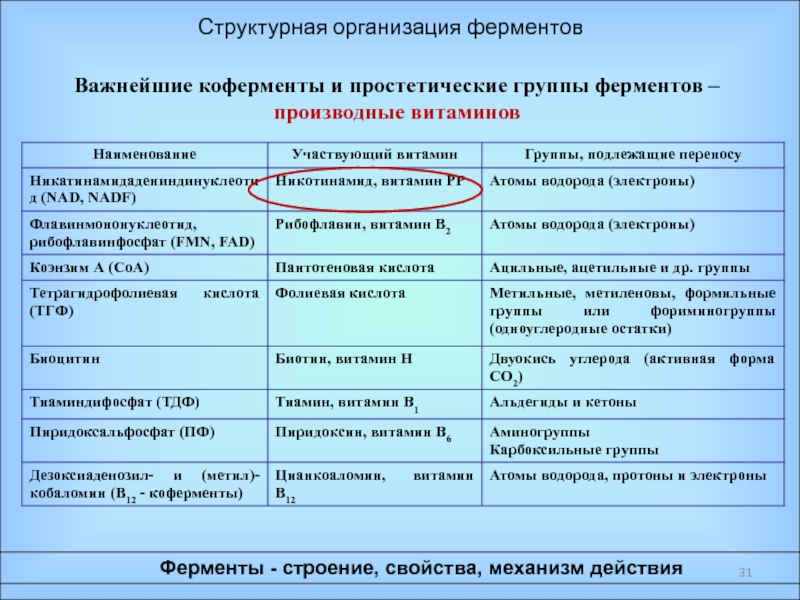
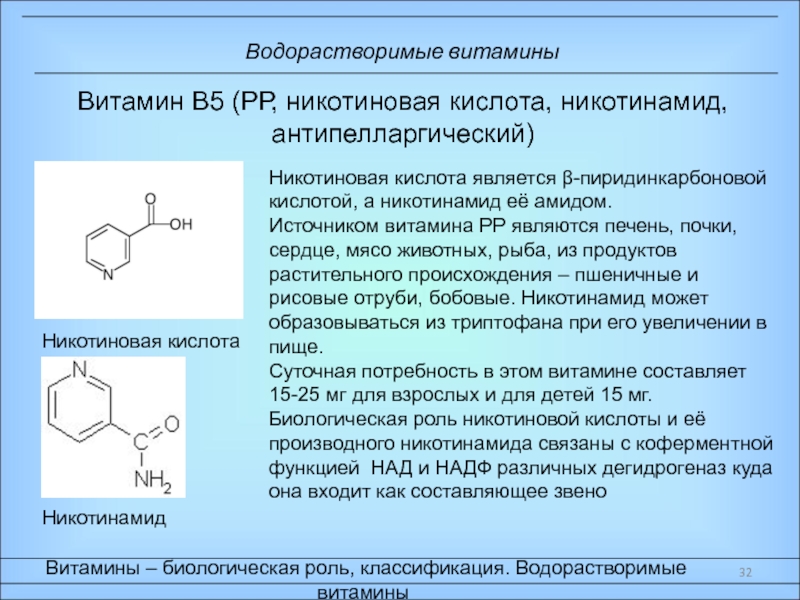
Ферменты – специфические белки, присутствующие во всех живых клетках и выполняющие роль биологических катализаторов;
(Термин фермент предложен голландским химиком Ван Гельмонтом в 17 веке. Он охарактеризовал фермент как «Агент вызывающий химические процессы в организме и управляющий ими»)
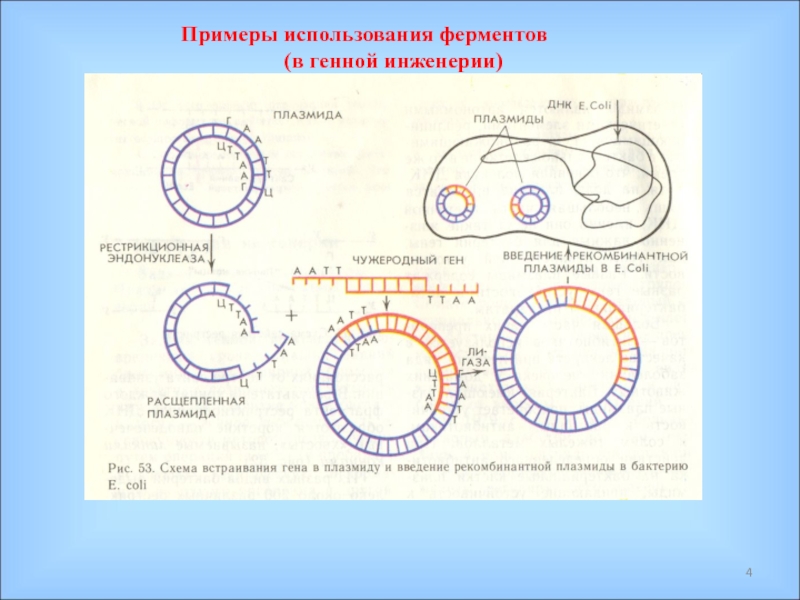
С помощью ферментов реализуется генетическая информация и осуществляются все процессы обмена веществ и энергии в живых организмах;
Слово «фермент» происходит от лат. fеrmеntum - закваска, а «энзим» - от греч. еn - в, внутри и zyme – дрожжи;
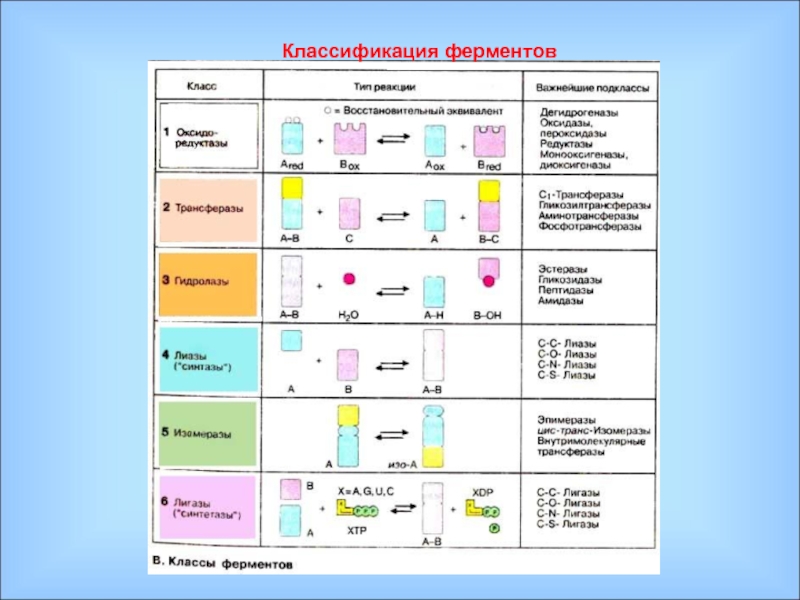
В настоящее время известно более 3700 ферментов
Понятие о ферментах