Слайд 2Учение о химических процессах. Две части:
1. Химическая термодинамика; 2. Химическая
кинетика.
Химическая термодинамика – раздел химии о зависимости направления и пределов
превращений веществ от условий, в которых эти вещества находятся. Рассматривается лишь начальное и конечное состояние веществ. Не учитывается путь, по которому протекает процесс и развитие во времени.
Базовые вопросы термодинамики:
какая теплота выделяется/поглощается;
какая работа может быть совершена;
каково положение равновесия;
каково направление процесса (возможен или невозможен процесс в данном направлении).
Слайд 3Система – совокупность тел, выделенных из окружающей среды анализа. Эти тела
находятся во взаимодействии между собой, но отделены от окружающей среды
реальной или воображаемой границей раздела.
Важно: для термодинамического рассмотрения система всегда она должна состоять из большого числа частиц, то есть быть макроскопической. Только для макроскопических систем можно оперировать такими понятиями, как температура, давление, теплота и т.д.
В термодинамике различают несколько видов систем.
И снова о понятиях...
Важнейшие понятия для термодинамики
Слайд 4Виды систем в термодинамике
1. Изолированная система – такая, которая не
обменивается с окружающей средой ни веществом, ни энергией (наиболее близок
термос). Различают
1а) - жестко изолированные системы и
1б) - адиабатически изолированные системы.
Последняя не обменивается с окружающей средой энергией в форме теплоты, но может изменять внутреннюю энергию за счет совершения над ней работы.
2. Закрытая система. Может обмениваться с окружающей средой энергией, но не веществом.
(Ампула, закрытый реактор и т.д.)
3. Открытая система. С окружающей средой возможен как энергообмен, так и массообмен (клетка организма, осмотический реактор и т.д.).
Слайд 5Состояние системы задается термодинамическими переменными, в роли которых выступают основные
термодинамические свойства системы.
Основные свойства: P (давление), V (объем), T (температура),
xi (xj, xk, … – концентрации по каждому из компонентов), (плотность) и т.д.
В качестве переменных величин, которые определяют состояние термодинамической системы (переменных состояния) при отсутствии силовых полей, чаще всего выбирают
температуру - T, давление - P и состав (составы) – x (xi, xj, …).
Слайд 6Для т/д описания систем используются термодинамические функции термодинамических переменных: Q
– теплота процесса, A – работа, U – внутренняя энергия,
H – энтальпия, S – энтропия G – энергия Гиббса и др.
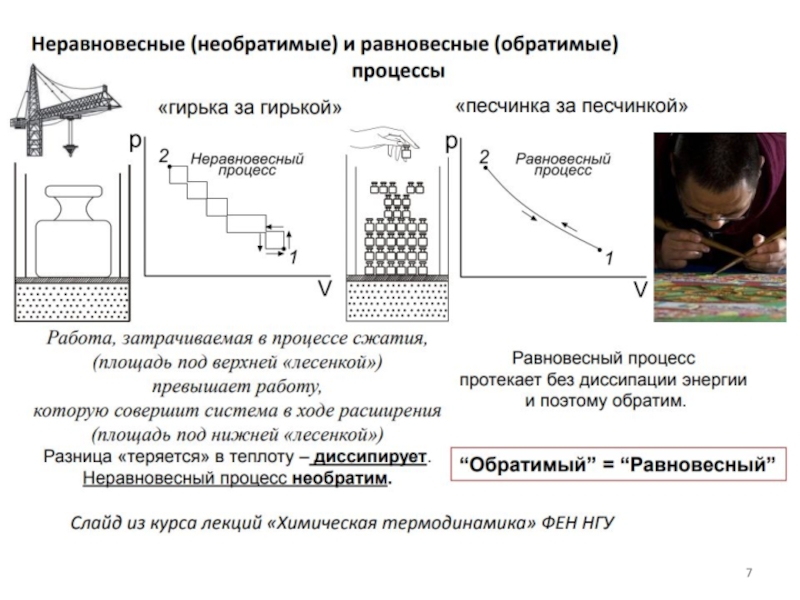
Термодинамические функции – это величины, убыль которых в равновесных процессах, протекающих при постоянстве значений соответствующих независимых параметров, равна полезной внешней работе.
Что такое «равновесный процесс»?
Слайд 8Некоторые из термодинамические функций являются функциями состояния, они однозначно определяют
состояние системы если она находится в равновесии.
Важно: функции состояния не
зависят от пути процесса (в отличие от функций процесса), ф. сост. – самые полезные.
Самые необходимые для следуюшего изложения функции:
Теплота (Q) – форма передачи энергии путем хаотического столкновения молекул о стенки сосуда (функция процесса!).
Работа (A) – форма передачи энергии путем упорядоченного действия большого числа частиц под действием каких-либо сил (функция процесса!).
Внутренняя энергия (U) – суммарная кинетическая и потенциальная энергия частиц, образующих систему (функция состояния!).В U не включается кинетическая энергия, связанная с возможным движением системы относительно др. тел.
Слайд 9Выделяют экстенсивные и интенсивные термодинамические свойства и функции. Экстенсивные свойства
зависят от количества веществ (например, m, V, A), интенсивные –
не зависят (P, T…).
Тепловой эффект химической реакции (Q) – это теплота, выделяемая или поглощаемая при превращении определенного количества веществ при проведении реакции в определенных условиях. Обычно тепловой эффект относят к 1 моль продукта реакции (тогда Q становится интенсивной функцией). Выделяют тепловые эффекты QV (V, T = const) и QP (P, T = const).
Слайд 10Первое начало термодинамики
«Энергия в природе не уничтожается и не возникает
вновь, а переходит из одного вида в другой». (Гельмгольц)
«Теплота и
работа являются различными формами <перехода> энергии; в любом процессе энергия может переходить из одной формы в другую, но она не создается из ничего и не исчезает бесследно» (Клаузиус)
«В любой жестко изолированной системе общий запас энергии остается постоянным» (Джоуль)
«Подводимая к закрытой системе теплота расходуется на изменение внутренней энергии и на совершение ею работы против внешних сил» Алгебраическая формулировка первого начала термодинамики
Q(к сист.) = U + A; Q(к сист.) = –Q(во вне)
QV (к сист.) = U; QP (к сист.) = U + PV = H
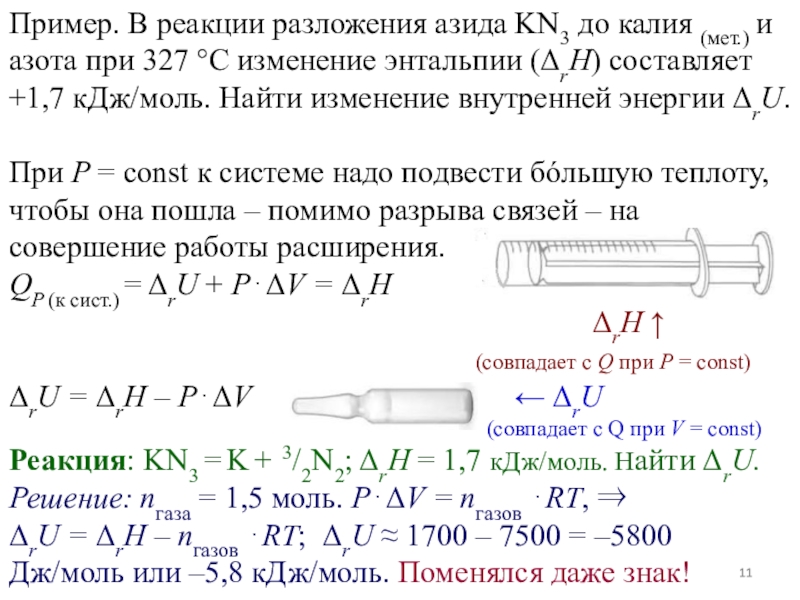
Слайд 11Пример. В реакции разложения азида KN3 до калия (мет.) и
азота при 327 С изменение энтальпии (rH) составляет +1,7 кДж/моль.
Найти изменение внутренней энергии rU.
При P = const к системе надо подвести бóльшую теплоту, чтобы она пошла – помимо разрыва связей – на совершение работы расширения.
QP (к сист.) = rU + PV = rH
rH
(совпадает с Q при P = const)
rU = rH – PV rU
(совпадает с Q при V = const)
Реакция: KN3 = K + 3/2N2; rH = 1,7 кДж/моль. Найти rU. Решение: nгаза = 1,5 моль. PV = nгазов RT,
rU = rH – nгазов RT; rU 1700 – 7500 = –5800 Дж/моль или –5,8 кДж/моль. Поменялся даже знак!
Слайд 12Закон Гесса – следствие 1 начала термодинамики.
Закон Гесса: тепловые эффекты
химической реакции QV и QP, (т.е. тепловые эффекты для изобарно-изотермических
и изохорно-изотермических условий) определяются только природой исходных веществ (точнее – фаз) и продуктов, но не зависят от реакционного пути, т.е. от природы и числа промежуточных стадий.
Под теплотой (энтальпией) образования обычно понимают тепловой эффект реакции образования 1 моль вещества из простых веществ, наиболее стабильных при данных условиях.
Слайд 13Пример: Найти энтальпию реакции
I2тв + Cl2газ = 2IClтв. (rH1)
если
известны энтальпии реакций
I2тв + 3Cl2газ = 2ICl3тв. (rH3) и IСlтв.
+ Cl2газ = ICl3газ (rH13)
Решение:
rH3
I2тв + 3Cl2 газ = 2ICl3 тв.
+ rH1 2Cl2газ
Cl2газ + 2rH13 Тогда rH3 = rH1 + 2rH13
2IClтв. или rH1 = rH3 – 2 rH13
Слайд 14Важнейшие следствия из закона Гесса:
Энтальпия реакции равна разности сумм энтальпий
сгорания начальных и конечных реагентов с учетом их стехиометрических коэффициентов
При
разложении сложного вещества на простые поглощается (или выделяется) столько же теплоты, сколько ее выделяется (или поглощается) при образовании того же количества вещества из простых веществ. (Закон Лавуазье – Лапласа.)
Сумма энтальпий реакций по замкнутому циклу равна нулю. Есть и другие, более частные следствия...
Стандартная теплота образования – определяется для температуры 25С (298 К) и давления 1 атм.
Слайд 15Пример этих следствий. Требуется определить энтальпию формирования CrO3 из хрома
(мет.) и кислорода (fHx). Напрямую её определить сложно. Но можно
составить цикл: разложить готовый оксид хрома (VI) на оксид хрома (III) и кислород (rH1). Далее «взять взаймы» Al и восстановить методом алюмотермии оксид хрома (III) (rH2). После надо разложить оксид алюминия до металла и кислорода (rH3). Энтальпия этой реакции равна энтальпии сгорания алюминия (rH4) с обратным знаком.
Слайд 16Из цикла имеем:
fHx + rH1 + rH2 + rH3 =
0.
С учетом rH3 = – rH4 получаем
fHx + rH1
+ rH2 – rH4 = 0,
Или окончательно
fHx = rH4 – rH1 – rH2.
Слайд 17Пример одного из следствий из закона Гесса:
Слайд 18
Второе начало термодинамики
«Невозможно превратить какое-то количество теплоты полностью в работу:
часть теплоты при этом оказывается растраченной.»
«В любом физическом или химическом
процессе увеличивается сумма энтропий всех тел, принимающих участие в этом процессе.»
«Невозможно осуществить перенос тепла от более холодного тела к более горячему, не затрачивая при этом работу»
Энтропия изолированной системы может только увеличиваться (если в ней идет самопроизвольный процесс), либо оставаться неизменной (макроскопические изменения отсутствуют).
– формула Больцмана
Слайд 19G = H – TS – энергия Гиббса, функция состояния,
одна из важнейших т/д функций.
Amax = – ∆G (P, T)
G = H – TS – изменение энергии Гиббса
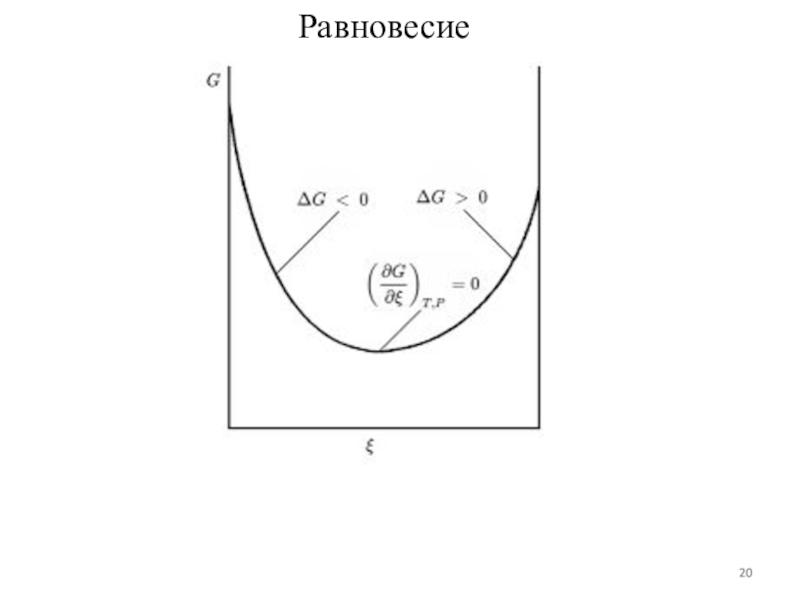
В закрытых системах самопроизвольными процессами, протекающими при P, T = const могут быть только такие, которые сопровождаются убылью энергии Гиббса.
GP, T < 0
При достижении минимально возможного значения Gmin, система приходит в состояние равновесия.
Варианты:
H < 0, S > 0 – реакция идет,
H < 0, S < 0 – реакция идет при малой величине TS,
H> 0, S > 0 – реакция идет при большой величине TS,
H < 0, S > 0 – реакция не идет.