Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Катализ. Виды катализа. Факторы, влияющие на активность ферментов
Содержание
- 1. Катализ. Виды катализа. Факторы, влияющие на активность ферментов
- 2. Ката́лиз (от греч. κατάλυσις, восходит к καταλύειν —
- 3. На изменении активности ферментов в организме основана
- 4. Катализа́тор — ……вещество, ускоряющее реакцию, но не
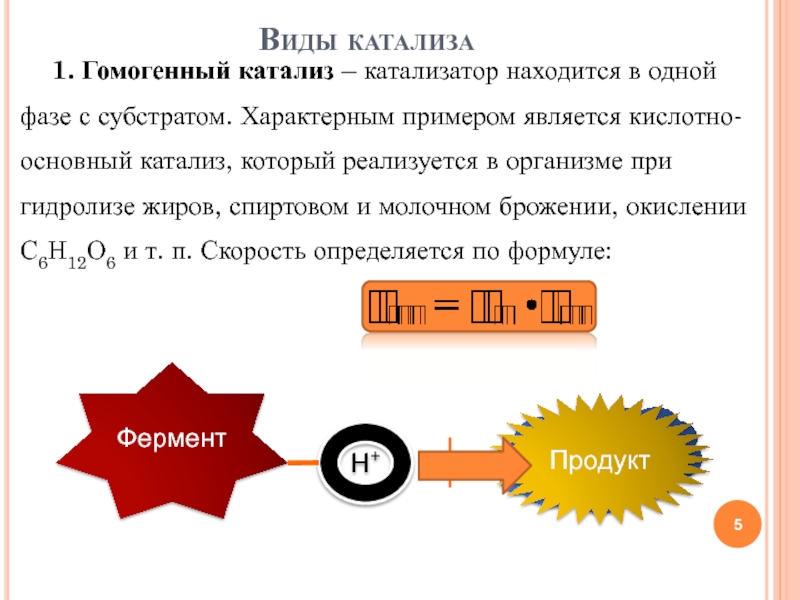
- 5. 1. Гомогенный катализ – катализатор находится в
- 6. 2. Гетерогенный катализ – катализатор и субстрат
- 7. 3. Ферментативный катализ (биокатализ) – ускорение биохимических
- 8. Эмиль Герман Фишер(1852-1919)В 1890 г. предположил, что
- 9. За счёт образования Е-S комплекса, в котором
- 10. Трактовка Фишера объясняет действие селективного фермента. Для
- 11. Human glyoxalase Two zinc ions that are
- 12. Elastase Protein Crystal Growth Porcine Elastase
- 13. Уравне́ние Михаэ́лиса – Ме́нтен — описывает зависимость
- 14. Графическое отображение уравнения Михаэлиса–МентенПри низких [S] −
- 15. Ингибитор (лат. inhibere — задерживать) — вещество, замедляющее
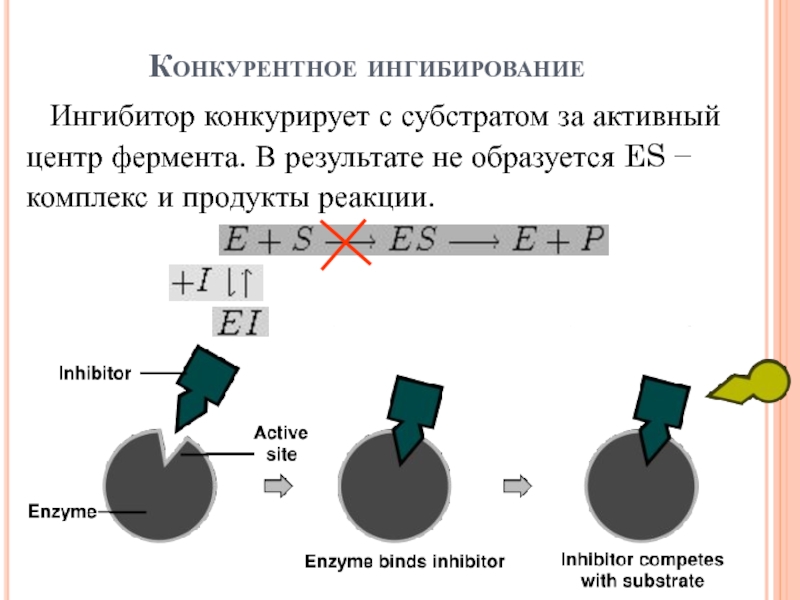
- 16. Конкурентное ингибированиеИнгибитор конкурирует с субстратом за активный
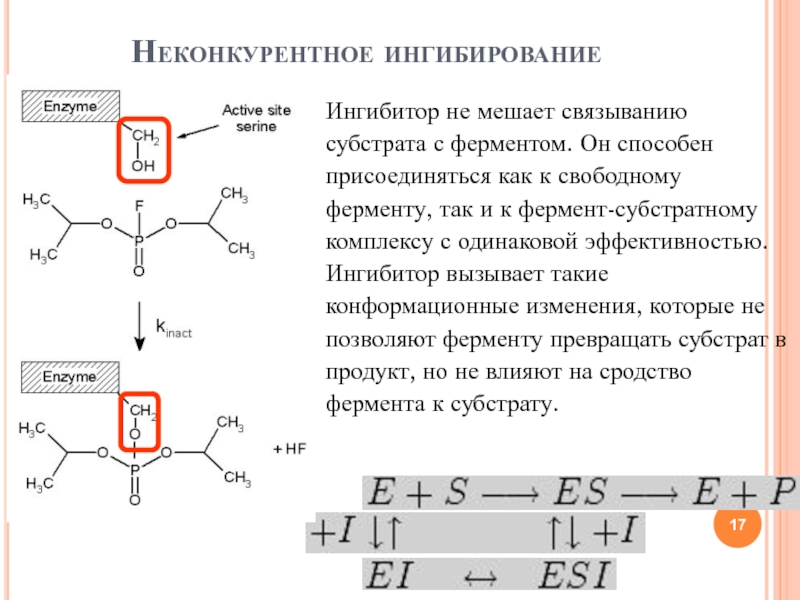
- 17. Неконкурентное ингибированиеИнгибитор не мешает связыванию субстрата с
- 18. EIS E
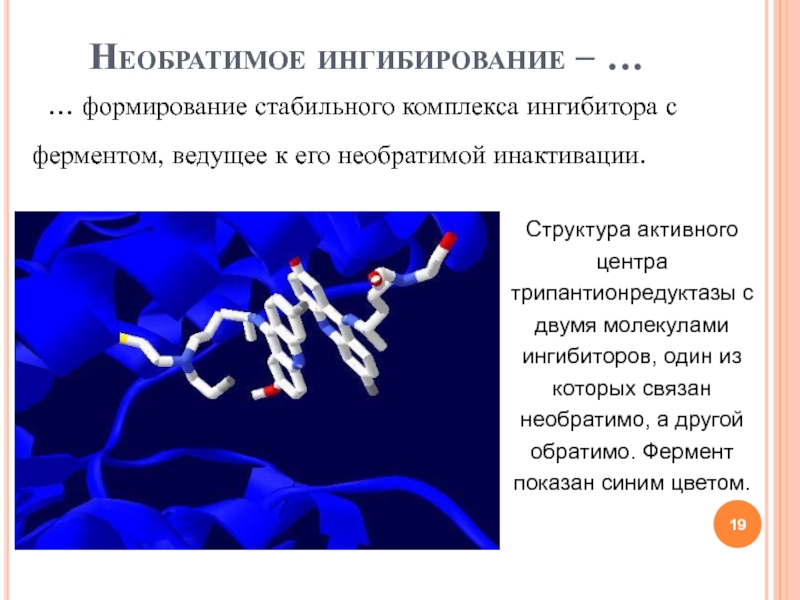
- 19. Необратимое ингибирование – … … формирование стабильного комплекса
- 20. Спасибо завнимание!
- 21. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Катализ. Виды катализа. Факторы, влияющие на активность ферментов
Лекция №6 курса
«Общая
химия»
Слайд 2 Ката́лиз (от греч. κατάλυσις, восходит к καταλύειν — разрушение) — явление изменения
скорости химической или биохимической реакции в присутствии веществ, количество и
состояние которых в ходе реакции не изменяются.Термин «катализ» был введён в 1835 году шведским учёным Берцелиусом.
Йёнс Якоб Берцелиус
(1779–1848)
Слайд 3На изменении активности ферментов в организме основана энзимодиагностика, энзимотерапия и
биохимическая генетика.
Энзимодиагностика позволяет определять болезнь на ранних этапах (заболевания печени,
поджелудочной железы, эндокринных расстройств и т.д.).В энзимотерапии лекарством является фермент (пепсин − для лечения гастрита, диспепсии и др. расстройств пищеварения, панкреатин [фестал, панзинорм] − для лечения печени и поджелудочной железы и т.д.).
Биохимическая генетика − учение о наследственных заболеваниях, обусловленных дефектами в структуре ферментов.
Слайд 4Катализа́тор — …
…вещество, ускоряющее реакцию, но не входящее в состав
продуктов реакции.
В отношении катализатора выполняются 2 условия:
1. катализатор ускоряет реакцию,
для которой ΔG <0.2. Катализатор не смещает химического равновесия, т.е. не влияет на Кр.
Слайд 51. Гомогенный катализ – катализатор находится в одной фазе с
субстратом. Характерным примером является кислотно-основный катализ, который реализуется в организме
при гидролизе жиров, спиртовом и молочном брожении, окислении С6Н12О6 и т. п. Скорость определяется по формуле:Виды катализа
Фермент
Н+
Субстрат
Продукт
Слайд 62. Гетерогенный катализ – катализатор и субстрат находятся в разных
фазах. Особенность таких катализаторов − наличие активных и аллостерических центров.
Активный центр − центр, обладающий каталитической активностью.
Аллостерический центр участвует в явлении, которое носит название индуцированная приспособляемость фермента к субстрату и наоборот.
Виды катализа
Слайд 73. Ферментативный катализ (биокатализ) – ускорение биохимических реакций при участии
белковых макромолекул, называемых ферментами (энзимами). Этот вид катализа относится к
микрогетерогенному катализу, но имеет аналогии и с гомогенным катализом. Отличие ферментов от других катализаторов − высокая активность и селективность первых.Виды катализа
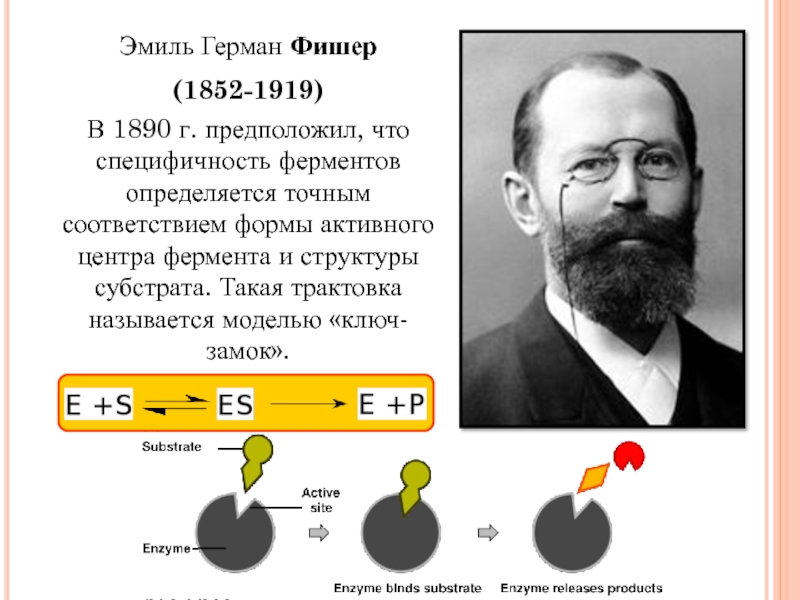
Слайд 8
Эмиль Герман Фишер
(1852-1919)
В 1890 г. предположил, что специфичность ферментов определяется
точным соответствием формы активного центра фермента и структуры субстрата. Такая
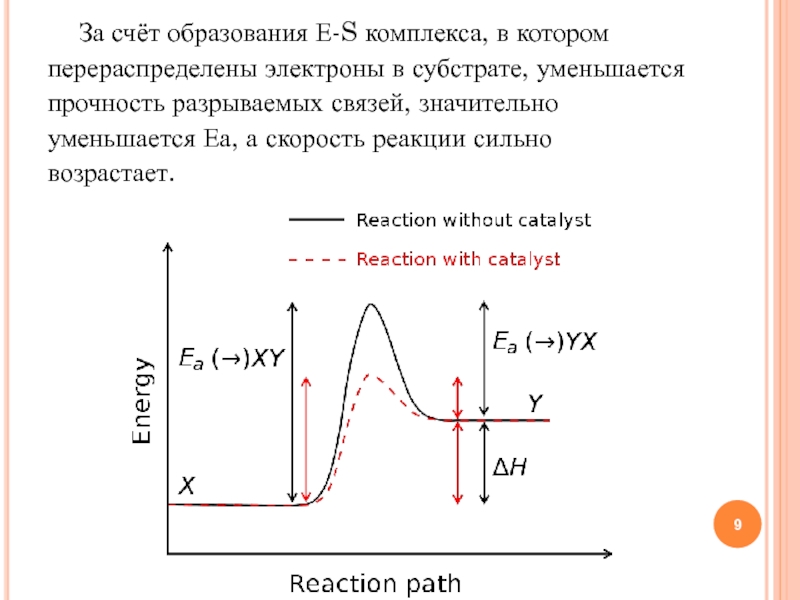
трактовка называется моделью «ключ-замок».Слайд 9За счёт образования Е-S комплекса, в котором перераспределены электроны в
субстрате, уменьшается прочность разрываемых связей, значительно уменьшается Еа, а скорость
реакции сильно возрастает.Слайд 10Трактовка Фишера объясняет действие селективного фермента. Для неселективного фермента более
реалистична индуцированная приспособляемость фермента к субстрату и наоборот. Неправильные субстраты —
слишком большие или слишком маленькие — не подходят к активному центру, поэтому аллостерический центр «подгоняет» структуру субстрата под структуру активного центра.P1
P2
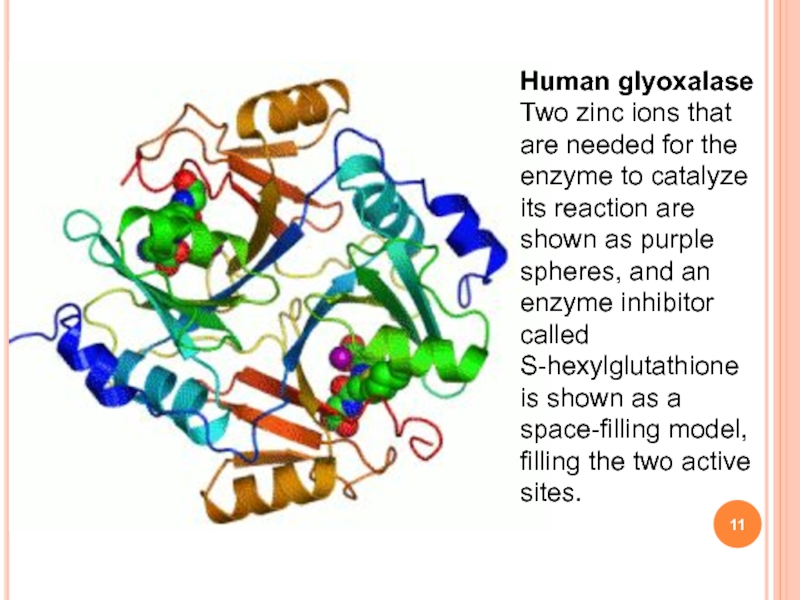
Слайд 11Human glyoxalase Two zinc ions that are needed for the
enzyme to catalyze its reaction are shown as purple spheres,
and an enzyme inhibitor called S-hexylglutathione is shown as a space-filling model, filling the two active sites.Слайд 13
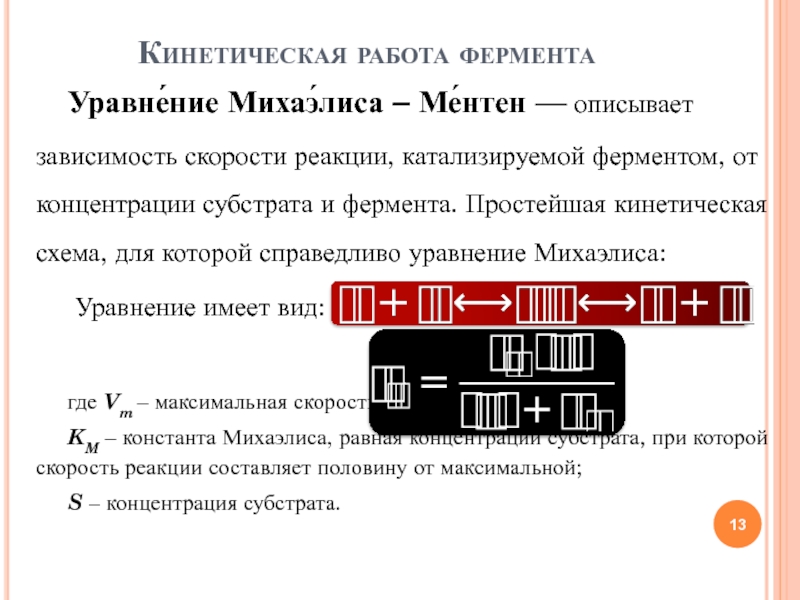
Уравне́ние Михаэ́лиса – Ме́нтен — описывает зависимость скорости реакции, катализируемой
ферментом, от концентрации субстрата и фермента. Простейшая кинетическая схема, для
которой справедливо уравнение Михаэлиса:Уравнение имеет вид:
где Vm – максимальная скорость реакции, равная kcatEo;
KM – константа Михаэлиса, равная концентрации субстрата, при которой скорость реакции составляет половину от максимальной;
S – концентрация субстрата.
Кинетическая работа фермента
Слайд 14Графическое отображение уравнения Михаэлиса–Ментен
При низких [S] − реакция I порядка;
V=k[S]
При высоких [S] − реакция 0 порядка; V=k[E]
Слайд 15Ингибитор (лат. inhibere — задерживать) — вещество, замедляющее или предотвращающее течение
различных химических реакций.
Ферментативный ингибитор — вещество, замедляющее протекание ферментативной реакции.
Слайд 16Конкурентное ингибирование
Ингибитор конкурирует с субстратом за активный центр фермента. В
результате не образуется ES − комплекс и продукты реакции.
Слайд 17Неконкурентное ингибирование
Ингибитор не мешает связыванию субстрата с ферментом. Он способен
присоединяться как к свободному ферменту, так и к фермент-субстратному комплексу
с одинаковой эффективностью. Ингибитор вызывает такие конформационные изменения, которые не позволяют ферменту превращать субстрат в продукт, но не влияют на сродство фермента к субстрату.








![Катализ. Виды катализа. Факторы, влияющие на активность ферментов Графическое отображение уравнения Михаэлиса–МентенПри низких [S] − реакция I порядка; V=k[S]При Графическое отображение уравнения Михаэлиса–МентенПри низких [S] − реакция I порядка; V=k[S]При высоких [S] − реакция 0 порядка;](/img/thumbs/9b780c9d7d6becf05ebd3a6ad7ab9ff8-800x.jpg)