Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Молекулярный фишинг на чипе оптического биосенсора
Содержание
- 1. Молекулярный фишинг на чипе оптического биосенсора
- 2. Оптический биосенсорОптический биосенсор, основанный на эффекте поверхностного
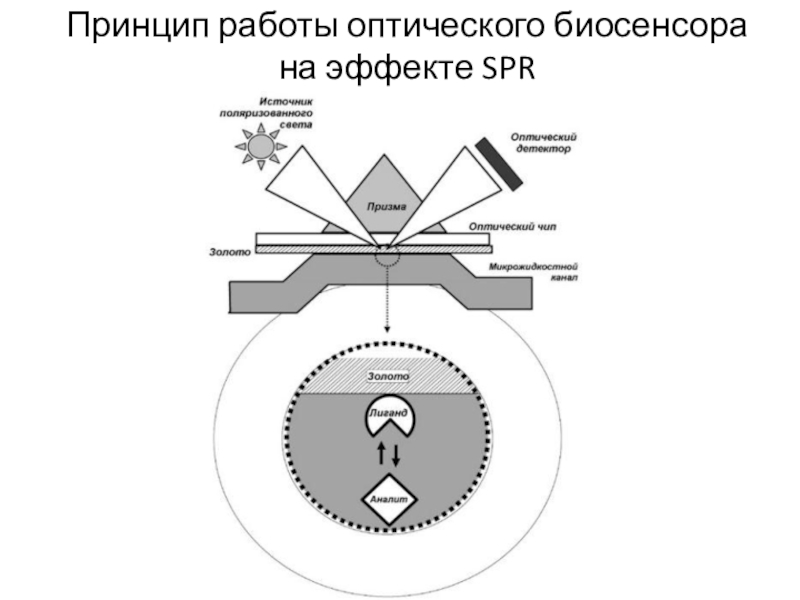
- 3. Принцип работы оптического биосенсора на эффекте SPR
- 4. Слайд 4
- 5. Анализ серии сенсограмм, полученных при разных концентрациях
- 6. Принципы иммобилизации лигандов на поверхности оптических чиповковалентная
- 7. Принцип нековалентной иммобилизацииНа поверхности оптического чипа ковалентно
- 8. Оптический биосенсор не осуществляет идентификацию выделенных белков,
- 9. Методы, используемые в современных протеомных исследованиях, основаны
- 10. Двумерный электрофорезметод разделения, основанный на последовательном использовании
- 11. Одномерный электрофорез Белки, разделенные методом одномерного электрофореза,
- 12. Безгелевые технологии многомерное разделение пептидов, полученных при
- 13. Скачать презентанцию
Оптический биосенсорОптический биосенсор, основанный на эффекте поверхностного плазмонного резонанса (SPR), используется для количественных измерений ББВ.SPR позволяет регистрировать ББВ в реальном времени в виде сенсограмм .
Слайды и текст этой презентации
Слайд 2Оптический биосенсор
Оптический биосенсор, основанный на эффекте поверхностного плазмонного резонанса (SPR),
используется для количественных измерений ББВ.
времени в виде сенсограмм .Слайд 5Анализ серии сенсограмм, полученных при разных концентрациях аналита:
равновесные характеристики межмолекулярных
взаимодействий — константу диссоциации комплекса и аффинность
кинетические параметры —
константы скоростей образования и распада белковых комплексовАнализ серии сенсограмм, полученных при разных температурах:
термодинамические характеристики — изменение свободной энергии Гиббса (ΔG), изменение энтальпии (ΔH) и энтропии (ΔS)
Слайд 6Принципы иммобилизации лигандов на поверхности оптических чипов
ковалентная
нековалентная
иммобилизации иммобилизация
лигандов лигандов
Слайд 7Принцип нековалентной иммобилизации
На поверхности оптического чипа ковалентно закрепляется специфический аффинный
реагент, на который нековалентно иммобилизируется лиганд (рис. б). В качестве
такой аффинной связки могут выступать специфические моно- или поликлональные антитела, стрептавидин .Распространен метод иммобилизации белков лигандов, содержащих так называемый гистаг (метку в виде последовательности из 6 гистидинов, 6×His). Белки иммобилизуются на оптическом чипе, поверхность которого модифицирована соединением NTA (нитрилотриацетат), за счет образования трех хелатных комплексов, состоящих из двух остатков гистидина, одного иона никеля (Ni2+) и одной молекулы NTA (рис. в)
Слайд 8Оптический биосенсор не осуществляет идентификацию выделенных белков, поэтому он используется
совместно с масс-спектрометрической идентификацией.
Идентификация белковых последовательностей при помощи комбинации высокопроизводительных
методов разделения белков и их масс-спектрометрического анализа является ключевым этапом протеомного анализа.Слайд 9Методы, используемые в современных протеомных исследованиях, основаны на трех технологических
платформах:
Использование двумерного электрофореза в комбинации с идентификацией белков методом
MALDI-TOF масс-спектрометрии. Использование одномерного электрофореза в полиакриламидном геле в комбинации с обращенно-фазовой жидкостной хроматографией, совмещенной с тандемной масс-спектрометрической детекцией.
Использование безгелевой технологии MudPit при помощи многомерного хроматографического разделения белков с последующим масс-спектрометрическим анализом
Слайд 10Двумерный электрофорез
метод разделения, основанный на последовательном использовании двух свойств белков:
заряда и массы.
Для визуализации белковых молекул используют различные методы их
окрашивания - методы серебрения, окраски Кумасси голубым и флуоресцентные красители.Для изучения белковых комплексов используется нативный (неденатурирующий) 2DE или голубой нативный 2DE.
Для осуществления идентификации представленные на электрофореграмме в виде пятен белки вырезают, и затем проводят ферментативное расщепление белка в пятне с использованием трипсина.
Полученный гидролизат анализируют при помощи массспектрометрии.
Идентификация белков по полученным масс-спектрам пептидных фрагментов проводится с использованием баз данных белковых и нуклеотидных последовательностей.