Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
СРС
Содержание
- 1. СРС
- 2. План:ВведениеПричины распространенности ЗПППМетоды диагностики ЗПППНаиболее надежные современные
- 3. ВведениеЗаболевания, передаваемые половым путем (ЗППП), занимают в
- 4. ВАЖНО!!!Клинические проявления ЗППП часто неспецифичны или слабо
- 5. Причины распространенности ЗППП: частая смена половых партнеров,нарушение
- 6. Диагностика ЗППП Существует достаточно много методов выявления
- 7. Микроскопические методы Первая группа – микроскопия выделений
- 8. Анализы крови Существуют различные способы, нацеленные на
- 9. Культуральные методы Третья группа диагностических методов –
- 10. ДНК-диагностика Четвертая группа методов лабораторной диагностики ЗППП
- 11. Наиболее надежные современные методы лабораторной диагностики инфекций:
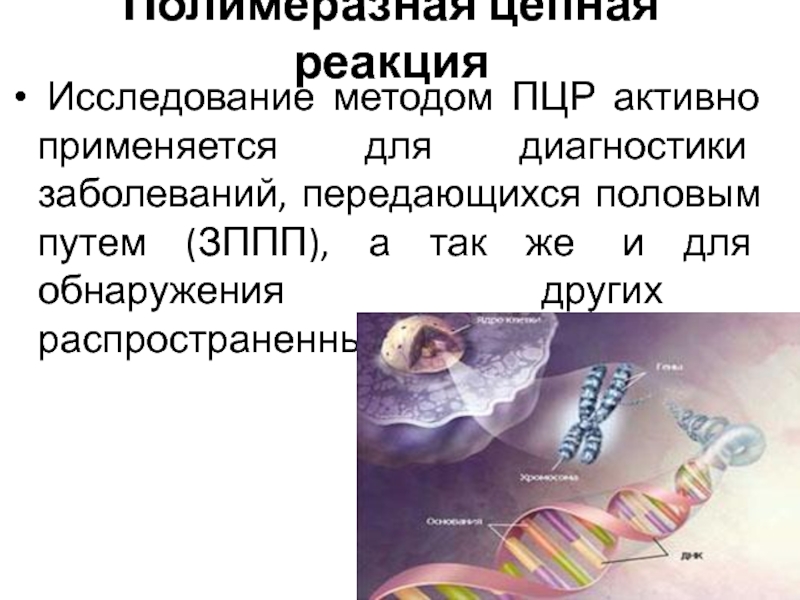
- 12. Полимеразная цепная реакция Исследование методом ПЦР активно применяется
- 13. Материалом для проведения ПЦР-диагностики может служить: соскоб
- 14. Суть метода ПЦРЦель ПЦР, как метода лабораторной
- 15. Для выявления каждого микроорганизма существует своя ПЦР-тест-система,
- 16. Стадии метода ПЦРДенатурация - расплетение цепей двунитевой
- 17. 2. Присоединение (отжиг) праймеров. Для начала процесса
- 18. 3. В результате присоединения праймеров образуются структуры
- 19. Вновь синтезированные двуцепочечные ДНК после стадии денатурации
- 20. ПЦР проводят в циклаторе или амплификаторе –
- 21. Достоинства метода ПЦР : ПЦР является одним
- 22. Иммуноферментный анализ (ИФА) ИФА
- 23. ИФАСерологические исследования основаны на образовании в организме,
- 24. Суть метода ИФАНа каждый вид (и даже
- 25. Первыми появляются Ig M- антитела. Обнаружение Ig
- 26. ИФА-тест-системы основаны на специфическом связывании АНТИГЕНА с АНТИТЕЛОМ и цветной ферментативной реакции, выявляющей результат этого взаимодействия.
- 27. Слайд 27
- 28. Реакция пассивной, или непрямой, гемагглютинации (РПГА,
- 29. РПГА
- 30. Слайд 30
- 31. РПГА в основном используют для диагностики сифилисаМетод
- 32. ГОНОРЕЯ Гонорея – бактериальное инфекционное венерическое заболевание.
- 33. Слайд 33
- 34. Лабораторная диагностика Традиционные методы лабораторной диагностики гонореи
- 35. ГЕРПЕСВИРУСНАЯ ИНФЕКЦИЯ Наиболее распространенную герпесвирусную инфекцию вызывают
- 36. ВПГ 2, генитальный герпес, вызывает характерные поражения
- 37. Слайд 37
- 38. Лабораторная диагностикаДля диагностики герпесвирусных инфекций необходимо применять
- 39. КАНДИДОЗ Более 70% микозов-кандидозов вызывает грибок Candida
- 40. Урогенитальный кандидоз может быть эндогенного происхождения (активизация
- 41. Слайд 41
- 42. Лабораторная диагностикаДля выявления Candida albicans и Candida
- 43. ПАПИЛЛОМАТОЗ Папилломавирусы человека (ВПЧ -
- 44. Генитальная папилломавирусная инфекция человека является одним из
- 45. Слайд 45
- 46. Лабораторная диагностикаДля лабораторной диагностики папилломавирусной инфекции используют
- 47. ТОКСОПЛАЗМОЗ Возбудитель токсоплазмоза – Toxoplasma gondii -
- 48. Слайд 48
- 49. Лабораторная диагностика Для выявления токсоплазм в пробах
- 50. ТРИХОМОНИАЗ Трихомониаз (трихомоноз) вызывается простейшими Trichomonas vaginalis.
- 51. Слайд 51
- 52. Лабораторная диагностикаДля лабораторной диагностики используют методы: пцр
- 53. ХЛАМИДИОЗЫ Хламидии – бактерии, вызывающие различные заболевания
- 54. Chlamydia trachomatis встречается преимущественно у человека, однако
- 55. Слайд 55
- 56. Лабораторная диагностикахламидиозов основана на использовании двух методов
- 57. ЦИТОМЕГАЛОВИРУСНАЯ ИНФЕКЦИЯ (ЦМВИ)ЦМВИ – широко распространенная вирусная
- 58. Слайд 58
- 59. Лабораторная диагностикаЛабораторная диагностика ЦМВ с помощью ПЦР
- 60. Заключение У каждой инфекции, передающейся половым путем,
- 61. Список литературы:Борисов Л.Б. Медицинская микробиология, вирусология, иммунология.-
- 62. Скачать презентанцию
План:ВведениеПричины распространенности ЗПППМетоды диагностики ЗПППНаиболее надежные современные методы лабораторной диагностики инфекцийПолимеразная цепная реакцияИммуноферментный анализРеакция пассивной, или непрямой, гемагглютинацииНекоторые ЗПППЗаключениеСписок литературы
Слайды и текст этой презентации
Слайд 1СРС
Современные методы диагностики заболеваний передающихся половым путем
Карагандинский Государственный Медицинский Университет
Кафедра
микробиологии и иммунологии
Слайд 2План:
Введение
Причины распространенности ЗППП
Методы диагностики ЗППП
Наиболее надежные современные методы лабораторной диагностики
инфекций
Полимеразная цепная реакция
Иммуноферментный анализ
Реакция пассивной, или непрямой, гемагглютинации
Некоторые ЗППП
Заключение
Список литературы
Слайд 3Введение
Заболевания, передаваемые половым путем (ЗППП), занимают в настоящее время одно
из ведущих мест в структуре инфекционной патологии. По данным Всемирной
Организации Здравоохранения (ВОЗ) распространение ЗППП имеет тенденцию к значительному росту. Возбудителями ЗППП являются бактерии, простейшие, грибы и вирусы. ЗППП могут передаваться половым путем, от матери к плоду, редко - контактно-бытовым путем (через губки, полотенца, руки).Слайд 4ВАЖНО!!!
Клинические проявления ЗППП часто неспецифичны или слабо выражены, при этом
возможно длительное бессимптомное течение болезни. Для диагностики ЗППП используют различные
лабораторные методы, прямо или косвенно выявляющие возбудителей заболеваний. Стратегия лабораторной диагностики и выявляемость возбудителей ЗППП зависят от особенностей течения заболеваний, фазы развития инфекции, а также от биологических циклов развития соответствующих возбудителей, их численности в момент забора биоматериала, особенностей взаимодействия возбудителей инфекции с иммунной системой человека.Слайд 5Причины распространенности ЗППП:
частая смена половых партнеров,
нарушение правил личной гигиены,
поздняя постановка
диагноза,
недолеченные инфекции,
затрудненные диагностика и лечение хронических и латентных (с бессимптомным
течением) форм заболеваний, а также здоровое носительство некоторых условно-патогенных микроорганизмов, возбудителей ЗППП.Слайд 6Диагностика ЗППП
Существует достаточно много методов выявления возбудителей ЗППП, принципиально их
можно разделить на несколько групп:
Микроскопические методы
Анализы крови
Культуральные методы
ДНК-диагностика
Слайд 7Микроскопические методы
Первая группа – микроскопия выделений из мочеиспускательного канала, слизистой
пробки цервикального канала, эпителия стенки влагалища, уретры и т.д., все
то, что по-простому называют «мазок». Таким методом можно обнаружить гонококки и трихомонады, иногда опытные доктора с применением специальных методов определяют хламидии и уреаплазмы, в большом количестве видны гарднереллы, но не более того.Слайд 8Анализы крови
Существуют различные способы, нацеленные на выявление возбудителя ЗППП или
его «следов» (антигенов или антител) в крови человека. Методы недешевы,
но результаты анализов точны и приходят быстро.Эти анализы всегда следует делать в спорных или неясных случаях, а также для контроля динамики течения заболевания, но начинать диагностику с них едва ли разумно. Во-первых, требуется немало времени с момента заражения, чтобы антигены или антитела к возбудителям оказались в крови, не меньше 2 недель или месяца. Во-вторых, «следы» инфекций не всегда специфичны. Обнаруженные в крови антитела к хламидиям не обязательно связаны с патогенной chlamidia trachomatis, они могли образоваться при попадании в организм легочной формы хламидии, безвредной для человека.
Слайд 9Культуральные методы
Третья группа диагностических методов – это культуральные методы, или
посевы. Смысл этих методов исследования заключается в следующем. Исследуемый материал
(как правило, выделения или соскобы из уретры или влагалища) наносится на питательную для микроорганизмов среду. Через сутки на ней вырастает колония микроорганизмов. По виду, цвету, форме и консистенции этой колонии можно точно идентифицировать возбудителя, а также провести определение его чувствительности к различным антибиотикам. Культуральный метод диагностики ЗППП иногда может дать поистине бесценную информацию. Это особенно касается случаев многократного неэффективного лечения заболевания.Слайд 10ДНК-диагностика
Четвертая группа методов лабораторной диагностики ЗППП – так называемая ДНК-диагностика.
Эти методы основаны на обнаружении ДНК микроорганизмов в исследуемом материале.
Наиболее распространенным методом ДНК диагностики является полимеразная цепная реакция (ПЦР). Точность метода ПЦР на сегодняшний день составляет 97% - высочайшая точность по сравнению с микроскопией, которая не всегда может дать правильный ответ даже на 60%. Еще одним положительным моментом ПЦР-диагностики относится то, что может проводиться исследование любого материала - крови, мочи, соскобов и выделений.Слайд 11Наиболее надежные современные методы лабораторной диагностики инфекций:
диагностика по методу ПЦР
– для выявления ДНК возбудителей,
ИФА – для выявления антител, выработанных
организмом человека в ответ на присутствие возбудителей,Микробиологический метод выделения культур возбудителей с определением чувствительности к антибиотикам.
Слайд 12Полимеразная цепная реакция
Исследование методом ПЦР активно применяется для диагностики заболеваний,
передающихся половым путем (ЗППП), а так же и для обнаружения
других распространенных инфекций.Слайд 13Материалом для проведения ПЦР-диагностики может служить:
соскоб эпителиальных клеток (соскоб из
уретры у мужчин и у женщин, из цервикального канала);
кровь, плазма,
сыворотка крови;биологические жидкости (сок простаты, плевральная, спинномозговая, околоплодная, суставная жидкости, слюна);
моча (используется первая порция утренней мочи);
слизь и другие биологические выделения;
Слайд 14Суть метода ПЦР
Цель ПЦР, как метода лабораторной диагностики инфекций, –
выявить в образце биологического материала ДНК искомого микроорганизма – возбудителя
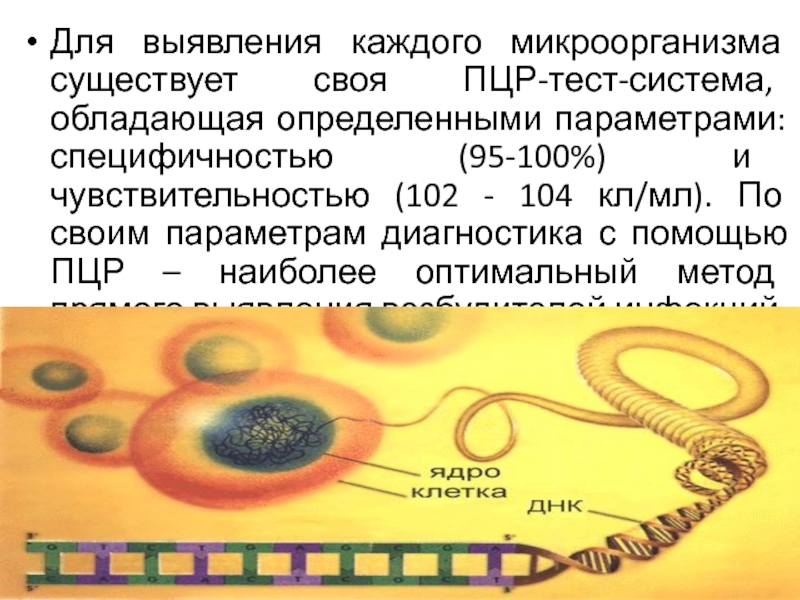
инфекционного процесса. Для проведения ПЦР исследования из биологического материала, полученного от пациента, сначала выделяют всю ДНК. Затем проводят амплификацию, т.е. многократное копирование строго определенных фрагментов ДНК, специфичных для искомых микроорганизмов и регистрируют полученные результаты.Слайд 15Для выявления каждого микроорганизма существует своя ПЦР-тест-система, обладающая определенными параметрами:
специфичностью (95-100%) и чувствительностью (102 - 104 кл/мл). По своим
параметрам диагностика с помощью ПЦР – наиболее оптимальный метод прямого выявления возбудителей инфекций.Слайд 16Стадии метода ПЦР
Денатурация - расплетение цепей двунитевой ДНК - не
ферментативный процесс, который идет при температуре 950С.
Слайд 172. Присоединение (отжиг) праймеров. Для начала процесса репликации в ПЦР
используют праймеры - короткие одноцепочечные ДНК (длиной 15-30 оснований), которые
добавляют в избытке в реакционную смесь. Они специфично (по принципу комплементарного спаривания) присоединяются к коротким участкам, ограничивающим выбранную мишень. Праймеры присоединяются только к выбранным специфичным для данного возбудителя фрагментам ДНК и не взаимодействуют ни с какими другими последовательностями ДНК. Именно этим обеспечивается абсолютная специфичность диагностической ПЦР-тест-системы.Слайд 183. В результате присоединения праймеров образуются структуры [ДНК-матрица + праймер],
являющиеся «затравочными» комплексами. Начинается достраивание праймеров, начиная с 3’-концов, путём
комплементарного синтеза на матрицах одноцепочечных фрагментов ДНК. Этот процесс осуществляется с помощью специального фермента - Taq-полимеразы (термоустойчивой ДНК-полимеразы) и нуклеотидов (в качестве строительного материала).Слайд 19Вновь синтезированные двуцепочечные ДНК после стадии денатурации [1] снова связывают
праймеры, которые находятся в смеси в избытке [2]. Полученные структуры
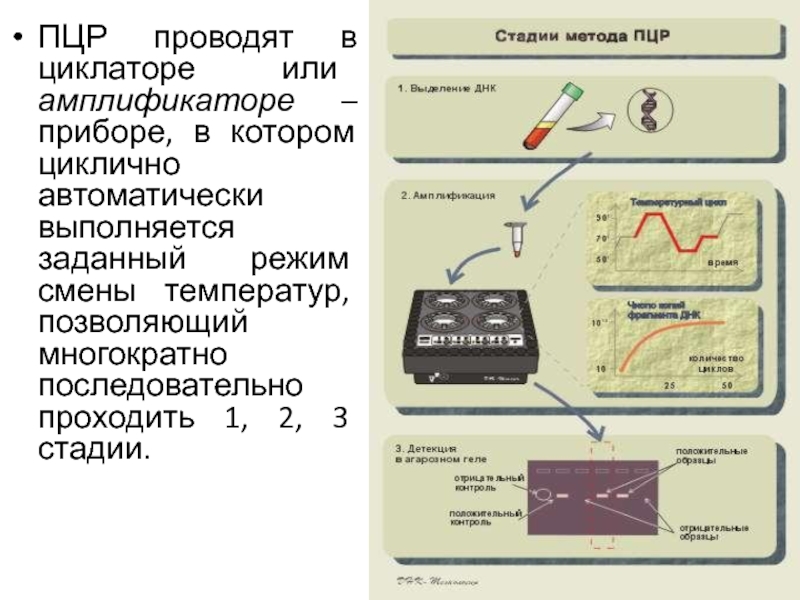
после достраивания [3] образуют специфические фрагменты ДНК, ограниченные последовательностями праймеров. Таким образом, даже если исходной для ПЦР была только одна молекула ДНК, то в течение 25 – 40 циклов происходит амплификация, т.е. синтезируется большое количество (108-109 копий) специфических фрагментов ДНК (ампликонов), достаточное для визуального учета результата реакции после электрофореза в агарозном геле.Слайд 20ПЦР проводят в циклаторе или амплификаторе – приборе, в котором
циклично автоматически выполняется заданный режим смены температур, позволяющий многократно последовательно
проходить 1, 2, 3 стадии.Слайд 21Достоинства метода ПЦР :
ПЦР является одним из наиболее современных и
совершенных лабораторных диагностических методов, позволяющий специфично выявлять ДНК единичных клеток
возбудителей инфекционных заболеваний в образце.Можно сказать, что ПЦР достигает предельно возможной чувствительности. Благодаря высокой чувствительности, тест-системы на основе ПЦР незаменимы в тех случаях, когда исследуемого материала (возбудителя заболевания) очень мало.
Благодаря высокой чувствительности исследование методом пцр позволяет осуществлять раннюю диагностику заболеваний, уточнять диагноз на фоне антибиотикотерапии, проверять излеченность, а также обнаруживать персистирующие микрорганизмы.
Для ПЦР-анализа пригоден любой клинический материал, потенциально содержащий возбудителей инфекций - кровь, сыворотка, лаважная жидкость, мокрота, слюна, желудочный сок, биопсийный материал, мазки, смывы.
Лабораторная диагностика методом ПЦР – быстрый и надёжный способ выявления возбудителей инфекционных заболеваний. ПЦР-лаборатория даёт ответ через 48 часов с момента доставки материала на исследование. (Чистое время исследования каждого образца составляет всего несколько часов.)
Слайд 22Иммуноферментный анализ (ИФА)
ИФА открыли и стали применять
в научно-медицинской практике в середине 60-х годов.
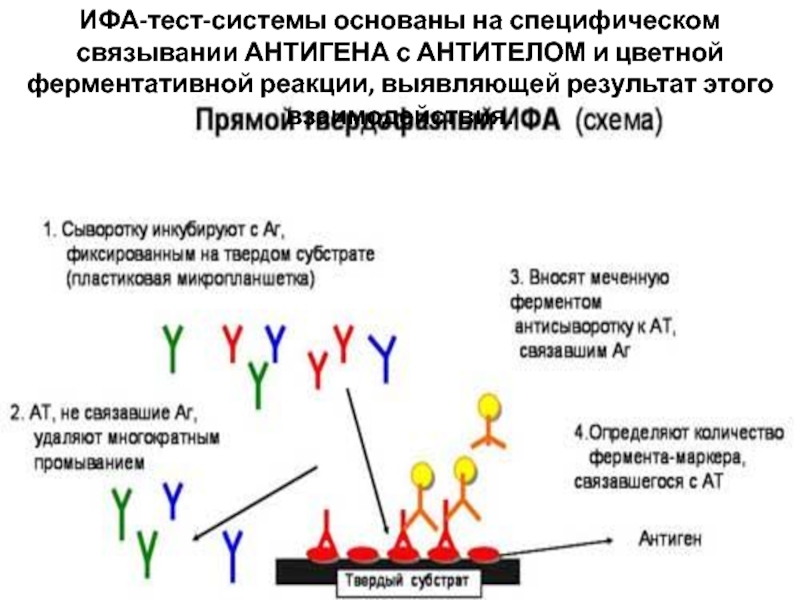
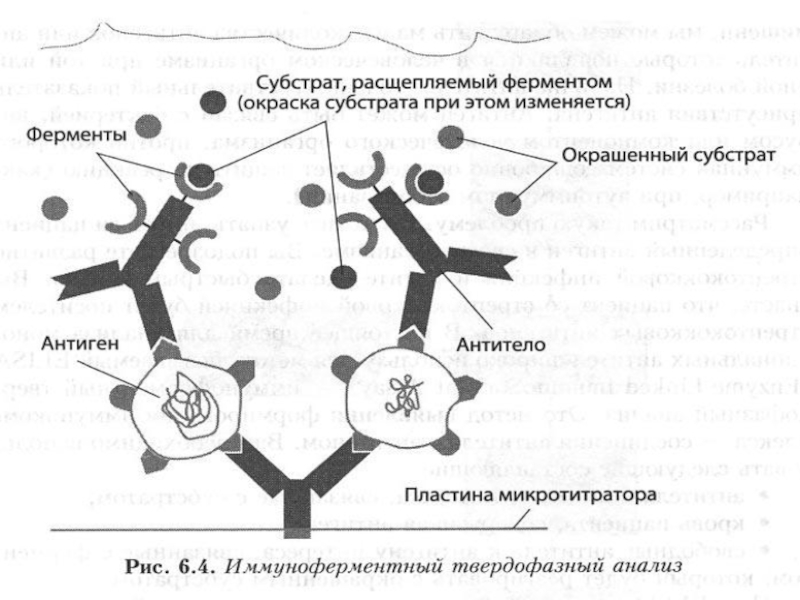
Иммуноферментный анализ (ИФА) основан на
обнаружении антигенов возбудителя или антител к ним в патологическом материале или сыворотке крови. В основе метода ИФА лежит принцип специфического взаимодействия между антигеном и соответствующим ему антителом.
При использовании метода ИФА применяется окрашивание мазков-отпечатков антителами, которые непосредственно конъюгированы с флюресцентным красителем (прямая иммунофлюоресценция), либо выявляются в мазке вторичными антителами, конъюгироваными с такими красителями (непрямая иммунофлюоресценция).
Слайд 23ИФА
Серологические исследования основаны на образовании в организме, в сыворотке крови
антител в ответ на попадание в организм чужеродного белка (антигена).
Серологические
методы позволяют дифференцировать острые и хронические формы, выделить стадию заболевания и выявлять практически здоровых носителей. Чувствительность методов ИФА довольно высока -70-80%. Слайд 24Суть метода ИФА
На каждый вид (и даже подвид) возбудителя вырабатываются
свои определенные антитела, которые, как правило, не связываются ни с
каким другим инфекционным агентом. Благодаря этому определение антимикробных антител обеспечивает достаточно высокую специфичность анализа.Для диагностики половых инфекций используется три класса иммуноглобулинов : A, M, G, которые вырабатываются в определенной последовательности.
Слайд 25Первыми появляются Ig M- антитела. Обнаружение Ig M- антител в
анализе указывает на наличие острой фазы заболевания или на обострение
хронических инфекционных заболеваний. Через определенное время (для каждой инфекции свое) начинают вырабатываться Ig A- антитела,основная часть которых концентрируется на слизистых оболочках, где реализуется их защитная функция. И последними появляются Ig G-антитела. Если организм справляется с инфекцией сам или с помощью проводимого лечения, то IgG могут еще длительное время (а для некоторых инфекций и пожизненно) оставаться повышенными.Слайд 26ИФА-тест-системы основаны на специфическом связывании АНТИГЕНА с АНТИТЕЛОМ и цветной
ферментативной реакции, выявляющей результат этого взаимодействия.
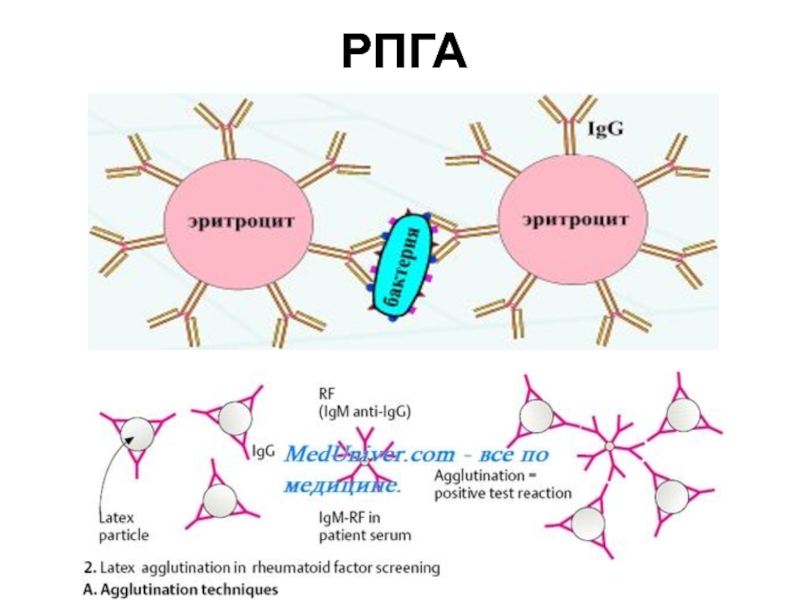
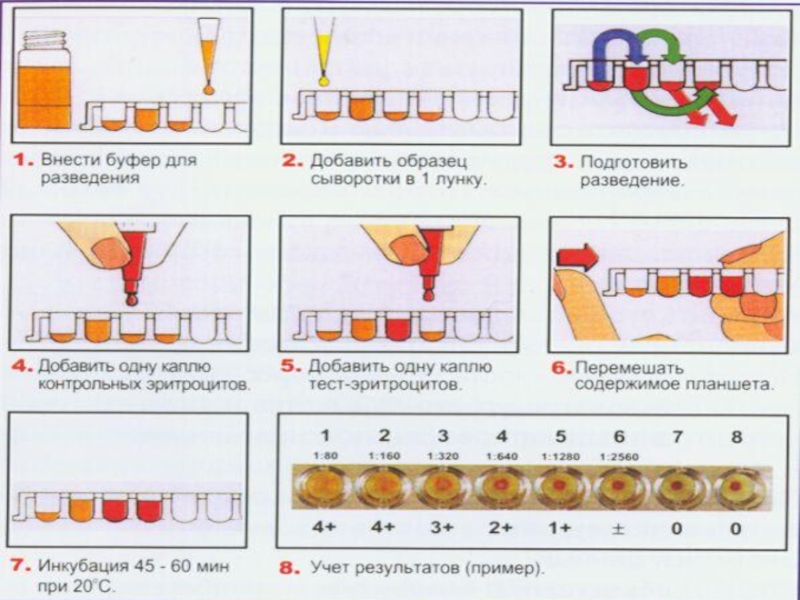
Слайд 28 Реакция пассивной, или непрямой, гемагглютинации (РПГА, РНГА)
В ней используют
эритроциты или нейтральные синтетические материалы (например, частицы латекса), на поверхности
которых сорбированы антигены (бактериальные, вирусные, тканевые) или антитела. Их агглютинация происходит при добавлении соответствующих сывороток или антигенов. Эритроциты, сенсибилизированные антигенами, называют антигенным эритроцитарным диагностикумом и используют для выявления и титрования антител. Эритроциты, сенсибилизированные антителами называют иммуноглобулиновыми эритроцитарными диагностикумами и применяют для выявления антигенов.Слайд 31РПГА в основном используют для диагностики сифилиса
Метод РПГА (ТРНА) основан
на агглютинации эритроцитов, сенсибилизированных антигенами Т. pallidum, в присутствии специфических
антитрепонемных антител.Слайд 32ГОНОРЕЯ
Гонорея – бактериальное инфекционное венерическое заболевание. Характеризуется воспалением слизистых оболочек
мочеполовых органов у взрослых и поражением конъюнктивы глаз у новорожденных
(бленнорея).Возбудители гонореи – гонококки (Neisseria gonorrhoeae).
Гонорея - одно из самых распространенных венерических заболеваний. Входными воротами для инфекции служит клеточный эпителий (уретры, шейки матки, конъюнктивы и прямой кишки). В организме гонококки распространяются по слизистым оболочкам, кровеносным и лимфатическим путям.
Слайд 34Лабораторная диагностика
Традиционные методы лабораторной диагностики гонореи - микроскопия мазков и
посев с выделением культуры гонококков. Из-за субъективной оценки результатов метод
микроскопии обладает низкой специфичностью и дает как ложноположительные, так и ложноотрицательные результаты. Посев с выделением культуры гонококков нередко дает ложноотрицательные результаты из-за потери жизнеспособности гонококков во время транспортировки биоматериала, а также из-за возрастающего количества некультивируемых L-форм.Оптимальным современным методом лабораторной диагностики гонорреи является ПЦР-исследование биоматериала (урогенитальные мазки-соскобы, из зева, с конъюнктивы глаза, суставная жидкость).
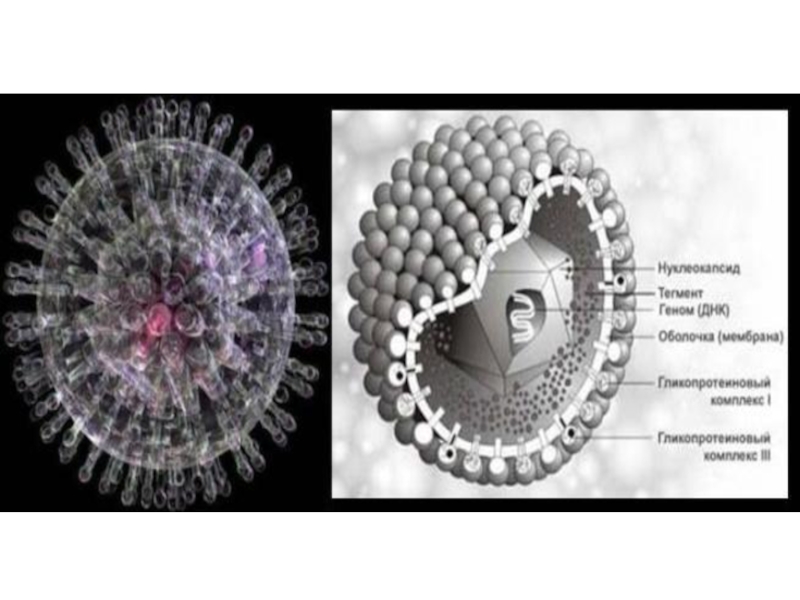
Слайд 35 ГЕРПЕСВИРУСНАЯ ИНФЕКЦИЯ
Наиболее распространенную герпесвирусную инфекцию вызывают вирусы простого герпеса 1-го
и 2-го типов - ВПГ 1,2. Единственным источником ВПГ 1,2
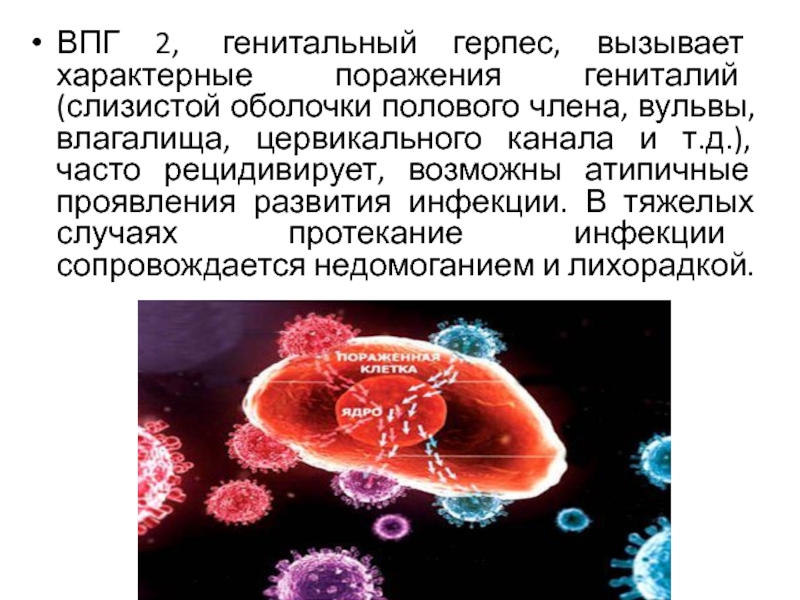
является человек. ВПГ 1,2 может передаваться контактным и половым путями, возможно перинатальное и внутриутробное заражение. Заражение ВПГ 1 часто происходит в раннем возрасте контактным путем. ВПГ 2 крайне редко выявляется у детей, а преимущественно обнаруживается у лиц, начавших половую жизнь (половой путь передачи). Однажды заразившись человек становится носителем герпесвирусов пожизненно.Слайд 36ВПГ 2, генитальный герпес, вызывает характерные поражения гениталий (слизистой оболочки
полового члена, вульвы, влагалища, цервикального канала и т.д.), часто рецидивирует,
возможны атипичные проявления развития инфекции. В тяжелых случаях протекание инфекции сопровождается недомоганием и лихорадкой.Слайд 38Лабораторная диагностика
Для диагностики герпесвирусных инфекций необходимо применять два лабораторных метода
– прямое выявление ДНК вирусов методом ПЦР и определение антител
к вирусам методом ИФА в сыворотке крови.Слайд 39КАНДИДОЗ
Более 70% микозов-кандидозов вызывает грибок Candida albicans. Микозы вызывают также
другие грибы рода кандида, а также другие роды грибов. Candida albicans
– может присутствует в норме в небольшом количестве в ротовой полости, в желудочно-кишечном тракте, во влагалище (103-105кл/мл). Снижение иммунитета, переохлаждение, нарушение нормального микробиоценоза (например, в результате применения антибиотиков) могут привести к заболеванию кандидозом.Слайд 40Урогенитальный кандидоз может быть эндогенного происхождения (активизация имеющихся Candida albicans
или рецидивирующий кандидоз), передаваться половым путем, а также контактно-бытовым путем
– через полотенца, губки и другие предметы личной гигиены, в бассейнах. Инфицирование детей может происходить также при прохождении через родовые пути и при кормлении грудью.КАНДИДОЗ
Слайд 42Лабораторная диагностика
Для выявления Candida albicans и Candida sp. в урогенитальном
мазке используют метод ПЦР. При диагностике микозов применяют также микробиологический
метод посева с выделением грибковых культур и определением их чувствительности к антимикотикам.Слайд 43
ПАПИЛЛОМАТОЗ
Папилломавирусы человека (ВПЧ - вирус папилломы человека) вызывают различные
варианты папилломатозов. Насчитывается более 100 типов ВПЧ, которые обозначаются номерами
и делятся на группы по различной степени онкогенного риска (риска развития злокачественных изменений в тканях). Разные типы ВПЧ предпочтительно развиваются в разных эпителиальных тканях. ВПЧ передаются через микротравмы кожи контактно и половым путем, а также от матери плоду.Слайд 44Генитальная папилломавирусная инфекция человека является одним из распространенных заболеваний, передаваемых
половым путем (20-60% инфицированных лиц). Наиболее часто это заболевание выявляется
среди молодых женщин и связано с ранним началом половой жизни и с большим количеством половых партнеров. Дополнительными эпидемиологическими факторами риска развития папилломавирусной инфекции являются изменение гормонального статуса, иммуносупрессия (снижение иммунитета), наличие других инфекций (ВИЧ, хламидиоза, бактериального вагиноза и других).Слайд 46Лабораторная диагностика
Для лабораторной диагностики папилломавирусной инфекции используют метод ПЦР. Биоматериалом
для исследования является соскоб с предположительного места поражения, биоптат. Методом
ПЦР можно выявлять определенные типы ВПЧ. Для этого создают соответствующие тест-ситемы. Проверять наличие ВПЧ высокого онкогенного риска актуально как при профилактических осмотрах, так и при патологических состояниях шейки матки. ПЦР-исследования ВПЧ позволяют обнаруживать онкогенные папилломавирусы задолго до появления заметных врачу онкологических изменений.Слайд 47ТОКСОПЛАЗМОЗ
Возбудитель токсоплазмоза – Toxoplasma gondii - простейшее из класса Sporozoea.
Источник
возбудителя - кошачьи, а также все промежуточные хозяева - другие
млекопитающие, птицы. Механизм передачи возбудителя фекально-оральный, пути передачи – пищевой (при употреблении полусырых мясных продуктов, но чаще с немытыми овощами), водный, бытовой. Возможно контактное заражение через микротравмы наружных покровов, а также передача половым путем.Наиболее опасен вертикальный механизм передачи – через плаценту от матери к плоду при первичном заражении беременных женщин в ранние сроки беременности (в 40% случаев).
Слайд 49Лабораторная диагностика
Для выявления токсоплазм в пробах крови, спинномозговой жидкости, пунктатах
лимфатических узлов, миндалин, остатках плодных оболочек, биоптатах пораженных органов, а
также в соскобах из цервикального канала используют метод ПЦР.Для определения носительства или стадии токсоплазмоза изучают антитела (иммуноглобулины – Ig) в сыворотке крови. IgM и низкоавидные IgG - маркеры первичного токсоплазмоза.
У здоровых носителей и при хроническом токсоплазмозе всегда выявляются IgG (высокоавидные), а IgM, как правило, не выявляются. Нарастание IgG в 2-4 раза свидетельствует о развитии инфекции. Во время первых двух лет хронического токсоплазмоза могут выявляться IgM. Низкоавидные IgG могут выявляться до 3-х месяцев после заражения.
Слайд 50ТРИХОМОНИАЗ
Трихомониаз (трихомоноз) вызывается простейшими Trichomonas vaginalis. Для этого заболевания характерно
комплексное поражение мочеполовой системы. Заболевание передается половым путем, а также от
матери - плоду. Редко возможен контактно-бытовой путь передачи – через полотенца, губки. Трихомонады могут сохранять жизнеспособность в неразведенных выделениях, в различных солевых растворах во внешней среде, защищенной от высыхания и УФ-лучей, на влажном белье, губках, в моче в течение нескольких часов, но плохо переносят гипотонические растворы, а высушивание и температура свыше 45 оС убивает их мгновенно.Слайд 52Лабораторная диагностика
Для лабораторной диагностики используют методы: пцр исследование урогенитального мазка,
мочи, спермы - для выявления трихомонад; ИФА сыворотки крови -
для выявления антител (IgG) к трихомонадам, а также микроскопию мазка и посев с выделением культуры трихомонад. Часто при наличии характерных клинических проявлений врачу достаточно для постановки диагноза результата ПЦР-исследования.Слайд 53ХЛАМИДИОЗЫ
Хламидии – бактерии, вызывающие различные заболевания урогенитального тракта и конъюнктивит
(Chlamydia trachomatis), хламидийную пневмонию, фарингит, проктит, атеросклероз, саркоидоз, бронхиальную астму,
ишемическую болезнь сердца (Chlamydia pneumoniae), орнитоз (Chlamydia psittaci). Хламидии вызывают также полиартриты, гастроэнтериты, менингоэнцефалиты и пиелонефриты.Chlamydia pneumoniae встречается только у человека, передается воздушно-капельным путем только от больного человека.
Chlamydia psittaci – является паразитом птиц, но может инфицировать человека и вызывать заболевания, которые без лабораторной диагностики и правильного лечения могут приводить к тяжелым последствиям.
Слайд 54Chlamydia trachomatis встречается преимущественно у человека, однако выявляется и у
животных (кошек, собак, крыс, зайцев и др.), которые могут быть
источниками инфекции для людей. Передача хламидийной инфекции может осуществляться половым путем и от матери плоду (внутриутробно – 6-7%, или во время родов – до 40%). Не исключается также контактно-бытовой путь передачи – через полотенца, губки, бассейны. Существует понятие «семейного» хламидиоза, при котором хламидийная инфекция развивается у родителей и детей – членов одной семьи. Заражение детей может происходить через общую постель и предметы личной гигиены. После заражения длительное время инфекция может протекать скрытно. Инкубационный период – от 5 до 30 дней.По данным ВОЗ урогенитальный хламидиоз (Chlamydia trachomatis) входит в первую тройку заболеваний, передаваемых половым путем, может приводить к бесплодию (до 50%), вызывает цервициты, эндометриты, вульвовагиниты, уретриты, цистоуретриты, проктиты, эпидидимиты, хронические пиелонефриты, сальпингиты и другие заболевания.
Слайд 56Лабораторная диагностика
хламидиозов основана на использовании двух методов – пцр диагностики
и ИФА. При подозрении на хламидиоз рекомендуется провести ПЦР-исследования соскобов
из цервикального/уретрального каналов, с конъюнктивы глаза, суставной жидкости (в зависимости от клинических проявлений). Причем при получении отрицательных результатов необходимо повторить забор материала еще 1-2 раза с интервалом в 2-3 недели и провести анализ. Это связано с биологическими особенностями хламидий и, соответственно, тем, что не каждый раз при заборе материала в пробу попадает определяемое количество возбудителей.Слайд 57ЦИТОМЕГАЛОВИРУСНАЯ ИНФЕКЦИЯ (ЦМВИ)
ЦМВИ – широко распространенная вирусная инфекция, характеризующаяся многообразными
проявлениями от бессимптомного течения до тяжелых форм с поражением внутренних
органов и центральной нервной системы.Цитомегаловирусы (ЦМВ) относятся к группе герпесвирусов.
Резервуаром и источником инфекции является только человек. Вирус может находиться в слюне, молоке, моче, испражнениях, семенной жидкости, в секрете шейки матки. Передача инфекции осуществляется через кровь, слюну, половым путем, а также вертикальным путем – от матери к плоду через плаценту.
Слайд 59Лабораторная диагностика
Лабораторная диагностика ЦМВ с помощью ПЦР очень эффективна при
любых формах ЦМВИ. В качестве клинического материала используют кровь, мочу,
ликвор, соскоб/мазок из цервикального канала.При обследовании беременных важно не только диагностировать ЦМВИ, но и отличить первичную инфекцию от вторичной (не столь опасной для плода). Для этого необходимо использовать сочетание ПЦР-исследования и определения специфических антител, иммуноглобулинов (Ig) методом ИФА.
Слайд 60Заключение
У каждой инфекции, передающейся половым путем, есть свои особенности, но
в целом у всех этих заболеваний есть много общего. Залогом
успешного лечения является заинтересованность в его успехе, как пациента, так и его лечащего доктора. не стоит доказывать тот факт, что избежать ЗППП значительно проще, чем избавиться от них. Поэтому не пренебрегайте правилами профилактики венерических заболеваний и регулярно проходите необходимое обследование. А при малейших подозрениях сразу же обращайтесь к врачу. Тем более что современные методы диагностики позволяют выявить возбудитель на ранних стадиях заражения.Слайд 61Список литературы:
Борисов Л.Б. Медицинская микробиология, вирусология, иммунология.- М.: МИА, 2001.
Коротяев
А.И, Бабичев С.Л. Медицинская микробиология, иммунология и вирусология. - СПб.:
Спец. лит, 2000.Медицинская микробиология /Гл.ред В.И. Покровский, O.K. Поздеев. - М.: ГЭОТАР МЕДИЦИНА, 1998, 2001, 2006.
Воробьев А.А., Кривошейн Ю.С., Широбоков В.П. Медицинская и санитарная микробиология М.: Издательский центр "Академия" – 2003.















![СРС 3. В результате присоединения праймеров образуются структуры [ДНК-матрица + праймер], являющиеся 3. В результате присоединения праймеров образуются структуры [ДНК-матрица + праймер], являющиеся «затравочными» комплексами. Начинается достраивание праймеров, начиная](/img/thumbs/1c43c202ed4b11e0a26ce0883efca8ea-800x.jpg)
![СРС Вновь синтезированные двуцепочечные ДНК после стадии денатурации [1] снова связывают праймеры, Вновь синтезированные двуцепочечные ДНК после стадии денатурации [1] снова связывают праймеры, которые находятся в смеси в избытке](/img/tmb/4/310279/56caa5d49196f804b61d421dc5fe66f4-800x.jpg)