Слайд 2План:
Применение первого начала термодинамики для анализа процессов в биологических системах.
Теплоемкость.
Теплообмен. Виды теплообмена. Энергетический баланс организма.
Второе начало термодинамики. Термодинамические функции
состояния.
Энтропия и термодинамическая вероятность. Организм как открытая система. Теорема Пригожина.
Слайд 3Термодинамика. Основные понятия
ТЕРМОДИНАМИКА – наука о законах превращения энергии из
одной формы в другую.
ОСНОВНЫЕ ПОНЯТИЯ
СИСТЕМА – совокупность элементов, отграниченных некоторым
образом от окружающей среды.
Слайд 5Основные понятия
ЭНЕРГИЯ – количественная мера определенного вида движения.
Энергия передается при:
совершении
работы;
теплообмене.
Мера передачи энергии в процессе теплообмена – количество теплоты.
Слайд 6М.В. Ломоносов (1744 г.), Гесс (1840 г.), Мейер, Джоуль (1842
г.),Гельмгольц (1847г.)
Общая суммарная энергия системы остается постоянной величиной, независимой от
изменений, происходящих в самой системе; изменение энергии системы возможно только в результате обмена с окружающей средой.
Первое начало термодинамики
Слайд 7Количество теплоты, переданное системе, идет на изменение ее внутренней энергии
и совершение системой работы.
dQ = dU+dA;
U – внутренняя
энергия,
Q – количество теплоты,
А – работа.
Первое начало термодинамики
Слайд 8Характеристика количества теплоты
Первичная (основная) теплота.
Образование первичной теплоты
– это результат того, что все процессы в организме имеют
КПД<100%
Вторичная (активная) теплота.
Это теплота, в которую преобразуется энергия всех процессов, происходящих в организме.
Слайд 9ОСОБЕННОСТИ ОРГАНИЗМА КАК ТЕРМОДИНАМИЧЕСКОЙ СИСТЕМЫ
биологические системы открыты для потока вещества
и энергии;
процессы в биологических системах имеют необратимый характер;
биологические системы гетерофазны
и структурированы;
живые системы далеки от равновесия.
Слайд 10Стационарное состояние характеризуется:
постоянным притоком веществ в систему и удалением продуктов
обмена;
постоянной затратой свободной энергии для поддержания постоянной концентрации веществ в
системе;
постоянством термодинамических параметров.
Слайд 11ЭНЕРГЕТИЧЕСКИЙ БАЛАНС ОРГАНИЗМА
Все виды работы в организме совершаются за счет
эквивалентного количества энергии, выделяющейся при окислении питательных веществ.
Q = Qп
+А – уравнение энергетического баланса, где Q – количество теплоты, освобождающегося в организме при усвоении пищи; Qп – потери в окружающую среду; А – совершенная работа.
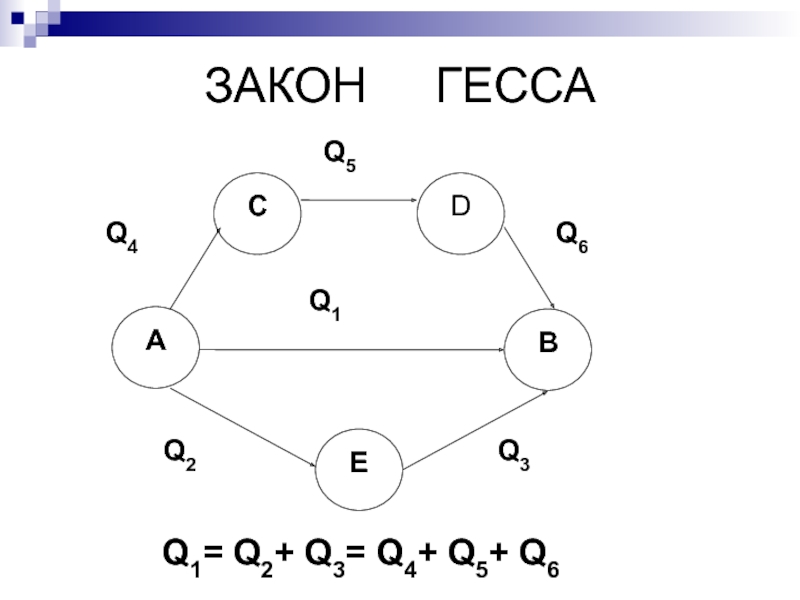
Слайд 12ЗАКОН ГЕССА
Тепловой эффект химического процесса, развивающегося через ряд
промежуточных стадий, не зависит от пути превращения, а определяется лишь
начальным и конечным состоянием системы.
Слайд 13ЗАКОН ГЕССА
Q1= Q2+ Q3= Q4+ Q5+ Q6
Слайд 14 Теплообмен человека и среды (тепловой баланс)
Организм человека поддерживает постоянную
температуру тела, которая отличается от температуры внешней среды. Вследствие этого
между телом человека и окружающей средой возникает теплообмен.
Задача организма состоит в обеспечении равенства между теплотой, выделяющейся в организме Qвыд и теплотой, отдаваемой в окружающую среду Qотд.
Qвыд- Qотд=0
Слайд 15ВИДЫ ТЕПЛООБМЕНА
за счет:
теплопроводности (15%)
конвекции (5-10%)
испарения (25-30 % )
теплового излучения (50%)
Слайд 16Теплоемкость тела C
Отношение энергии (или теплоты для процесса
теплообмена) δQ необходимой для изменения температуры тела от T до
T+dT к интервалу температур dT:
δQ=С dT
Слайд 17Теплообмен за счет теплопроводности
Теплопроводность - процесс передачи теплоты от
более нагретых частей системы к менее нагретым, происходящий без переноса
массы вещества и без излучения электромагнитных волн.
Слайд 18Закон Фурье:
где kT – коэффициент теплопроводности;
- градиент температуры
Ф
= Δ Q/Δt – тепловой поток
Слайд 19Теплообмен за счет теплопроводности
Слайд 20Теплообмен за счет конвекции
В жидкостях или газах возникают явления конвекции
(перемешивания)
Ф = kкS(T – T0), где kк – коэффициент теплопроводности
при конвекции; Т – температура поверхности; T0 – температура среды.
Слайд 21Теплообмен за счет испарения
Количество теплоты, расходуемой на парообразование:
Q = r·m
где m – масса испарившейся жидкости;
r – удельная теплота парообразования
Слайд 22Теплообмен за счет испарения
При н.у. человек выводит в сутки
из организма около 0,35 кг вместе с выдыхаемым воздухом и
около 0,5 кг в виде пота
Тепловые потери организма
0,85 · 2,52 · 106 = 2,1·106 Дж в сутки.
r = 2,52 · 106 Дж/кг.
Слайд 23ТЕПЛООБМЕН ЗА СЧЕТ ИЗЛУЧЕНИЯ
Происходит в ИК диапазоне с λ =
9,5 мкм.
P = Sασ(Т14 - Т04),
где Р –
мощность излучения;
S – площадь поверхности тела;
α– коэффициент излучения;
σ– постоянная Больцмана;
Т0 – температура окружающей среды;
Т1 – температура поверхности тела.
Слайд 24ПРИМЕНЕНИЕ В МЕДИЦИНЕ НАГРЕТЫХ И ХОЛОДНЫХ СРЕД
Термотерапия
контактное приложение (грелка, торф,
грязи, песок)
свето-тепловое облучение
воздействие ВЧ токами и полями
Охлаждение
местное охлаждение
местное обезболивание
метод гипотермии
Слайд 25ПРИМЕНЕНИЕ ПЕРВОГО НАЧАЛА ТЕРМОДИНАМИИКИ К ПРОЦЕССАМ В ИДЕАЛЬНОМ ГАЗЕ
Изохорный процесс
А
= 0, следовательно, dA=0 и dQ = dU
dQ = сv·m·dT;
сv·m·dT = dU;
U – U0 = сv·m·(T – T0); T0=0, U0 = 0,
U= сv·m·T
Энергия газа зависит от температуры
Слайд 26Изобарный процесс
dQ = ср·m·dT, следовательно,
dQ = dU+ dA
ср·m·dT
= сv·m·dT + РdV;
cP – cV = R – уравнение Майера для молярной теплоемкости
Слайд 27Изотермический процесс
Т = Const, dU = 0, dQ = dA
,
Адиабатный процесс
(Нет теплообмена с окружающей средой) dQ =0 А
= ΔU, При сжатии температура увеличивается, при расширении – уменьшается.
РVγ= Const – уравнение Пуассона
т.к. cP > cV, γ>1
Слайд 28Политропный процесс
(Теплоемкость вещества не изменяется)
РVn= Const ,
Слайд 29ЭНТРОПИЯ
Процесс 1-2 называется обратимым, если можно совершить обратный переход
2-1 через все промежуточные стадии так, что после возвращения системы
в исходное состояние в окружающих телах никаких изменений не происходит. Sобр=Const; ΔS=0
ΔSнеобр>0; Sравн= Smax
Слайд 30теплота сама собой не может переходить от тел с меньшей
температурой к телам с большей температурой (формулировка Клаузиуса)
невозможен вечный двигатель
второго рода, т. е. такой периодический процесс, единственным результатом которого было бы превращение теплоты в работу вследствие охлаждения одного тела ( формулировка Томсона).
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Слайд 31ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Энтропия изолированной системы возрастает в необратимом процессе
и остается неизменной в обратимом процессе; все реальные процессы в
изолированной системе протекают с увеличением энтропии.
Энтропия – мера перехода упорядоченных форм движения частиц в неупорядоченные.
Слайд 32Энтропия и термодинамическая вероятность
Термодинамической вероятностью Wтер называют число способов размещения
частиц или число микросостояний, реализующих данное макросостояние
S = k∙lnWтер –
формула Больцмана
k – постоянная Больцмана,
W – термодинамическая вероятность.
Слайд 33Организм как открытая система
Организм человека является открытой термодинамической
системой. Изменение энтропии открытой системы:
dS=dSe+dSi
где dSi - изменение энтропии, обусловленное
необратимыми процессами в системе;
dSe - изменение энтропии, вызванное взаимодействием системы с внешними телами (потоки, проходящие через систему).
Слайд 34Организм как открытая система
В стационарном состоянии (если параметры системы при
взаимодействии ее с окружающими телами не изменяются с течением времени)
т.е.
Слайд 35Теорема Пригожина
Для стационарного состояния ,
т.е. все процессы внутри системы протекают с увеличением энтропии.
энтропия
должна быть больше в продуктах выделения, а не продуктах питания.
Слайд 36В стационарном состоянии скорость возрастания энтропии вследствие необратимых процессов имеет
положительное и минимальное значение при данных внешних условиях:
Теорема Пригожина
,min
Слайд 37ТЕРМОДИНАМИЧЕСКИЕ ПОТЕНЦИАЛЫ
Внутренняя энергия
dQ = dU+ dA; dU=
dQ – dA; dQ = TdS; dA=PdV; U=f(S,V); dU= TdS
– PdV
Слайд 38Энергия Гемгольца (свободная энергия) F= U –TS
dF=dU –TdS –
SdT= TdS – PdV–TdS –SdT= =– PdV– SdT;
ТЕРМОДИНАМИЧЕСКИЕ ПОТЕНЦИАЛЫ
Т.е.
изменение свободной энергии равно работе, совершаемой системой в изотермическом процессе.
если Т = Const,
то dT=0 и dF= - PdV=dA,
если Т = Const,
то dT=0 и dF= - PdV=dA,
Слайд 39Энергия Гиббса
G=F+PV = U –TS +PV
dG=dU –TdS –SdT + PdV+VdP= TdS – PdV–TdS –SdT
+ PdV+VdP = VdP–SdT
ТЕРМОДИНАМИЧЕСКИЕ ПОТЕНЦИАЛЫ
Слайд 40ТЕРМОДИНАМИЧЕСКИЕ ПОТЕНЦИАЛЫ
Химический потенциал
Электрохимический потенциал
где R – универсальная газовая постоянная;
F
– число Фарадея; N – число частиц в системе
Z –
заряд частицы (с учетом знака)
Слайд 42
Уважаемые старосты!
Вы сдали списки отсутствующих?