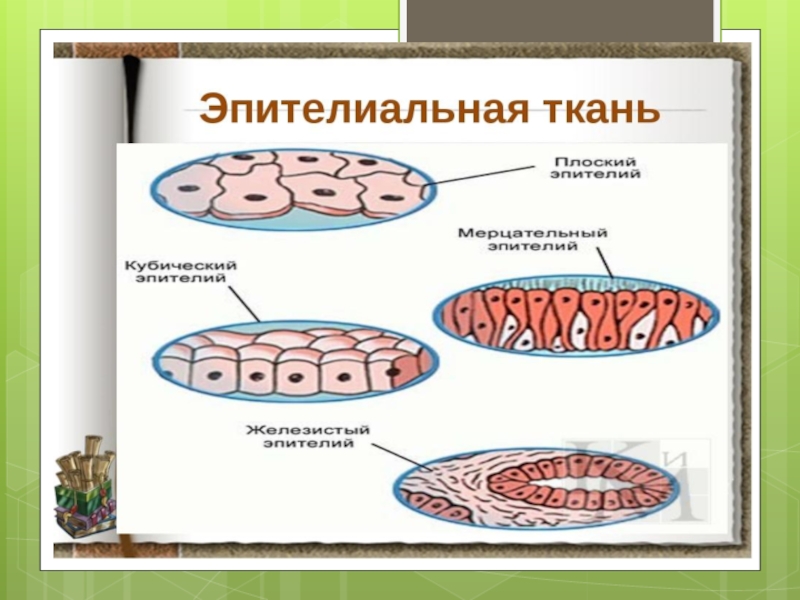
Слайд 1Ткани организмов. Культивирование тканей
Слайд 4Основные условия культивирования клеток и тканей
Слайд 9Культуры растущих тканей
Получение культур тканей основано на первичной эксплантации растущих
тканей, изолированных непосредственно из организма. К основной группе методов относятся
те, в которых используются предметные стекла с лунками, флаконы Карреля, а также пробирки и перфузионные камеры.
Эксплантацию небольших кусочков ткани для морфол, исследований в сочетании с микрокиносъемкой проводят на предметном стекле, к-рое потом накрывают специальным покровным стеклом и заклеивают. Более известны модификации этого метода: эксплантация на одинарное покровное стекло со сгустком плазмы, к-рое помещают над лункой предметного стекла (Гаррисон); метод Максимова с двойным покровным стеклом; метод культивирования в капле среды на покровном стекле [Льюис и Льюис (W. Lewis, М. Lewis)]. Методы культивирования К. к. и т. на стеклах удобны для кратковременных исследований, т. к. длительное ведение связано с необходимостью сложной замены питательной среды. Культуры на покровных стеклах можно пересевать. Для этого эксплантат рассекают на кусочки и переносят на новые покровные стекла. Каждый кусочек обрабатывают затем, как новый эксплантат.

Слайд 10Более длительное культивирование эксплантатов возможно в сгустке плазмы во флаконах
Карреля [Эрл (W. R. Earle)]. Метод используют при формировании линий
и штаммов клеток. Для этой цели во флаконы Карреля помещают каплю смеси плазмы и эмбрионального экстракта, к-рую распределяют по дну флакона, помещают кусочки ткани в плазму и дают образоваться сгустку, а затем приливают питательную среду. Ткань можно переносить из сосуда в сосуд, нарезая кусочками или трипсинизируя ткань и сгусток, как в случае получения первично трипсинизированных культур.
Культивирование в сгустке плазмы в неподвижной или вращающейся пробирке, метод «летающих стекол» близки к культивированию во флаконах Карреля. Эксплантаты можно укреплять на стенках пробирки или на узких покровных стеклах, которые помещают в пробирки с питательной средой. Пробирки можно поместить в наклонном положении во вращающийся барабан для лучшего контакта эксплантата со средой. Метод «летающих стекол» получил широкое применение для исследования большого числа эксплантатов
Слайд 11Вместо сгустка плазмы можно использовать подложки: коллагеновые, лавсановые (для дальнейших
электронно-микроскопических исследований), пластиковые, агаровые, из пористой бумаги, ацетатцеллюлозы. Можно эксплантировать
ткань и непосредственно на стекле, в частности при эксплантации кусочков кожи, макрофагов и других клеток, способных прикрепляться к стеклу. Задачей метода органных культур является создание условий культивирования, максимально близких к условиям in vivo. Основной принцип метода состоит в том, что эксплантат помещают на границе двух фаз —питательная среда/газовая смесь. Существует несколько вариантов поддержания органных культур: культивирование на поверхности плазменного сгустка, на часовом стекле в чашке Петри [Фелл (Н. Fell)] — классическая техника, являющаяся основой современных методов; культивирование в мягком (полутвердом) агаре, насыщенном питательной средой, эмбриональным экстрактом, сывороткой; культивирование на металлических (тантал или нержавеющая сталь) сетках, покрытых агаром
Слайд 12 [Троуэлл (О. Trowell)], нижняя поверхность которых касается жидкой питательной
среды; культивирование на «плоту» из ацетатцеллюлозы или папиросной бумаги [Чан
(J. Chan), 1954; Рихтер (Richter), 1955]; культивирование на миллипоровых фильтрах [Гробштейн (С. Grobstein), 1955]. Для создания оптимальных условий культуры инкубируют в газовой смеси, состоящей из 95% O2 и 5% CO2 с ежедневной сменой питательной среды. Широкое распространение в технике тканевых и органных культур имеют перфузионные камеры, позволяющие прижизненно изучать процессы развития.








![Ткани организмов. Культивирование тканей Более длительное культивирование эксплантатов возможно в сгустке плазмы во флаконах Карреля Более длительное культивирование эксплантатов возможно в сгустке плазмы во флаконах Карреля [Эрл (W. R. Earle)]. Метод используют](/img/thumbs/4f1b43da429dc96d87b59858bc8203ca-800x.jpg)

![Ткани организмов. Культивирование тканей [Троуэлл (О. Trowell)], нижняя поверхность которых касается жидкой питательной среды; [Троуэлл (О. Trowell)], нижняя поверхность которых касается жидкой питательной среды; культивирование на «плоту» из ацетатцеллюлозы или](/img/thumbs/54ff98a734312d09749694f0af3178cf-800x.jpg)