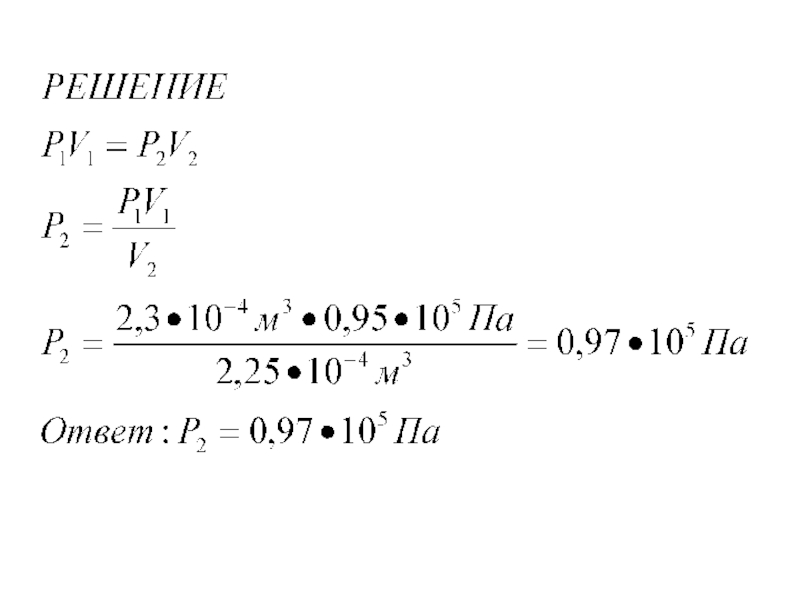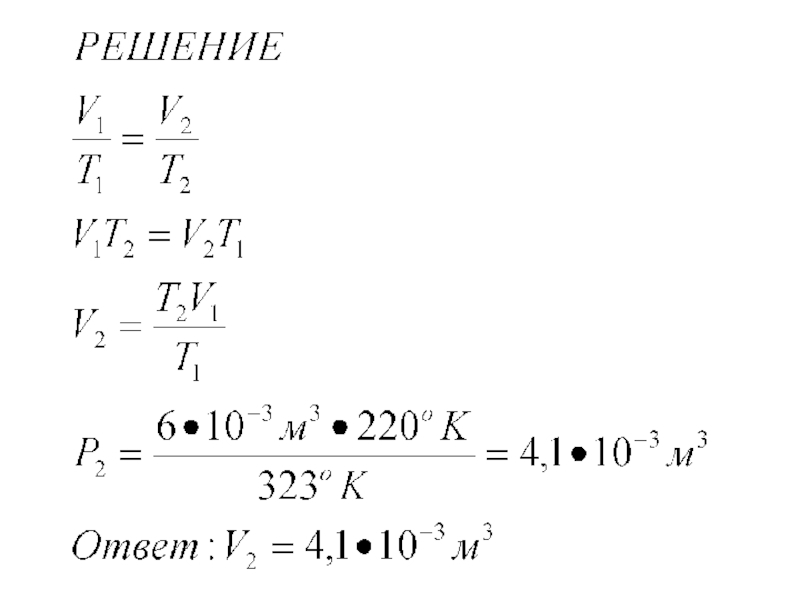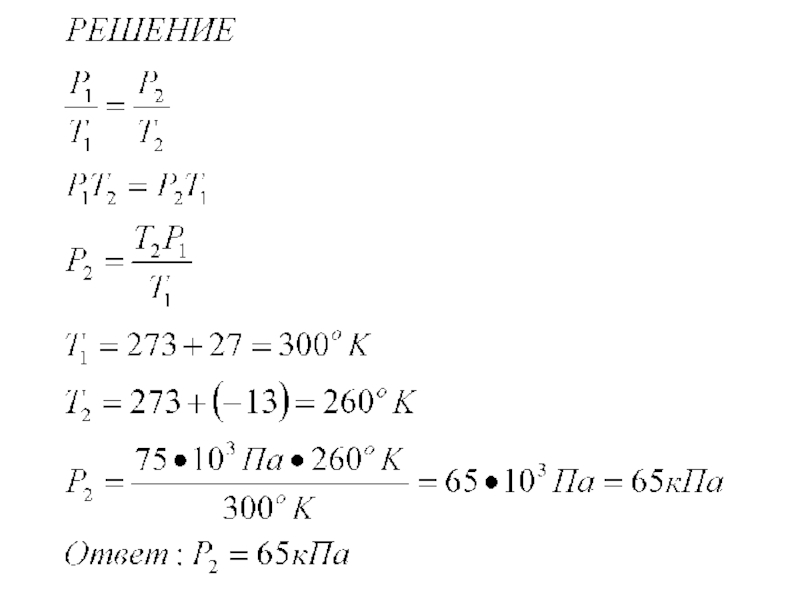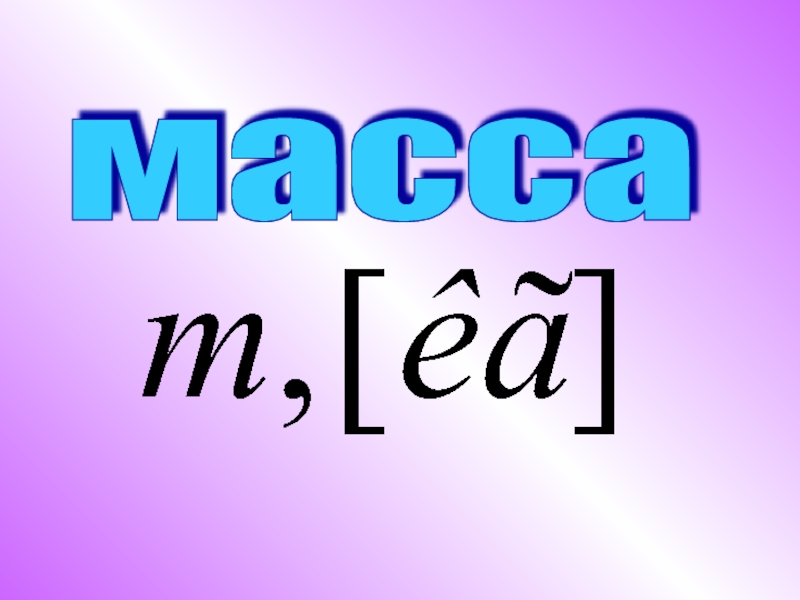Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
"Идеальный газ"
Содержание
- 1. "Идеальный газ"
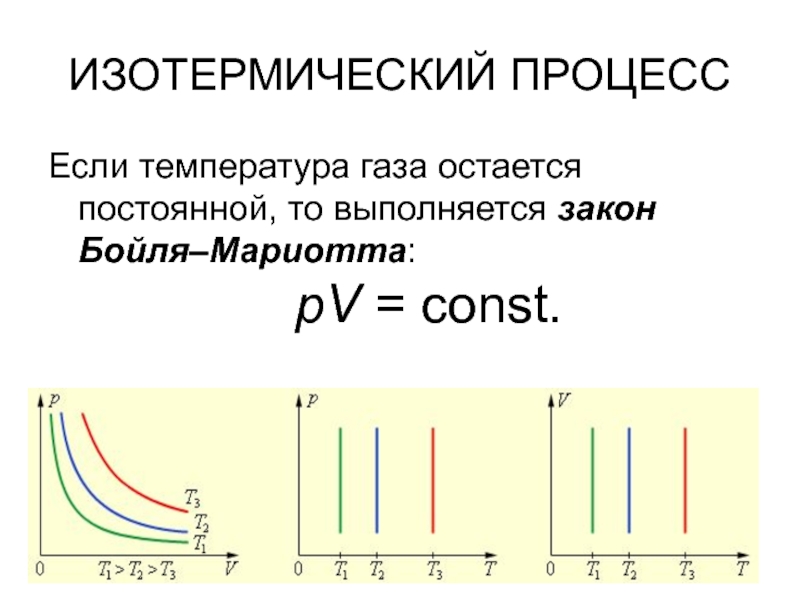
- 2. ЗАКОН БОЙЛЯ-МАРИОТТАЗАКОН БОЙЛЯ–МАРИОТТА – при неизменной температуре
- 3. ИЗОТЕРМИЧЕСКИЙ ПРОЦЕССЕсли температура газа остается постоянной, то
- 4. ЗАДАЧА 1 При каком давлении
- 5. Слайд 5
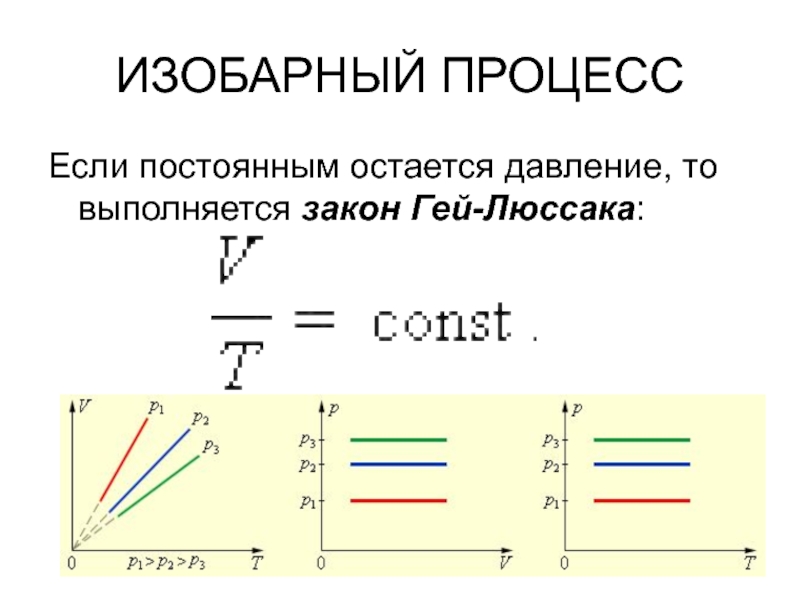
- 6. ЗАКОН ГЕЙ-ЛЮССАКАЗАКОН ГЕЙ-ЛЮССАКА– при неизменном давлении и
- 7. ИЗОБАРНЫЙ ПРОЦЕССЕсли постоянным остается давление, то выполняется закон Гей-Люссака:
- 8. ЗАДАЧА 2 В цилиндре под поршнем
- 9. Слайд 9
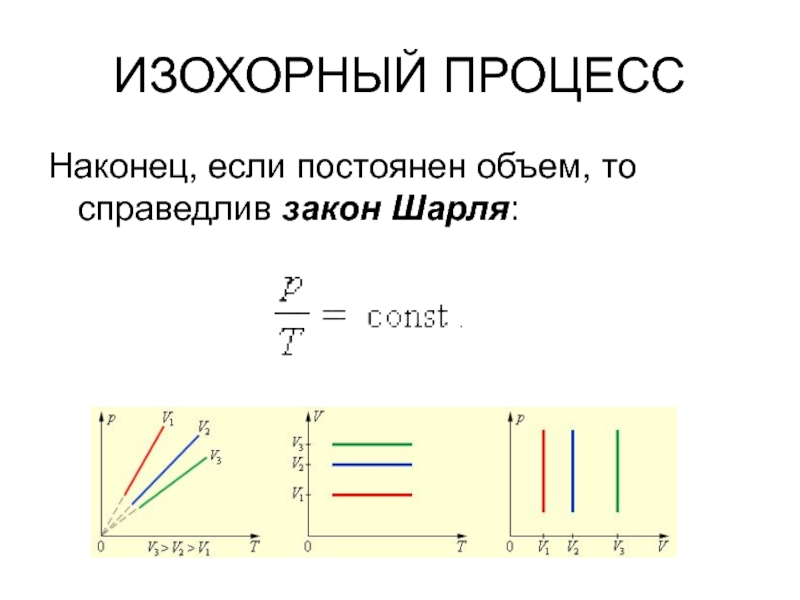
- 10. ЗАКОН ШАРЛЯ– при неизменном объеме и массе
- 11. ИЗОХОРНЫЙ ПРОЦЕССНаконец, если постоянен объем, то справедлив закон Шарля:
- 12. ЗАДАЧА 3 При температуре 27°С давление
- 13. Слайд 13
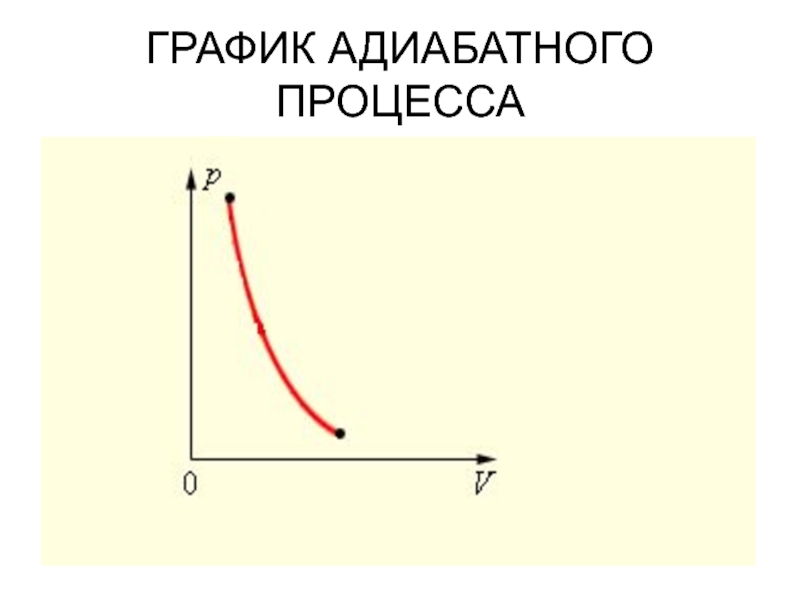
- 14. АДИАБАТНЫЙ ПРОЦЕССАДИАБАТИЧЕСКИЙ ПРОЦЕСС (адиабатный процесс)– это модель
- 15. ГРАФИК АДИАБАТНОГО ПРОЦЕССА
- 16. УРАВНЕНИЕ МЕНДЕЛЕЕВА-КЛАПЕЙРОНА
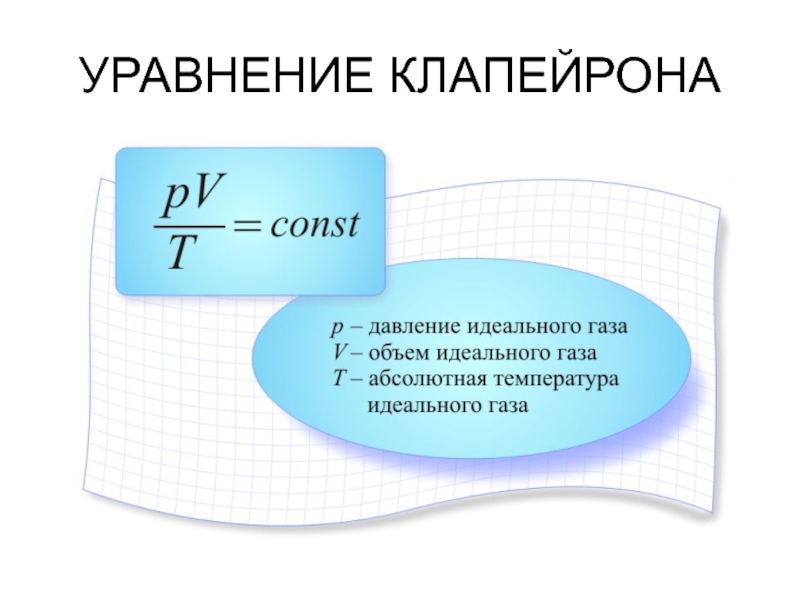
- 17. УРАВНЕНИЕ КЛАПЕЙРОНА
- 18. Скачать презентанцию
ЗАКОН БОЙЛЯ-МАРИОТТАЗАКОН БОЙЛЯ–МАРИОТТА – при неизменной температуре произведение объема данной массы газа на его давление является величиной постоянной. В современной физике закон Бойля–Мариотта рассматривается как одно из следствий уравнения состояния идеального