Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Модели атома. Презентация физика 9 класс
Содержание
- 1. Модели атома. Презентация физика 9 класс
- 2. Проверка домашнего заданияКак назвали способность атомов некоторых
- 3. 1903г. Джозеф Томсон предложил одну из
- 4. Модель Томсона нуждалась в экспериментальной проверке. Важно
- 5. Идея опыта Резерфорда:Зондировать атом альфа–частицами.Альфа-частицы возникают при
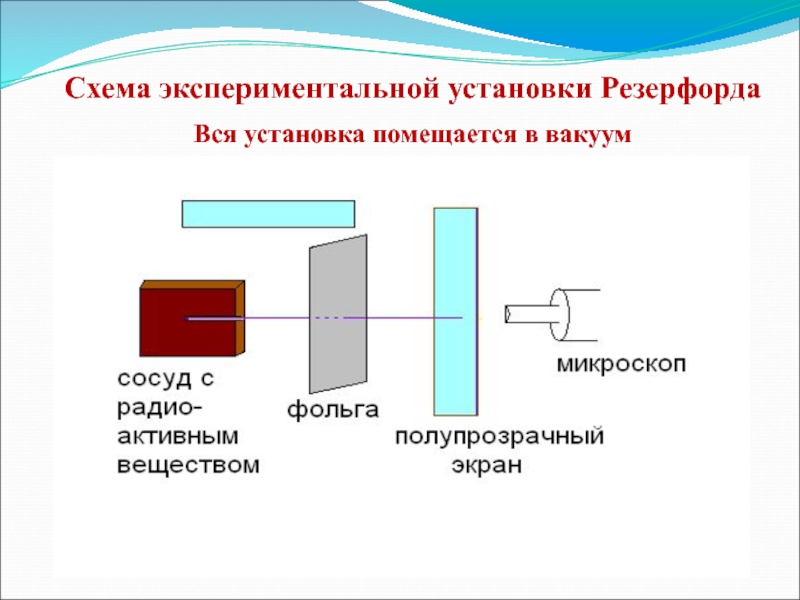
- 6. Схема экспериментальной установки Резерфорда Вся установка помещается в вакуум
- 7. В ходе эксперимента обнаружили:1. В отсутствии фольги
- 8. Противоречие модели Томсона с экспериментом1. Так как
- 9. Выводы из опыта по рассеиванию альфа-частиц
- 10. Процесс прохождения альфа-частиц сквозь атомы фольги
- 11. Недостаток планетарной модели атома Нельзя объяснить факт существования атома; Нельзя объяснить устойчивость атома.
- 12. Вопросы на закрепление:1. В чём заключается сущность
- 13. Скачать презентанцию
Проверка домашнего заданияКак назвали способность атомов некоторых химических элементов к самопроизвольному излучению?Как были названы частицы, входящие в состав радиоактивного излучения? Что представляют собой эти частицы?О чём свидетельствовало явление радиоактивности?Расскажите, как проводился
Слайды и текст этой презентации
Слайд 1Модели атомов
Опыт Резерфорда
Ученик 9 класса – Репин Роман
Руководитель –
учитель физики Бакурадзе Л.А.
Слайд 2Проверка домашнего задания
Как назвали способность атомов некоторых химических элементов к
самопроизвольному излучению?
Как были названы частицы, входящие в состав радиоактивного излучения?
Что представляют собой эти частицы?О чём свидетельствовало явление радиоактивности?
Расскажите, как проводился опыт Резерфорда, схема которого изображена на рис.136, стр181. Что выяснилось в результате этого опыта?
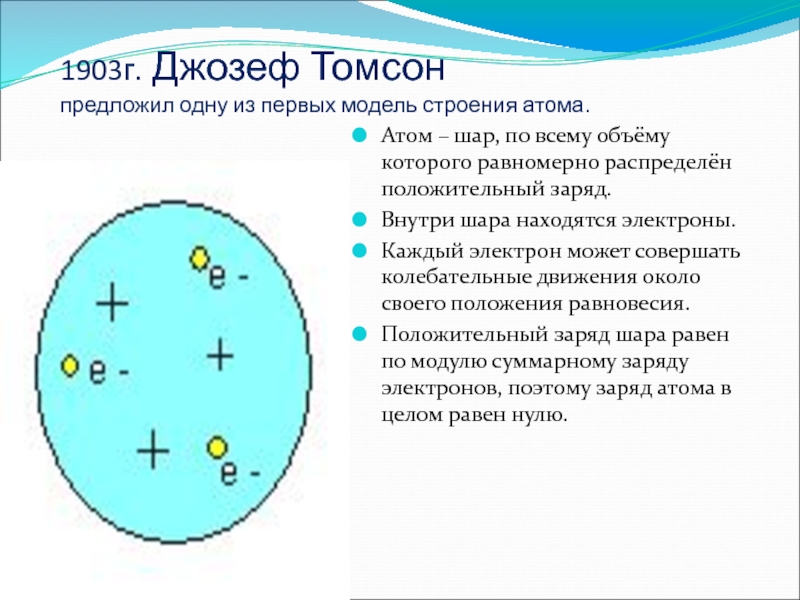
Слайд 31903г. Джозеф Томсон
предложил одну из первых модель строения атома.
Атом
– шар, по всему объёму которого равномерно распределён положительный заряд.
Внутри
шара находятся электроны.Каждый электрон может совершать колебательные движения около своего положения равновесия.
Положительный заряд шара равен по модулю суммарному заряду электронов, поэтому заряд атома в целом равен нулю.
Слайд 4Модель Томсона нуждалась в экспериментальной проверке. Важно было проверить, действительно ли
положительный заряд распределён по всему объёму атома с постоянной плотностью.
В 1911г. Эрнест Резерфорд совместно со своими сотрудниками провёл ряд опытов по исследованию состава и строения атомовСлайд 5Идея опыта Резерфорда:
Зондировать атом альфа–частицами.
Альфа-частицы возникают при распаде радия.
Масса
альфа-частицы в 8000 раз больше массы электрона.
Электрический заряд альфа-частицы в
2 раза больше заряда электрона.Скорость альфа-частицы около 15 000 км/с.
Альфа-частицы является ядром атома гелия.
Слайд 7В ходе эксперимента обнаружили:
1. В отсутствии фольги – на экране
появлялся светлый кружок напротив канала с радиоактивным веществом.
2. Когда на
пути пучка альфа-частиц поместили фольгу, площадь пятна на экране увеличилась.3. Помещая экран сверху и снизу установки, Резерфорд обнаружил, что небольшое число альфа-частиц отклонилось на углы около 900.
4. Единичные частицы были отброшены назад.
Слайд 8Противоречие модели Томсона с экспериментом
1. Так как масса электронов мала,
они не могут заметно изменить траекторию движения альфа-частиц.
2. Заметное рассеивание
альфа-частиц может вызвать только положительная часть атома и лишь в том случае, если она сконцентрирована в очень малом объёме.Слайд 9Выводы из опыта по рассеиванию
альфа-частиц Резерфорда
1. Существует атомное ядро,
т.е. тело малых размеров, в котором сконцентрирована
почти вся масса атома и весь положительный заряд.2. В ядре сконцентрирована почти вся масса атома.
3. Вокруг ядра по замкнутым орбитам вращаются отрицательные частицы- электроны.
4. отрицательный заряд всех электронов распределён по всему объёму атома.
Ядерная модель атома
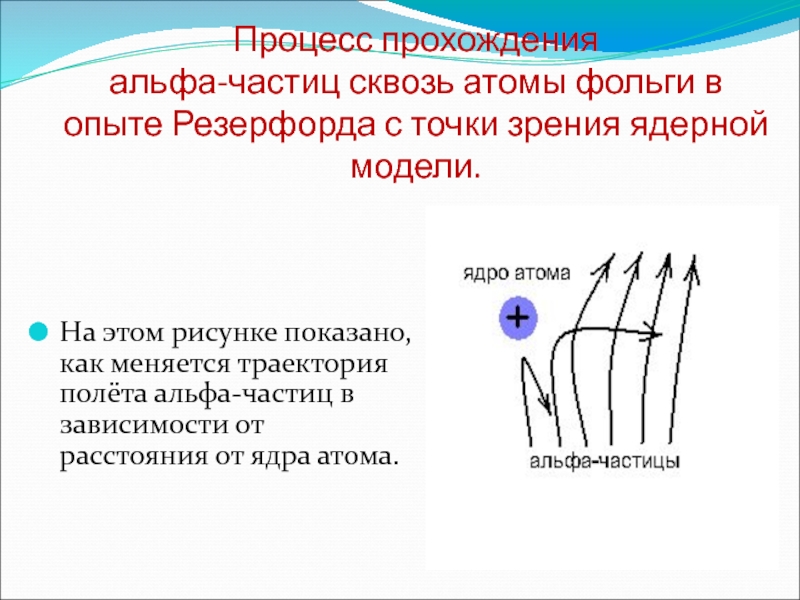
Слайд 10Процесс прохождения альфа-частиц сквозь атомы фольги в опыте Резерфорда с
точки зрения ядерной модели.
На этом рисунке показано, как меняется траектория
полёта альфа-частиц в зависимости от расстояния от ядра атома.
Слайд 11Недостаток
планетарной модели атома
Нельзя объяснить факт существования атома;
Нельзя
объяснить устойчивость атома.
Слайд 12Вопросы на закрепление:
1. В чём заключается сущность модели Томсона?
2. В
чём заключалась идея опыта Резерфорда?
3. Объясните по схеме опыт Резерфорда
по рассеиванию альфа-частиц. (Схема экспериментальной установки Резерфорда.) 4. Объясните причину рассеивания альфа-частиц атомами вещества.
5. В чём сущность планетарной модели атома?