Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация к интегрированному уроку химии и физики для 11 класса по теме Электрический ток в жидкостях. Закон электролиза
Содержание
- 1. Презентация к интегрированному уроку химии и физики для 11 класса по теме Электрический ток в жидкостях. Закон электролиза
- 2. Тема урока «Электрический ток в жидкостях . Закон электролиза»
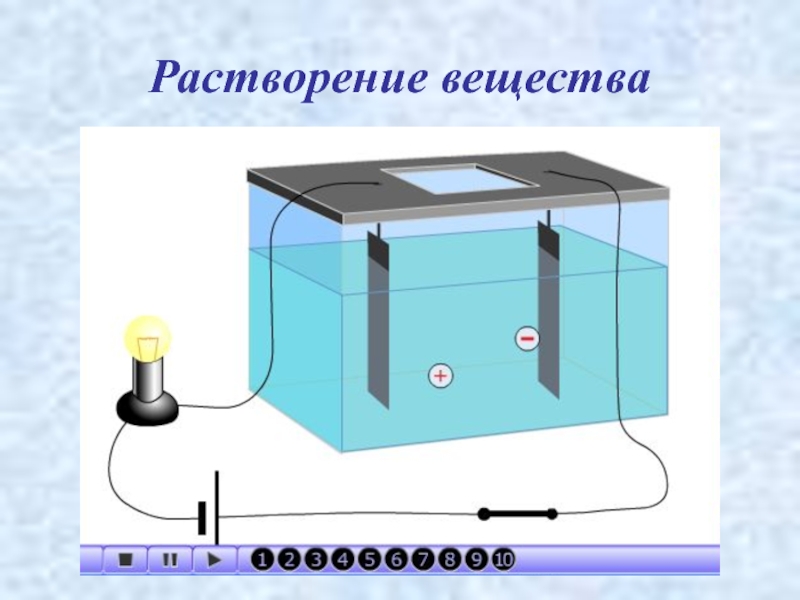
- 3. Растворение вещества
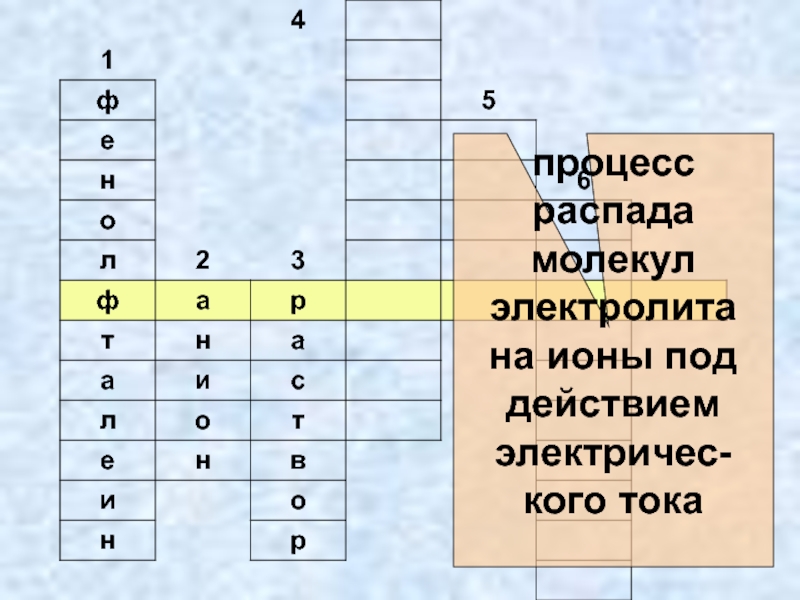
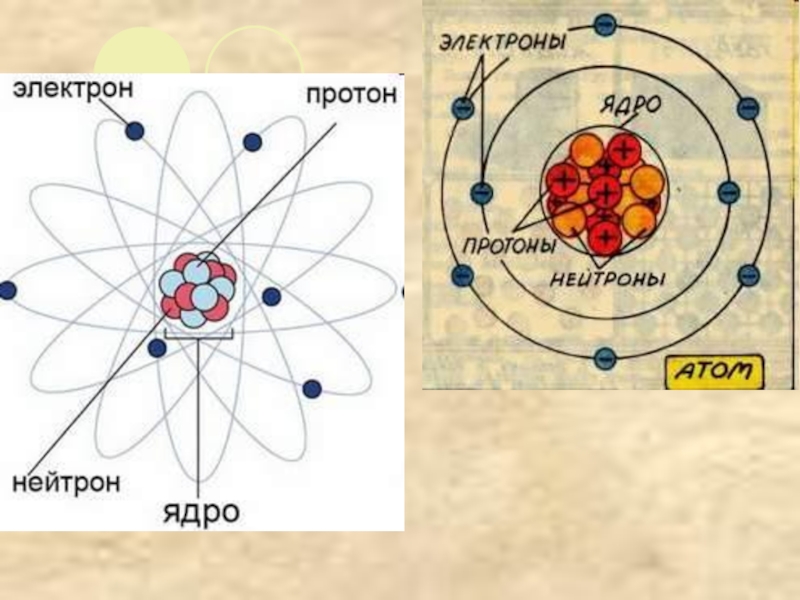
- 4. Электролитическая диссоциация процесс распада молекул электролита на ионы под действием электрического тока.
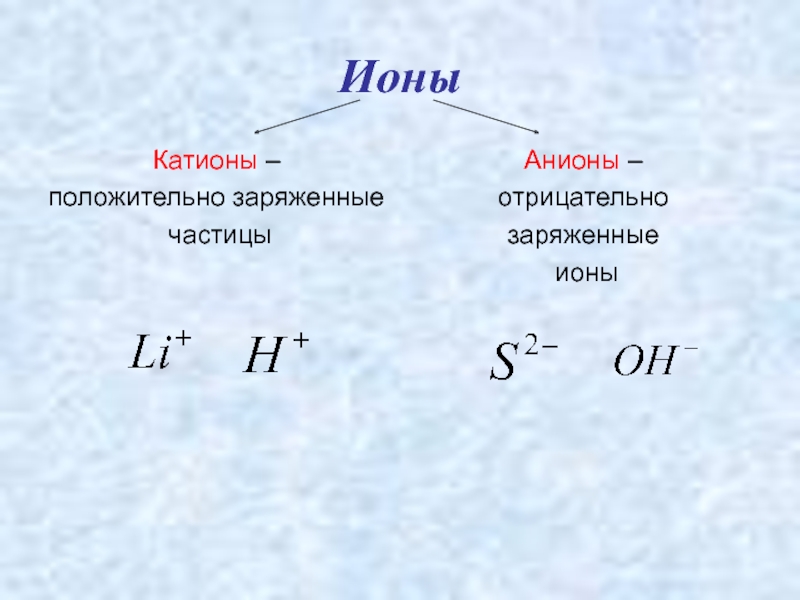
- 5. ИоныКатионы –положительно заряженные частицыАнионы – отрицательно заряженные ионы
- 6. Схема электролиза раствора KIСуммарное уравнение
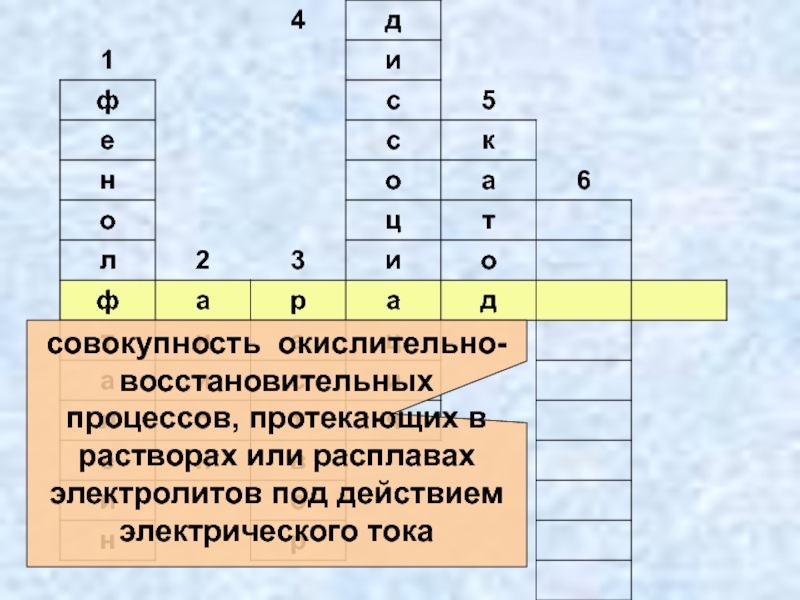
- 7. Электролиз - совокупность окислительно-восстановительных процессов, протекающих в растворах или расплавах электролитов под действием электрического тока.
- 8. Правила анодных процессов В первую очередь разряжаются
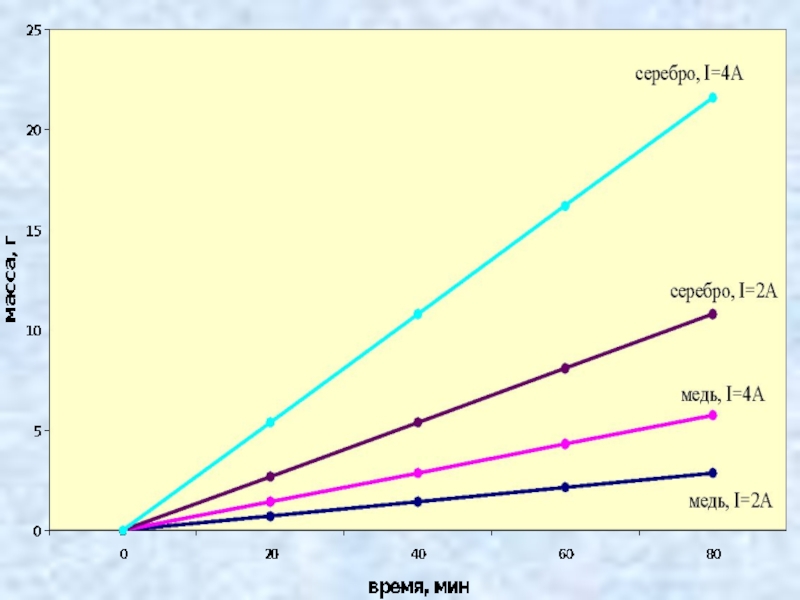
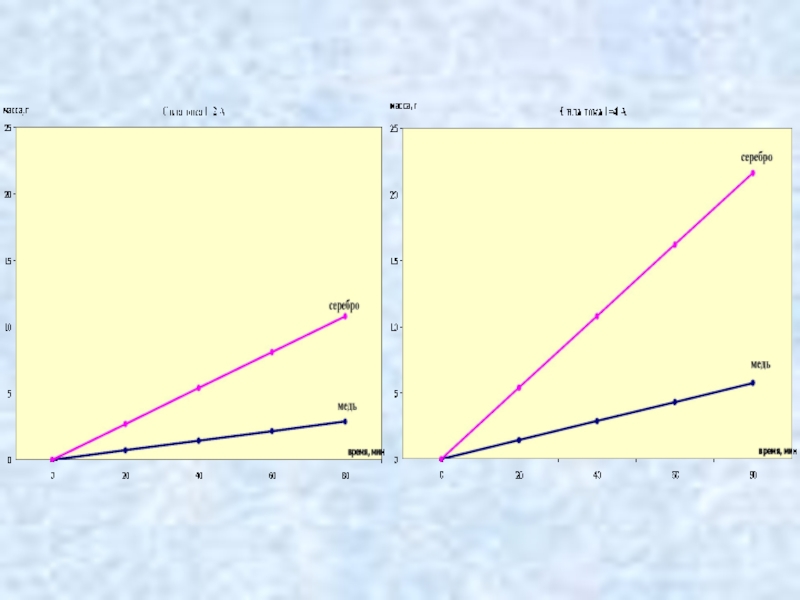
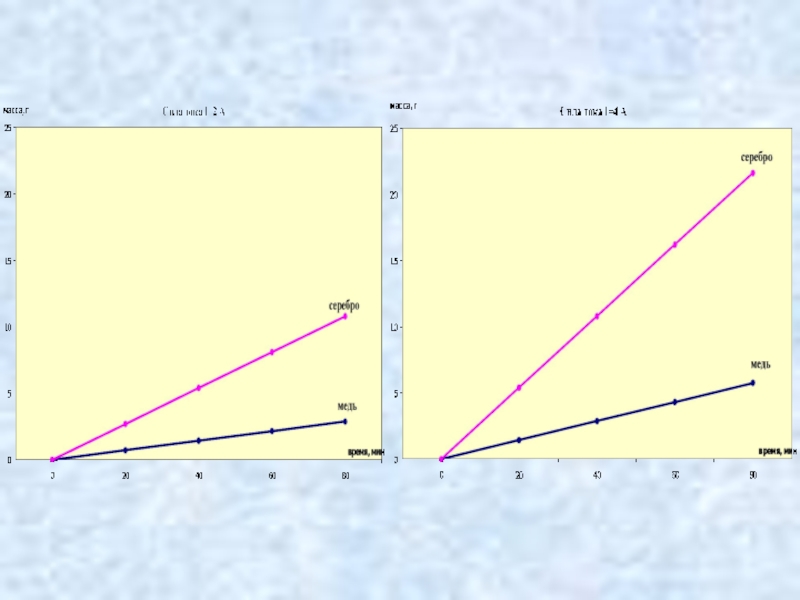
- 9. Виртуальный экспериментВыполнение виртуального исследования зависимости массы вещества, выделяющегося на катоде от времени и силы тока.
- 10. Слайд 10
- 11. Закон электролизамасса вещества, выделившегося на электроде за
- 12. Слайд 12
- 13. Электрохимический эквивалент
- 14. Слайд 14
- 15. k – электрохимический эквивалент
- 16. ЗадачаПри электролизе раствора сульфата железа (II) за
- 17. Электролиз- это процесс выделения на электроде вещества, связанный с окислительно- восстановительными реакциями.
- 18. Применение электролиза
- 19. Электрометаллургия – это…получение чистых металлов (Al, Na, Mg, Be)при электролизе расплавленных руд.
- 20. Домашнее заданиеПодготовить сообщение по теме «Применение электролиза в различных сферах деятельности человека»
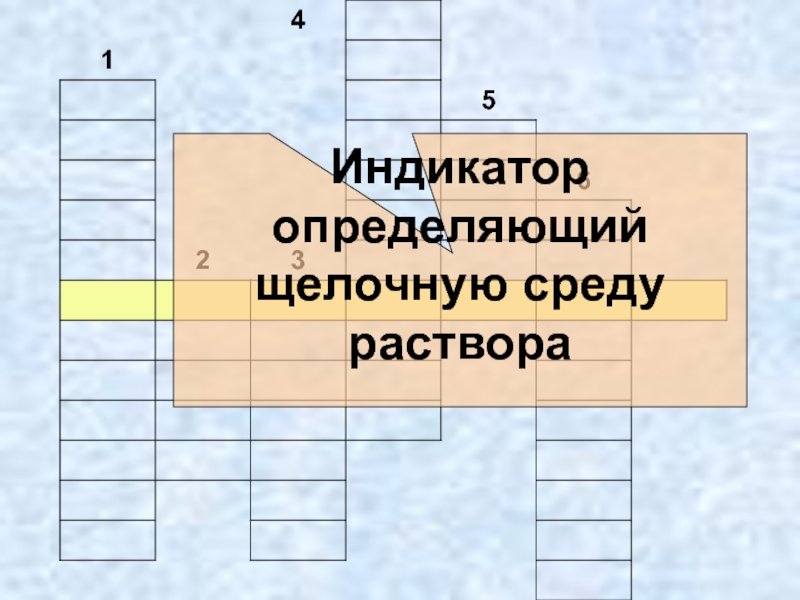
- 21. Индикатор определяющий щелочную среду раствора
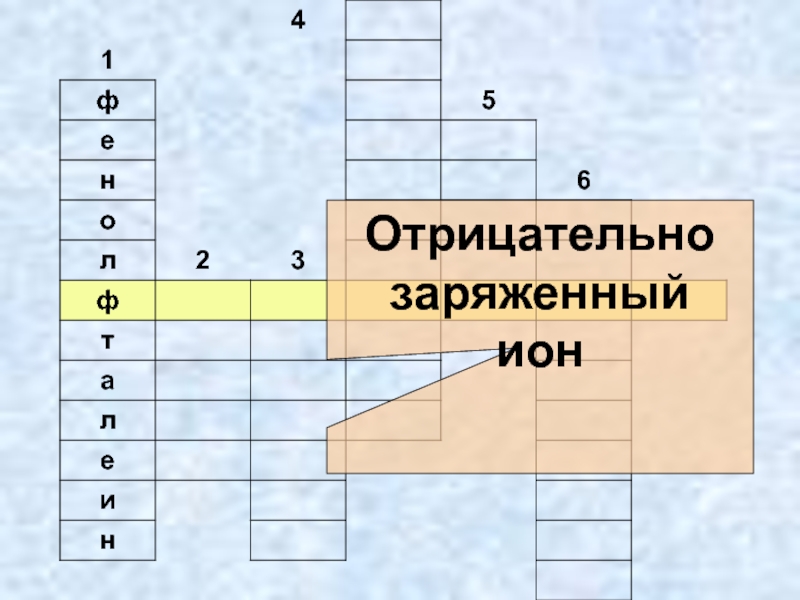
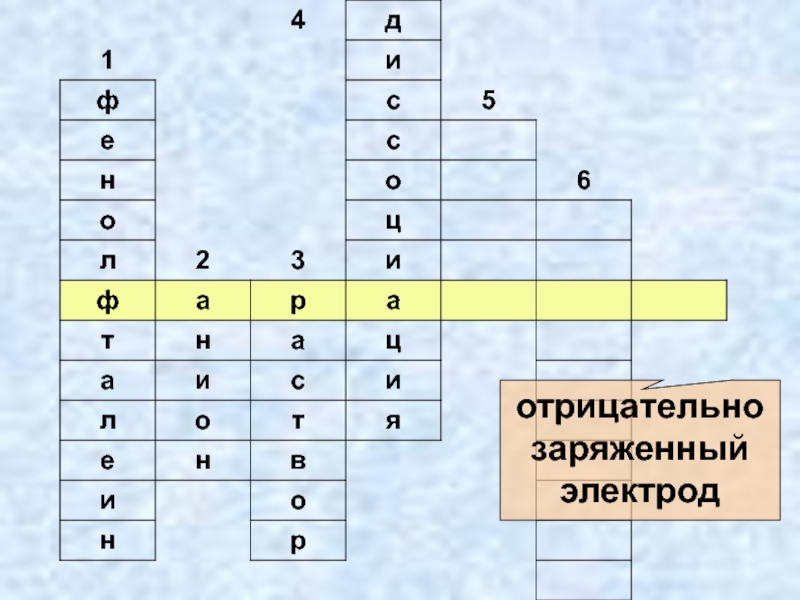
- 22. Отрицательно заряженныйион
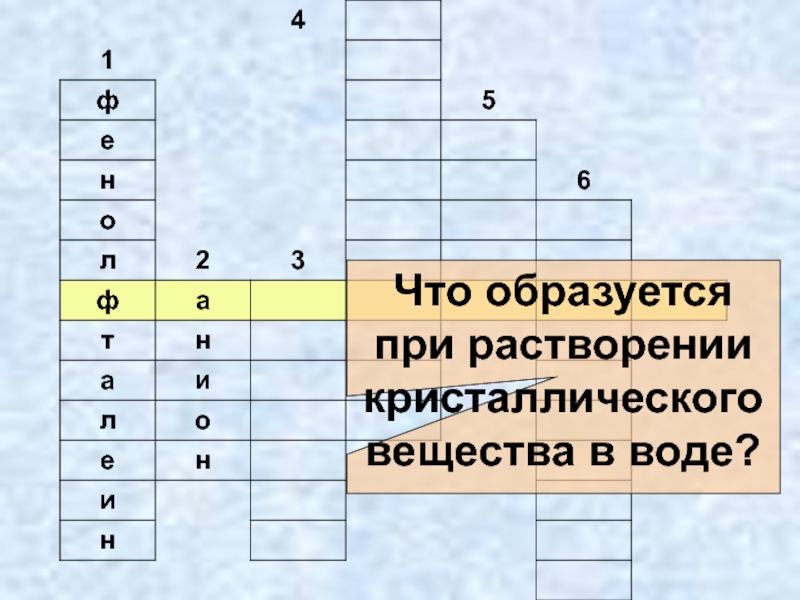
- 23. Что образуется при растворении кристаллического вещества в воде?
- 24. процесс распада молекул электролита на ионы под действием электричес-кого тока
- 25. отрицательно заряженный электрод
- 26. совокупность окислительно-восстановительных процессов, протекающих в растворах или расплавах электролитов под действием электрического тока
- 27. Слайд 27
- 28. Слайд 28
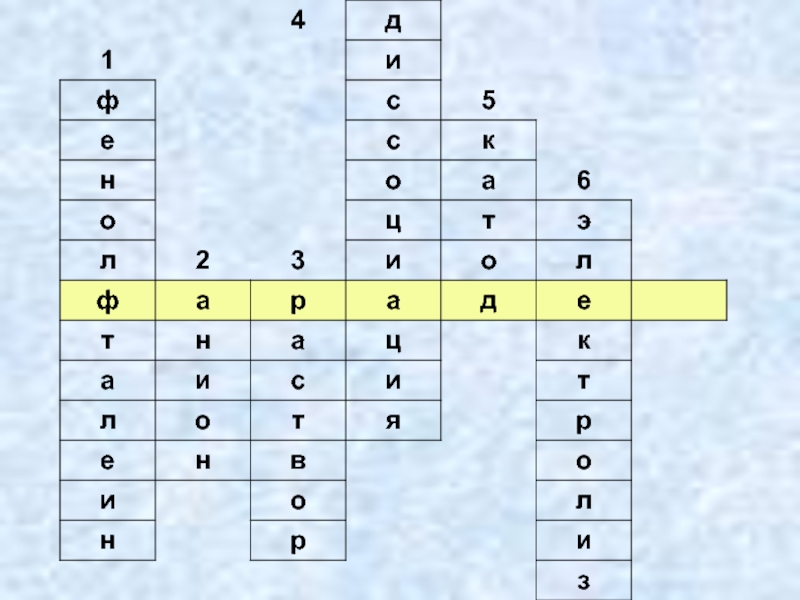
- 29. Майкл Фарадей(1791 – 1867гг.)
- 30. Электролиз –- это совокупность окислительно-восстановительных процессов, протекающих
- 31. Скачать презентанцию
Слайды и текст этой презентации
Слайд 4Электролитическая диссоциация
процесс распада молекул электролита на ионы
под действием электрического тока.
Слайд 7Электролиз -
совокупность окислительно-восстановительных процессов, протекающих в растворах или
расплавах электролитов под действием электрического тока.
Слайд 8Правила анодных процессов
В первую очередь разряжаются бескислородные ионы
( кислотные остатки
бескислородных кислот) : S- , I- , CI- , Br-.Во вторую очередь разряжаются гидроксид - ионы :
4 ОН- - 4е →О2 +2 Н2 О
3. В растворе не разряжаются анионы кислородосодержащих кислотных остатков и F-
Правила катодных процессов
В первую очередь на катоде разряжаются катионы металлов , стоящих в ряду напряжений металлов после водорода.
Во вторую очередь одновременно разряжаются катионы водорода 2 Н+ + 2 е → Н2 и катионы металла , стоящих в ряду напряжения металлы от алюминия до водорода.
В растворах никогда не разряжаются катионы металлов , стоящих в ряду напряжения металлов до алюминия ( включительно)
ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ МЕТАЛЛОВ
Li, К, Ва, Са, Nа, Mg, AI, Мn, Zn, Сr, Fe, Сo, Sn, РЬ, Н2 , Cu, Hg,Ag,Au
Слайд 9Виртуальный эксперимент
Выполнение виртуального исследования зависимости массы вещества, выделяющегося на катоде
от времени и силы тока.
Слайд 11Закон электролиза
масса вещества, выделившегося на электроде за время Δt при
прохождении электрического тока, пропорциональна силе тока и времени.
k – электрохимический
эквивалент.Слайд 16Задача
При электролизе раствора сульфата железа (II) за 20 минут выделилось
20 г чистого железа. Сколько выделится этого же вещества за
то же время, если силу тока увеличить в 2 раза?Ответ: 40 г.