Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация к уроку "Строение атома"
Содержание
- 1. Презентация к уроку "Строение атома"
- 2. Рассмотреть факты, доказывающие сложное строение атома.Познакомиться с
- 3. СодержаниеСтраницы историиДемокрит о строении веществаЯвления, указывающие на
- 4. Страницы историиV – IV века до н.э.
- 5. Демокрит (ок. 460 г. – 370
- 6. Явления, указывающие на сложное строение атома.Открытие электрона
- 7. Атом представляет собой электронейтральную систему шарообразной формы
- 8. Схема опыта:Эрнест Резерфорд 30.VIII.1871 – 19.X.1937Английский физик,
- 9. Результаты исследований РезерфордаОбнаружены единичные случаи рассеяния α-частиц
- 10. Модель атома Резерфорда Планетарная модель атома Атом
- 11. Структура атомаqp= + 1,6 × 10-19 Кл
- 12. Достоинства и недостатки планетарной модели атома Резерфорда
- 13. Кроссворд для самопроверки1. Английский ученый, предложивший планетарную
- 14. СПАСИБО ЗА УРОК!
- 15. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Презентация к уроку физики по теме «Строение атома»
Выполнила учитель физики
школы № 67 г. Брянска
Гуторова Е. В.
Слайд 2Рассмотреть факты, доказывающие сложное строение атома.
Познакомиться с историей открытия атома.
Познакомиться
с моделями строения атома Томсона и Резерфорда.
Сформировать целостное представление об
атоме на основе знаний из курсов физики и химии.?
Цели урока
Слайд 3Содержание
Страницы истории
Демокрит о строении вещества
Явления, указывающие на сложное строение атома
Модель
атома Томсона
Опыт Резерфорда
Результаты исследований Резерфорда
Модель атома Резерфорда
Структура атома
Достоинства и недостатки
планетарной моделиКроссворд для самопроверки
Еще, быть может, каждый атом –
Вселенная, где сто планет;
Там все, что здесь в объеме сжатом,
Но также то, чего здесь нет.
В. Брюсов
Слайд 4Страницы истории
V – IV века до н.э. Демокрит: «Существуют только
атомы и пустота. Атомы – неделимые материальные элементы, вечные, неразрушимые,
непроницаемые».Конец XIX века. Открытия явлений, указывающих на сложное строение атома. Возникновение необходимости создания модели атома.
1903 г. Дж. Томпсон. Модель атома «Булочка с изюмом».
1911 г. Эксперименты Э. Резерфорда. Планетарная модель атома.
1913 г. Квантовые постулаты Н. Бора. Модель атома водорода по Бору.
Слайд 5Демокрит
(ок. 460 г. – 370 г. до н.э.)
Древнегреческий философ,
один из основателей античной атомистики. По Демокриту, существуют только атомы
и пустота. Атомы – неделимые материальные элементы (геометрические тела, «фигуры»), вечные, неразрушимые, непроницаемые, различаются формой, положением в пустоте, величиной; движутся в различных направлениях, из их «вихря» образуются как отдельные тела, так и все бесчисленные миры; они невидимы для человека, истечения из них, действуя на органы чувств, вызывают ощущения. Говорил о множественности миров.Взгляды философа Демокрита на свойства атома
Слайд 6Явления, указывающие на сложное строение атома.
Открытие электрона и измерение его
заряда и массы
Открытие явления радиоактивности
Открытие линейчатого спектра
Открытие явления фотоэффекта
Открытие рентгеновского
излученияСлайд 7Атом представляет собой электронейтральную систему шарообразной формы радиусом примерно равным
10–10 м. Положительный заряд атома равномерно распределен по всему объему шара,
а отрицательно заряженные электроны находятся внутри него.Джозеф Джон Томсон
18.XII.1856 – 30.VIII.1940
Английский физик, член Лондонского королевского общества, профессор Кембриджского университета и руководитель Кавендишской лаборатории, лауреат Нобелевской премии 1906 года.
Модель атома Томсона
«Булочка с изюмом»
Слайд 8Схема опыта:
Эрнест Резерфорд
30.VIII.1871 – 19.X.1937
Английский физик, лауреат Нобелевской премии по
физике 1908 года. Один из основателей учения о радиоактивности, ядерной
физики и представлений о строении атомов.Опыт Резерфорда
K – свинцовый контейнер
с радиоактивным веществом;
Э – экран, покрытый сернистым цинком;
Ф – золотая фольга;
M – микроскоп.
Цель: экспериментальная проверка модели атома Томсона
Слайд 9Результаты исследований Резерфорда
Обнаружены единичные случаи рассеяния α-частиц на углы, большие
900. Следовательно, не весь атом представляет препятствие для летящих частиц.
«Это
было столь же неправдоподобным, как если бы вы произвели выстрел по обрывку папиросной бумаги пятнадцатидюймовым снарядом, а он вернулся бы назад и угодил в вас.»Выводы:
1. Модель атома Томсона противоречит результатам эксперимента.
2. Положительный заряд атома и почти вся его масса сконцентрирована в области в 10000 раз меньшей размера атома.
Из воспоминаний Резерфорда
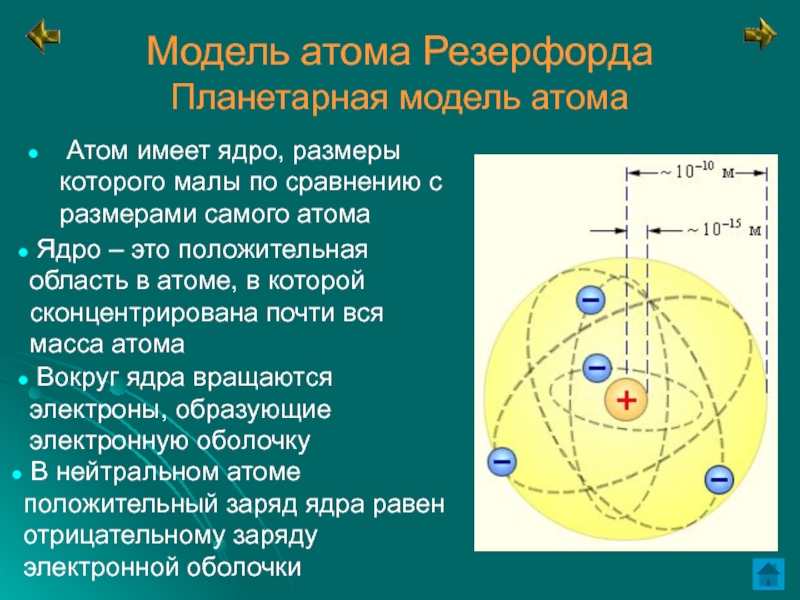
Слайд 10Модель атома Резерфорда
Планетарная модель атома
Атом имеет ядро, размеры которого
малы по сравнению с размерами самого атома
Ядро – это
положительная область в атоме, в которой сконцентрирована почти вся масса атома Вокруг ядра вращаются электроны, образующие электронную оболочку
В нейтральном атоме положительный заряд ядра равен отрицательному заряду электронной оболочки
Слайд 11Структура атома
qp= + 1,6 × 10-19 Кл
mp= 1,6724 × 10-27
кг
qn= 0
mn= 1,6747 × 10-27 кг
10-19 Кл
10-27 кг
Атом
qe= - 1,6
× 10-19 Кл
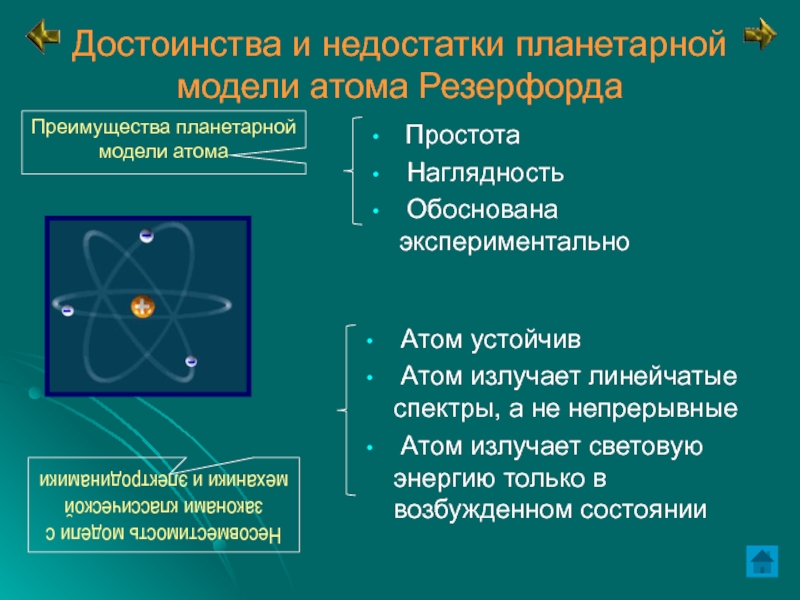
me= 9,1 × 10-31 кгСлайд 12Достоинства и недостатки планетарной модели атома Резерфорда
Простота
Наглядность
Обоснована
экспериментально
Атом устойчив
Атом излучает линейчатые спектры, а не непрерывные
Атом излучает световую энергию только в возбужденном состоянииНесовместимость модели с законами классической механики и электродинамики
Преимущества планетарной модели атома
Слайд 13Кроссворд для самопроверки
1. Английский ученый, предложивший планетарную модель атома.
2. Он
входит в состав любого вещества.
3. Отрицательно заряженная частица атома.
4. Античный
философ, основоположник атомистики.5. И электрон, и протон, и нейтрон.
6. Английский ученый, модель атома которого называют «Булочкой с изюмом».
7. Положительная область атома, в которой сконцентрирована почти вся его масса.