Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Строение атомного ядра
Содержание
- 1. Строение атомного ядра
- 2. Тема урока:«Строение атомного ядра»
- 3. Представление об атомах как неделимых мельчайших частицах
- 4. Большую роль в развитии атомистической теории сыграл
- 5. Важным свидетельством сложной структуры атомов явились спектроскопические
- 6. В 1896 году А. БеккерельВ 1896 году А. Беккерель обнаружил явление испускания атомами невидимых проникающих излучений, названное радиоактивностью.
- 7. В 1897 году Дж. Томсон открыл электрон и измерил
- 8. Модель атома Томсона(1903г)Он считал, что атом представляет
- 9. Слайд 9
- 10. Первые прямые эксперименты по исследованию внутренней структуры
- 11. Опыт Резерфорда K – свинцовый контейнер
- 12. Слайд 12
- 13. Было обнаружено, что большинство α-частиц проходит через
- 14. Этот результат был совершенно неожиданным даже для
- 15. Слайд 15
- 16. Резерфорд пришёл к выводу, что атом почти
- 17. Планетарная модель атомаСогласно этой модели, в центре
- 18. К 20-м годам XX века физики уже не
- 19. В 1919 году Э. Резерфорд обнаружил ядра атома водорода
- 20. Схема опытов Резерфорда по обнаружению протонов в
- 21. По современным измерениям, положительный заряд протона в
- 22. Масса протона, по современным измерениям, равна m р = 1,67262·10 -27 кг. 1 а. е. м. = 1,66057·10 -27 кг. Следовательно, mр = 1,007276 · а. е. м.
- 23. После открытия протона было высказано предположение, что ядра атомов состоят из одних протонов
- 24. В 1920 г. Резерфорд высказал гипотезу о существовании
- 25. Это была очень красивая, но, как выяснилось
- 26. 1932 г. Чедвик экспериментально исследовал излучение, возникающее при
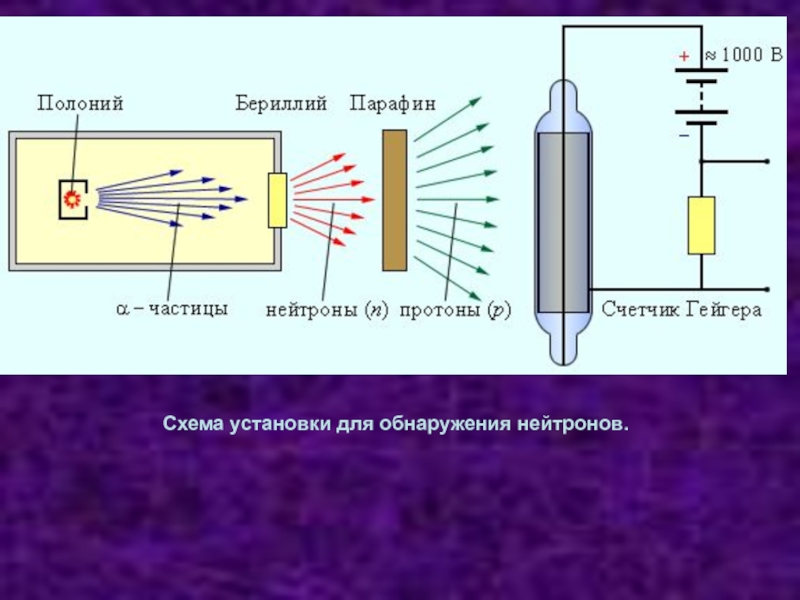
- 27. Схема установки для обнаружения нейтронов.
- 28. Нейтрон – это элементарная частица По современным
- 29. Сразу же после открытия нейтрона российский ученый
- 30. Число протонов, входящих в состав атомного ядра,
- 31. Заряд ядра равен Z∙ e, где e – элементарный заряд. Число нейтронов обозначают символом N.
- 32. Общее число нуклонов (т. е. протонов и нейтронов) называют массовым числом A: A = Z + N.
- 33. Ядра одного и того же химического элемента могут отличаться числом нейтронов. Такие ядра называются изотопами
- 34. У большинства химических элементов имеется несколько изотопов.
- 35. Для того, чтобы атомные ядра были устойчивыми,
- 36. Они представляют собой проявление самого интенсивного из
- 37. Энергия связи ядра Е св равна минимальной
- 38. Масса любого ядра Mя всегда меньше суммы
- 39. Разность масс ΔM = Z∙mp + N∙mn – Mя. называется дефектом массы.
- 40. Энергия связиEсв = ΔM∙c2 = (Z∙mp + N∙mn – Mя)c2. Эта энергия выделяется при образовании ядра в виде излучения γ-квантов.
- 41. Образование всего 1 г гелия сопровождается выделением энергии
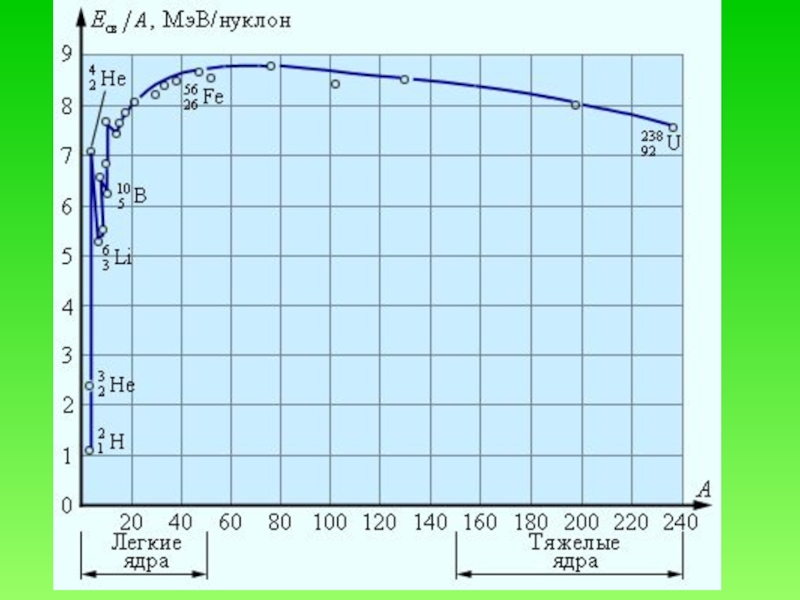
- 42. Удельная энергия связи - энергия связи, приходящаяся на один нуклон
- 43. Слайд 43
- 44. Уменьшение удельной энергии связи при переходе к
- 45. Самостоятельная работаОпределите состав ядра атома 31
- 46. 3. Рассчитайте энергию связи нуклонов в ядре
- 47. Молодцы !
- 48. Скачать презентанцию
Тема урока:«Строение атомного ядра»
Слайды и текст этой презентации
Слайд 1Добрый день !
Десяткова Татьяна Владимировна преподаватель физики Ачитского филиала
ГБОУ СПО СО «Красноуфимский аграрный колледж»
Слайд 3Представление об атомах как неделимых мельчайших частицах вещества возникло еще
в античные времена, но только в XVIII веке трудами А. Лавуазье, М. В. Ломоносова
и других ученых была доказана реальность существования атомов.Слайд 4Большую роль в развитии атомистической теории сыграл выдающийся русский химик
Д. И. Менделеев, разработавший в 1869 году периодическую систему элементов, в которой впервые
был поставлен вопрос о единой природе атомов.Слайд 5Важным свидетельством сложной структуры атомов явились спектроскопические исследования, которые привели
к открытию линейчатых спектров атомов. В начале XIX века были открыты
дискретные спектральные линии в излучении атомов водорода в видимой части спектра, и впоследствии были установлены математические закономерности, связывающие длины волн этих линий (И. Бальмер, 1885 г.).Слайд 6В 1896 году А. БеккерельВ 1896 году А. Беккерель обнаружил явление испускания атомами невидимых
проникающих излучений, названное радиоактивностью.
Слайд 7В 1897 году Дж. Томсон открыл электрон и измерил отношение e / m заряда
электрона к массе. Опыты Томсона подтвердили вывод о том, что
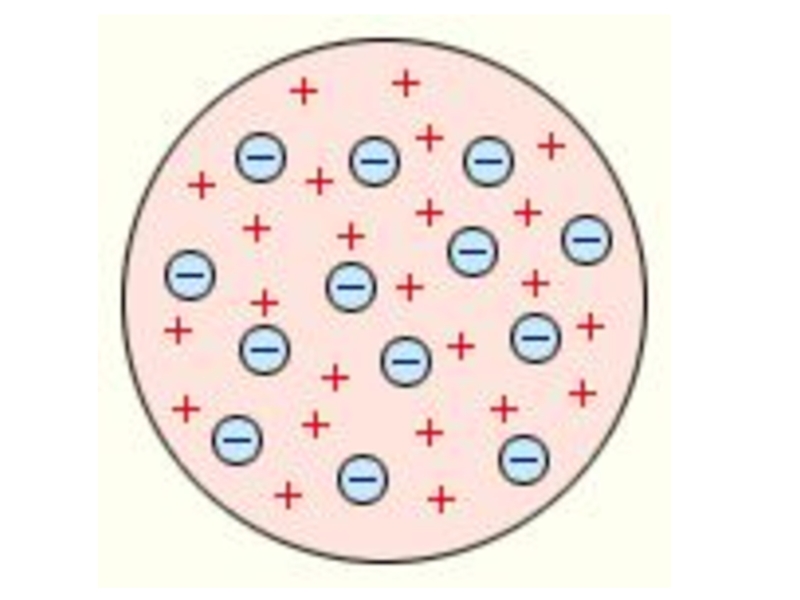
электроны входят в состав атомов.Слайд 8Модель атома Томсона(1903г)
Он считал, что атом представляет собой электронейтральную систему
шарообразной формы радиусом примерно равным 10 -10 м. Положительный заряд атома
равномерно распределен по всему объему шара, а отрицательно заряженные электроны находятся внутри него .Слайд 10Первые прямые эксперименты по исследованию внутренней структуры атомов были выполнены
Э. Резерфордом и его сотрудниками Э. Марсденом и Х. Гейгером в 1909–1911 годах.
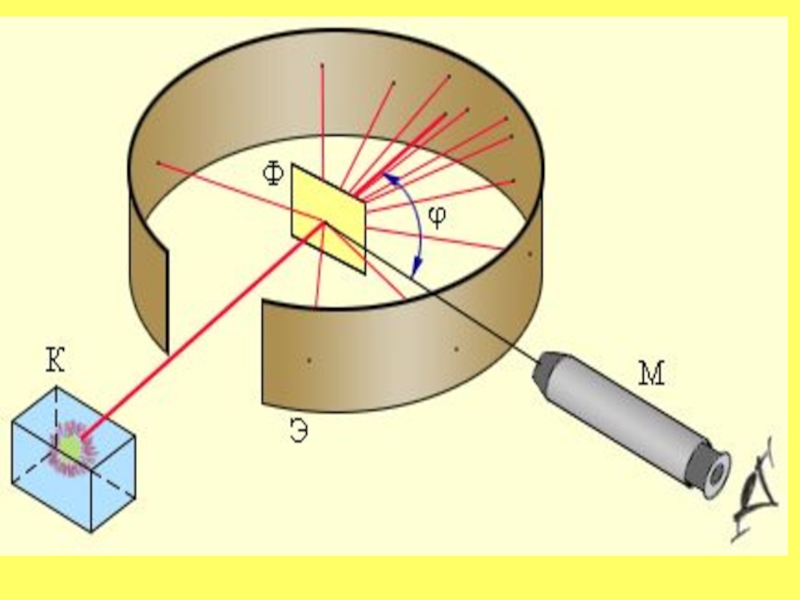
Резерфорд предложил применить зондирование атома с помощью α-частицСлайд 11Опыт Резерфорда
K – свинцовый контейнер с радиоактивным веществом,
Э – экран, покрытый сернистым цинком,
Ф – золотая фольга,
M – микроскоп.
Весь прибор в сосуде без воздуха.
Слайд 13Было обнаружено, что большинство α-частиц проходит через тонкий слой металла,
практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на
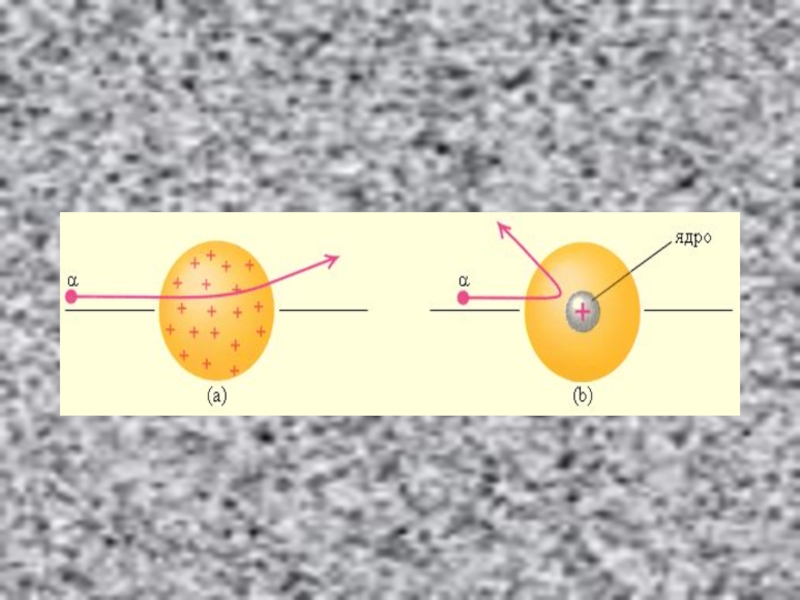
значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.Слайд 14Этот результат был совершенно неожиданным даже для Резерфорда. Он находился
в резком противоречии с моделью атома Томсона, согласно которой положительный
заряд распределен по всему объему атома. При таком распределении положительный заряд не может создать сильное электрическое поле, способное отбросить α-частицы назадСлайд 16
Резерфорд пришёл к выводу, что атом почти пустой, и весь
его положительный заряд сосредоточен в малом объеме. Эту часть атома
Резерфорд назвал атомным ядром. Так возникла ядерная модель атома.Слайд 17Планетарная модель атома
Согласно этой модели, в центре атома располагается положительно
заряженное ядро, в котором сосредоточена почти вся масса атома. Атом
в целом нейтрален. Вокруг ядра, подобно планетам, вращаются под действием кулоновских сил электроны . Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро.Слайд 18К 20-м годам XX века физики уже не сомневались в том,
что атомные ядра, открытые Э. Резерфордом в 1911 г., также как и
сами атомы, имеют сложную структуруСлайд 19В 1919 году Э. Резерфорд обнаружил ядра атома водорода в продуктах расщепления
ядер атомов многих элементов. Резерфорд назвал эту частицу протоном. Он
высказал предположение, что протоны входят в состав всех атомных ядер.Слайд 20Схема опытов Резерфорда по обнаружению протонов в продуктах расщепления ядер.
К – свинцовый контейнер с радиоактивным источником α-частиц, Ф –
металлическая фольга, Э – экран, покрытый сульфидом цинка, М – микроскоп.Слайд 21По современным измерениям, положительный заряд протона в точности равен элементарному
заряду
e = 1,60217733·10 -19 Кл,
то есть равен по модулю отрицательному заряду
электрона. Слайд 22Масса протона, по современным измерениям, равна
m р = 1,67262·10
-27 кг.
1 а. е. м. = 1,66057·10 -27 кг.
Следовательно, mр = 1,007276 · а. е. м.
Слайд 23После открытия протона было высказано предположение, что ядра атомов состоят
из одних протонов
Слайд 24В 1920 г. Резерфорд высказал гипотезу о существовании в составе ядер
жестко связанной компактной протон - электронной пары, представляющей собой электрически
нейтральное образование – частицу с массой, приблизительно равной массе протона. Он даже придумал название этой гипотетической частице – нейтронСлайд 25Это была очень красивая, но, как выяснилось впоследствии, ошибочная идея.
Электрон не может входить в состав ядра
Слайд 261932 г. Чедвик экспериментально исследовал излучение, возникающее при облучении бериллия α-частицами,
и обнаружил, что это излучение представляет собой поток нейтральных частиц
с массой, примерно равной массе протона.Так был открыт нейтрон.
Слайд 28Нейтрон – это элементарная частица
По современным измерениям, масса нейтрона
mn = 1,67493·10-27 кг = 1,008665 а. е. м.
В энергетических единицах масса нейтрона равна 939,56563 МэВ. Масса нейтрона
приблизительно на две электронные массы превосходит массу протона.Слайд 29Сразу же после открытия нейтрона российский ученый Д. Д. Иваненко и немецкий
физик В. Гейзенберг выдвинули гипотезу о протонно-нейтронном строении атомных ядер, которая
полностью подтвердилась последующими исследованиями. Протоны и нейтроны принято называть нуклонами.Слайд 30Число протонов, входящих в состав атомного ядра, обозначают символом Z
и называют зарядовым числом или атомным номером
Слайд 33Ядра одного и того же химического элемента могут отличаться числом
нейтронов. Такие ядра называются изотопами
Слайд 34У большинства химических элементов имеется несколько изотопов. Например, у водорода
три изотопа: 11Н – обычный водород, 12 Н – дейтерий
и 31Н – тритий.У углерода – 6 изотопов,
У кислорода – 3.
Слайд 35Для того, чтобы атомные ядра были устойчивыми, протоны и нейтроны
должны удерживаться внутри ядер огромными силами, во много раз превосходящими
силы кулоновского отталкивания протонов. Силы, удерживающие нуклоны в ядре, называются ядерными.Слайд 36Они представляют собой проявление самого интенсивного из всех известных в
физике видов взаимодействия – так называемого сильного взаимодействия. Ядерные силы
примерно в 100 раз превосходят электростатические силы и на десятки порядков превосходят силы гравитационного взаимодействия нуклонов. Важной особенностью ядерных сил является их короткодействующий характер.Слайд 37Энергия связи ядра Е св равна минимальной энергии, которую необходимо
затратить для полного расщепления ядра на отдельные частицы.
Слайд 38Масса любого ядра Mя всегда меньше суммы масс входящих в
его состав протонов и нейтронов: Mя
Слайд 40Энергия связи
Eсв = ΔM∙c2 = (Z∙mp + N∙mn – Mя)c2.
Эта энергия выделяется при образовании ядра в виде
излучения γ-квантов.
Слайд 41Образование всего 1 г гелия сопровождается выделением энергии порядка 1012 Дж. Примерно
такая же энергия выделяется при сгорании почти целого вагона каменного
угля.Слайд 44Уменьшение удельной энергии связи при переходе к тяжелым элементам объясняется
увеличением энергии кулоновского отталкивания протонов. В тяжелых ядрах связь между
нуклонами ослабевает, а сами ядра становятся менее прочнымиСлайд 45Самостоятельная работа
Определите состав ядра атома
31
Р
15
2. Определите состав ядра атома
16
О8