Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Теория горения горючих дисперсных материалов
Содержание
- 1. Теория горения горючих дисперсных материалов
- 2. Жидкости – это вещества в конденсированном состоянии,
- 3. Горение жидкостей представляет собой сложный физико-химический процесс,
- 4. Важнейшей характеристикой жидкости, от которой зависит процесс
- 5. Температурные пределы воспламенения применяют при расчете безопасных
- 6. Состояние вещества, при котором исчезает различие между
- 7. По способам хранения и транспортирования вещества можно
- 8. Горение твердых веществ. В условиях большинства пожаров
- 9. Горение органических материалов. Состав некоторых целлюлозных материаловСостав неконденсирующихся газов, образующихся при различной температуре разложения древесины
- 10. Полимеры отличаются высоким содержанием углерода, и большинство
- 11. При горении жидкости, массовую скорость выгорания твердых
- 12. Горючая пыль – это дисперсная система, состоящая
- 13. ГОСТ 12.1.044-84 ССБТ регламентирует следующие показатели пожаро-
- 14. Кондуктивный механизм распространения горения (теплопроводный), продукты горения
- 15. Слайд 15
- 16. Слайд 16
- 17. Слайд 17
- 18. Слайд 18
- 19. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Теория горения горючих дисперсных материалов
Лекция 7 по теории горения
и взрыва для гр. ДБЖ-09
Слайд 2Жидкости – это вещества в конденсированном состоянии, промежуточном между твердыми
и газообразными.
Жидкости, подобно твердым веществам, обладают малой сжимаемостью и
большой плотностью, не обладают упругостью и легко текут. В жидкостях расстояние между молекулами – порядка размеров самих молекул, а силы межмолекулярного взаимодействия весьма значительны.Горючими жидкостями называют жидкости, способные самовозгораться, а также возгораться от источника зажигания.
Их можно разделить на индивидуальные вещества и смеси.
К смесям относятся бензин, дизельное топливо, керосин, растительные масла различных марок. Бензин представляет собой смесь углеводородов различного строения, бесцветная жидкость с пределами кипения 30…205оС, плотностью 700…780 кг/м3; марки отечественных автомобильных бензинов.
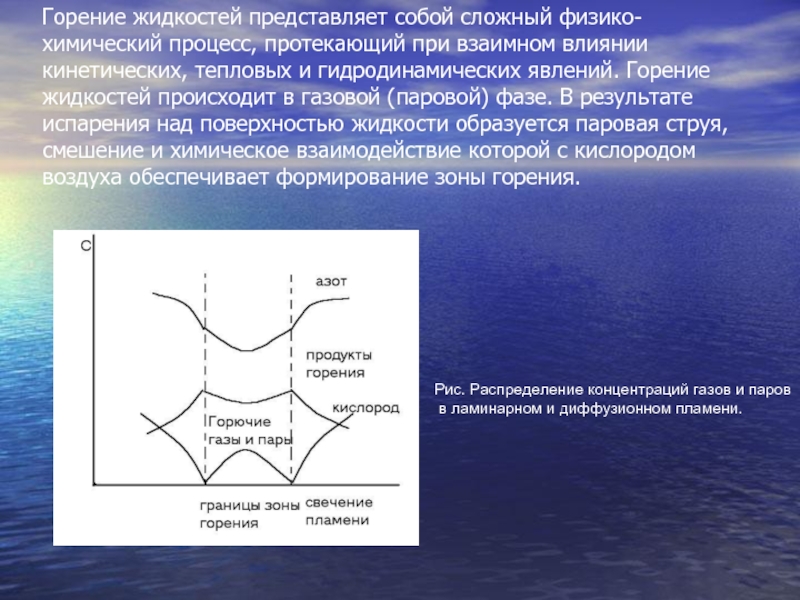
Слайд 3Горение жидкостей представляет собой сложный физико-химический процесс, протекающий при взаимном
влиянии кинетических, тепловых и гидродинамических явлений. Горение жидкостей происходит в
газовой (паровой) фазе. В результате испарения над поверхностью жидкости образуется паровая струя, смешение и химическое взаимодействие которой с кислородом воздуха обеспечивает формирование зоны горения.Рис. Распределение концентраций газов и паров
в ламинарном и диффузионном пламени.
Слайд 4Важнейшей характеристикой жидкости, от которой зависит процесс горения, является температура
кипения – температура, при которой происходит переход вещества из жидкого
состояния в парообразное не только на поверхности, как при испарении, но и по всему объему.Температура кипения индивидуальных углеводородов при атмосферном давлении может быть определена:
tкип=(10√10М – 375) – 150
где М – молекулярная масса вещества.
Слайд 5Температурные пределы воспламенения применяют при расчете безопасных температурных режимов работы
закрытых технологических аппаратов с жидкостями и летучими твердыми веществами. Безопасной
(в отношении возможности образования взрывоопасных паровоздушных смесей) следует считать температуру веществ tбез, оС при которой соблюдается следующие неравенства:tбез ≤ tн + Δtн
tв + Δtв ≤ tбез ≤0,8 tсв
где Δtн, Δtв – допустимые величины температур, зависящие от природы жидкости, tсв –температура самовоспламенения жидкости.
Слайд 6Состояние вещества, при котором исчезает различие между его жидкой и
газообразной фазами, называется критическим. Оно возникает при определенных значениях давления
и температуры, называемых критическими: критической называется температура, выше которой вещество не может находиться в жидком состоянии; критическим называется давление, при котором еще сохраняется возможность сжижения газообразной фазы.Объем, который занимает вещество в критическом состоянии, также называется критическим. Критические параметры вещества связаны следующим соотношением:
Zкр=Pкр· Vкр/RTкр
R– универсальная газовая постоянная; Zкр– константа, равная 0,375 (для газов, удовлетворяющих уравнению состояния Ван-дер-Ваальса; для паров углеводородов тяжелее пропана – 0,27).
Слайд 7По способам хранения и транспортирования вещества можно разделить на четыре
основные категории:
вещества, у которых критическая температура ниже температуры окружающей среды,
называются криогенными, для сжижения их необходимо охладить и сжать. Поведение разлитой криогенной жидкости подобно поведению воды, налитой на раскаленную поверхность: капли жидкости парят над поверхностью подобно пузырькам кипящей воды;вещества, у которых критическая температура выше, а точка кипения ниже температуры окружающей среды. Для сжижения их достаточно сжать, они отличаются способностью к "мгновенному испарению", то есть при разгерметизации емкости части жидкости испаряется, а оставшаяся охлаждается до точки кипения при атмосферном давлении;
вещества, у которых критическое давление выше атмосферного и точка кипения выше температуры окружающей среды, находятся при атмосферном давлении в жидком состоянии, в холодную погоду при атмосферном давлении бутан – жидкость, а этиленоксид в жаркую погоду – сжиженный газ;
вещества, содержащиеся при повышенных температурах. Жидкости 3-й категории, указанные выше, в рабочих условиях могут вести себя подобно сжиженным газам, если они содержатся при подводе тепла и под давлением при температурах выше их атмосферной точки кипения. Характерным примером может служить водяной пар в котлах.
Слайд 8Горение твердых веществ. В условиях большинства пожаров горят твердые вещества,
которые широко используются в различных отраслях и быту. К ним
относятся органические и неорганические вещества и материалы.Рис. Строение ламинарного пламени
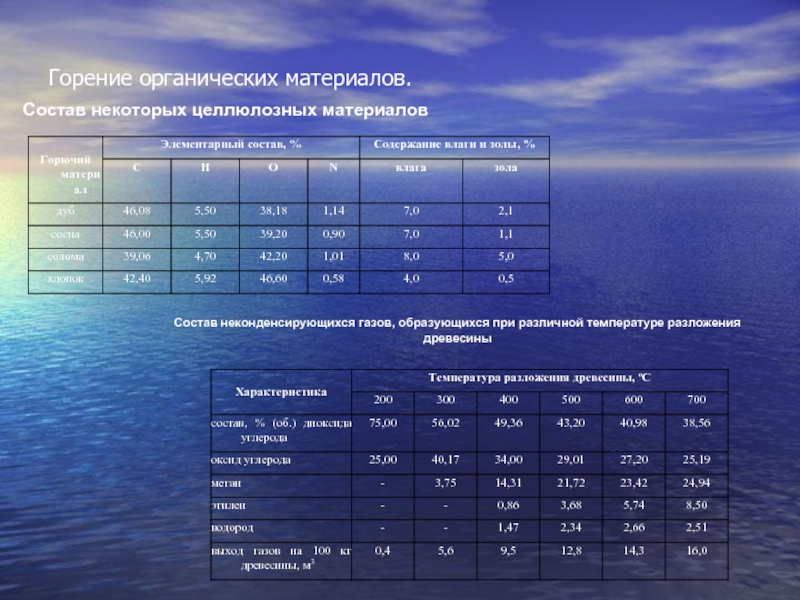
Слайд 9Горение органических материалов.
Состав некоторых целлюлозных материалов
Состав неконденсирующихся газов, образующихся
при различной температуре разложения древесины
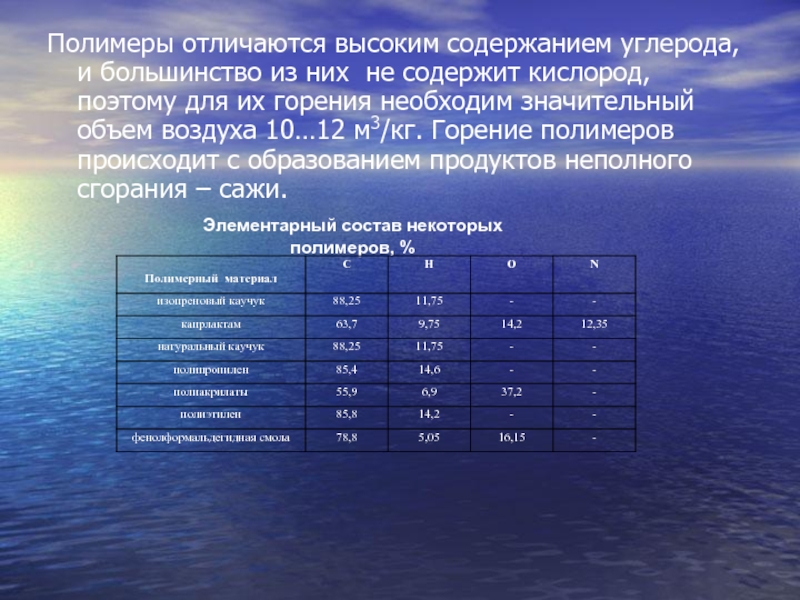
Слайд 10Полимеры отличаются высоким содержанием углерода, и большинство из них не
содержит кислород, поэтому для их горения необходим значительный объем воздуха
10…12 м3/кг. Горение полимеров происходит с образованием продуктов неполного сгорания – сажи.Элементарный состав некоторых полимеров, %
Слайд 11При горении жидкости, массовую скорость выгорания твердых веществ относят к
единице поверхности горения, то есть поверхности горючего вещества, с которой
в данный момент времени в зону горения поступают пары и газы. Такая массовая скорость выгорания твердых веществ называется удельной и не зависит от размеров поверхности твердых веществ и изменяется в зависимости от температуры и влажности веществ. Практическое определение удельной скорости выгорания твердых материалов очень затруднено, так как поверхность горения многих из них не представляет ровную плоскость. В связи с этим расчет скорости выгорания ведут на единицу площади проекции поверхности горения на горизонтальную плоскость.Удельная массовая скорость выгорания некоторых материалов
Перемещение фронта пламени по поверхности твердых веществ называется распространением горения и характеризуется скоростью распространения горения, определяемой по формуле: Uв = l/τ
,
где
Слайд 12Горючая пыль – это дисперсная система, состоящая из твердых частиц
размером менее 850 мкм, находящихся во взвешенном или осевшем состоянии
в газовой среде, способная к самостоятельному горению в воздухе нормального состава.Пыли по общей классификации коллоидно-дисперсных систем относятся к аэрозолям, в которых дисперсной средой является воздух, а дисперсной фазой – твердое вещество в раздробленном состоянии.
Пыль может образовываться при механическом измельчении твердых тел, а также при получении порошкообразных и пылеобразных веществ методами кристаллизации и сублимации. Осевшая пыль называется аэрогелем (пыль – гель), пыль, находящаяся во взвешенном состоянии, называется аэрозолем (пыль – аэровзвесь); аэрогели и аэровзвеси являются гетерогенными системами. Пыли горючих веществ являются пожаро- и взрывоопасными.
Слайд 13ГОСТ 12.1.044-84 ССБТ регламентирует следующие показатели пожаро- и взрывоопасности горючих
аэрозолей и аэрогелей:
для горючих пылей во взвешенном состоянии: нижний концентрационный
предел распространения пламени (НКПР), минимальная энергия зажигания, максимальное давление взрыва, скорость нарастания давления при разрыве, минимальное взрывоопасное содержание кислорода;для пылей, находящихся в осевшем состоянии: температура воспламенения, температура самовоспламенения, температура самонагревания, температура тления, температурные условия теплового самовозгорания, минимальная энергия зажигания, способность гореть и взрываться при взаимодействии с водой, кислородом воздуха и другими веществами.
Слайд 14Кондуктивный механизм распространения горения (теплопроводный), продукты горения нагревают воздух, и
воздух нагревает частицу до температуры воспламенения, так распространяется горение. В
аэровзвесях много воздуха и мало твердой фазы; твердая фаза – является источником тепла, воздух основной поглотитель этого тепла и является адиабатической характеристикой.Скорость распространения горения должна зависеть от размеров частиц в существенной мере; частицы, горящие в газовой фазе, горят по закону Средневского: время горения пропорционально квадрату диаметра частиц
t=k·d2