Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Внутренняя энергия 10 класс
Содержание
- 1. Внутренняя энергия 10 класс
- 2. Термодинамика – раздел физики, изучающий возможности использования внутренней энергии тел для совершения механической работы
- 3. В термодинамике имеют дело не с отдельны-ми
- 4. Внутренняя энергия идеального газа Внутренняя энергия тела (обозначается
- 5. Средняя кинетическая энергия одного атома k =
- 6. Внутренняя энергия данной массы идеально-го газа зависит
- 7. Общая формула внутренней энергии идеального газаi –
- 8. Изменение внутренней энергии Изменение внутренней энергии ∆U равно
- 9. Теплообмен – процесс передачи энергии от одного
- 10. Д.З. §55 Ответить на вопросы
- 11. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2 Термодинамика – раздел физики, изучающий возможности использования внутренней энергии тел
для совершения механической работы
Слайд 3 В термодинамике имеют дело не с отдельны-ми молекулами, а с
макроскопическими телами, состоящими из огромного числа частиц. Эти тела называются
термодинами-ческими системами В термодинамике тепловые явления описы-ваются макроскопическими величинами – давление, температура, объём.
Слайд 4Внутренняя энергия идеального газа
Внутренняя энергия тела (обозначается U) – сумма
кинетической энергии хаотического теплового движения частиц (атомов или молекул) тела
и потенциальной энергии их взаимодействия Т. к. для идеального газа потенциальная энергия частиц мала Ер → 0 то внутренняя энергия U = ΣEk = NEk
Слайд 5 Средняя кинетическая энергия одного атома
k = 1,38 ∙ 10-23Дж/К
– постоянная Больцмана
T – температура по Кельвину
i – число
степеней свободы – число возможных независимых направлений движения молекулы i = 3 для одноатомного газа
i = 5 для двухатомного газа
i = 6 для трёхатомного (многоатомного) газа
Слайд 6 Внутренняя энергия данной массы идеально-го газа зависит лишь от одного
макроскопи-ческого параметра –термодинамической температуры
М = ma∙NA– молярная масса газа
R
= kNA – молярная газовая постоянная NA = 6,022 ∙ 10-23 моль-1 – постоянная Авогадро
m = ma∙N – масса газа
Слайд 7Общая формула внутренней энергии идеального газа
i – число степеней свободы
Т
– температура газа (K)
p – давление идеального газа
М = ma∙NA–
молярная масса газаR = kNA – молярная газовая постоянная
NA = 6,022 ∙ 10-23 моль-1 – постоянная Авогадро
Внутренняя энергия идеального газа
m – масса газа
V – объём газа
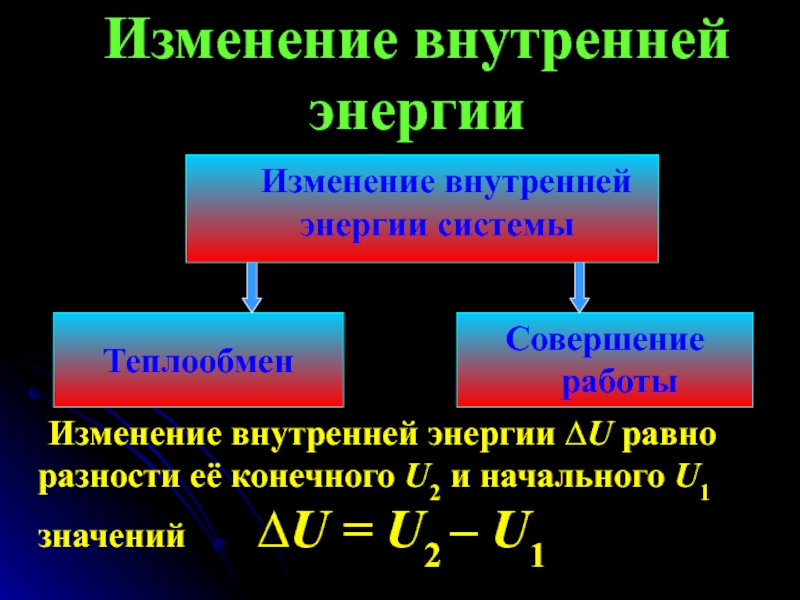
Слайд 8Изменение внутренней энергии
Изменение внутренней энергии ∆U равно разности её конечного
U2 и начального U1 значений ∆U =
U2 – U1Теплообмен
Совершение работы
Изменение внутренней энергии системы
Слайд 9 Теплообмен – процесс передачи энергии от одного тела к другому
без совершения работы
Количество теплоты, получаемое телом, - энергия, передаваемая телу
извне в результате теплообмена (взаимодействия с другим телом без совершения работы) Процесс теплообмена может происходить только при контакте двух тел
За счет изменения внутренней энергии при теплообмене не может совершаться работа