момент.
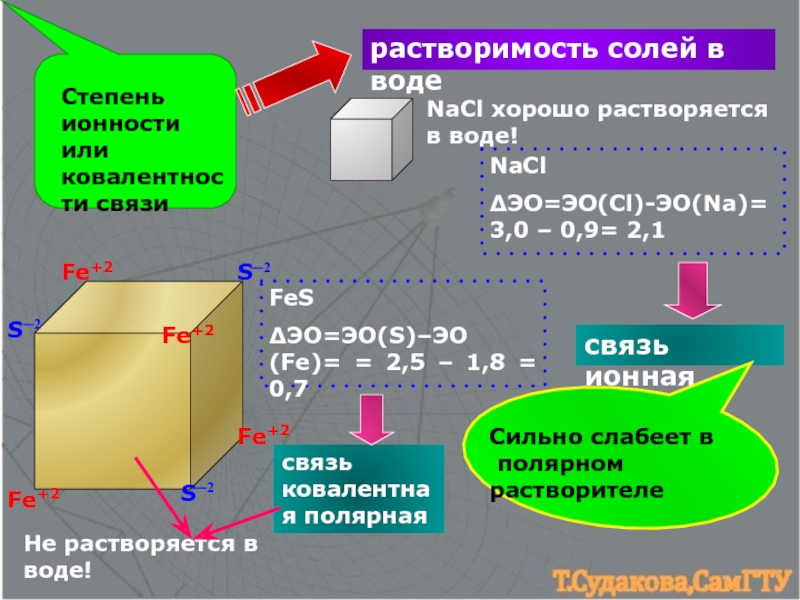
3. Ионная связь. Оценка степени ионности связи.
4. Донорно-акцепторный механизм
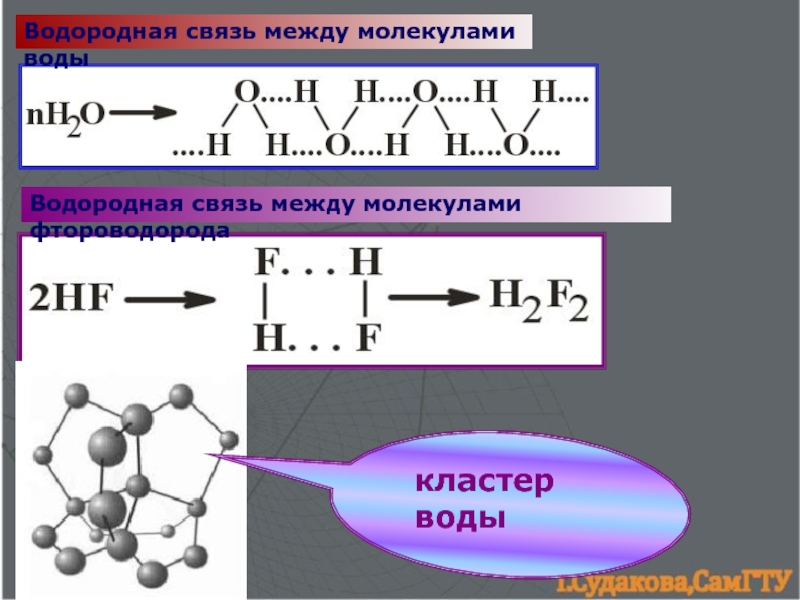
образования ковалентной связи.5. Водородная связь. 6. Силы межмолекулярного взаимодействия.
По выражению г-на Брайка Кроуфорда мл. « Вопрос о природе химической связи – сердце всей химии (1953)


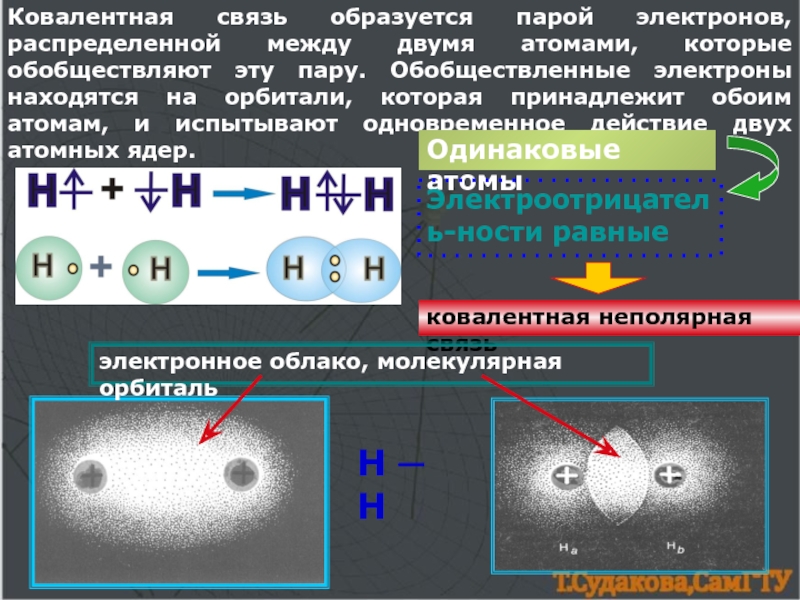

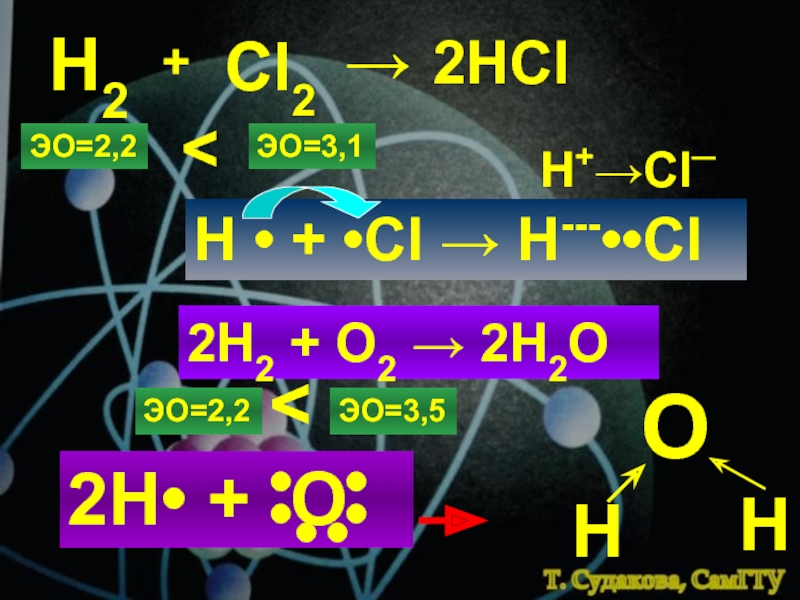

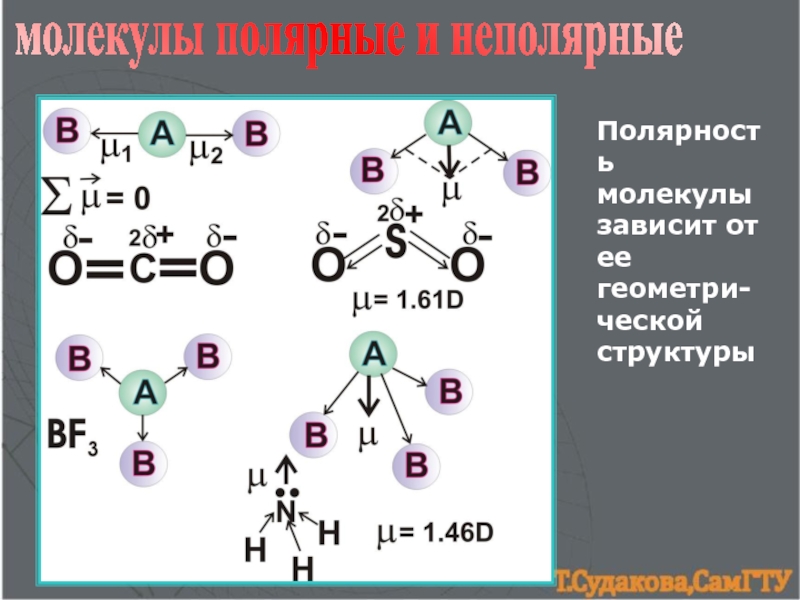




![Химическая связь комплексные ионыКатионы [NH4]+, [Zn(NH3)4]2+Анионы[Al(OH)4]─, [CuCl4]2─структура комплексного иона[Zn+2(NH3)04]2+[Cu+2Cl─4]2─ион-комплексообразовательлигандыкоординаци-онное числоКомплексные соединения:[NH4]OH, [Zn(NH3)4]SO4, Na[Al(OH)4], Na[CuCl4]Сульфат тетраамминцинка, тетрахлорокупрат натрия комплексные ионыКатионы [NH4]+, [Zn(NH3)4]2+Анионы[Al(OH)4]─, [CuCl4]2─структура комплексного иона[Zn+2(NH3)04]2+[Cu+2Cl─4]2─ион-комплексообразовательлигандыкоординаци-онное числоКомплексные соединения:[NH4]OH, [Zn(NH3)4]SO4, Na[Al(OH)4], Na[CuCl4]Сульфат тетраамминцинка, тетрахлорокупрат](/img/thumbs/782c7063eb93412fbf284763def23b20-800x.jpg)



![Химическая связь Силы межмолекулярного взаимодействияСилы Ван-дер-Ваальса: электростатическая природа, слабые, Ион-дипольное взаимодействиегидраты ионов в Силы межмолекулярного взаимодействияСилы Ван-дер-Ваальса: электростатическая природа, слабые, Ион-дипольное взаимодействиегидраты ионов в водных растворах, например, [Na(H2O)x]+, [F(H2O)y]− в](/img/thumbs/cd74207419a825b7be44e3b9629d313f-800x.jpg)