Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Окислительно - восстановительные реакции 9 класс
Содержание
- 1. Окислительно - восстановительные реакции 9 класс
- 2. Чем отличаются реакции?
- 3. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (ОВР)
- 4. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (ОВР) – реакции, протекающие с
- 5. Окисление – процесс отдачи электронов атомом, молекулой
- 6. Расстановка коэффициентов с использованием метода электронного баланса.1.
- 7. Расставить коэффициентов, используя метод электронного баланса:1) Al
- 8. Используя метод электронного баланса, преобразуйте схемы в
- 9. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Расставьте степень окисления элементов в соединениях.
K2SO4 + BaCl2 →
BaSO4 + KCl
отличаются реакции?Слайд 4ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ
РЕАКЦИИ (ОВР) – реакции, протекающие с изменением степени окисления.
ОВР
– реакции, в результате которых происходят два взаимопротивоположных процесса: отдачи
электронов (окисления) и их принятия (восстановления).Окислитель – вещество, содержащее атомы или ионы, принимающие электроны.
Восстановитель – вещество, содержащее атомы или ионы, отдающие электроны.
Слайд 5Окисление – процесс отдачи электронов атомом, молекулой или ионом, степень
окисления элемента повышается.
Восстановление – процесс приема электронов атомом, молекулой или
ионом, степень окисления элемента понижается.Часто используются условные обозначения:
ок-ль – окислитель,
восст-ль – восстановитель,
ок-е – окисление,
восст-е – восстановление.
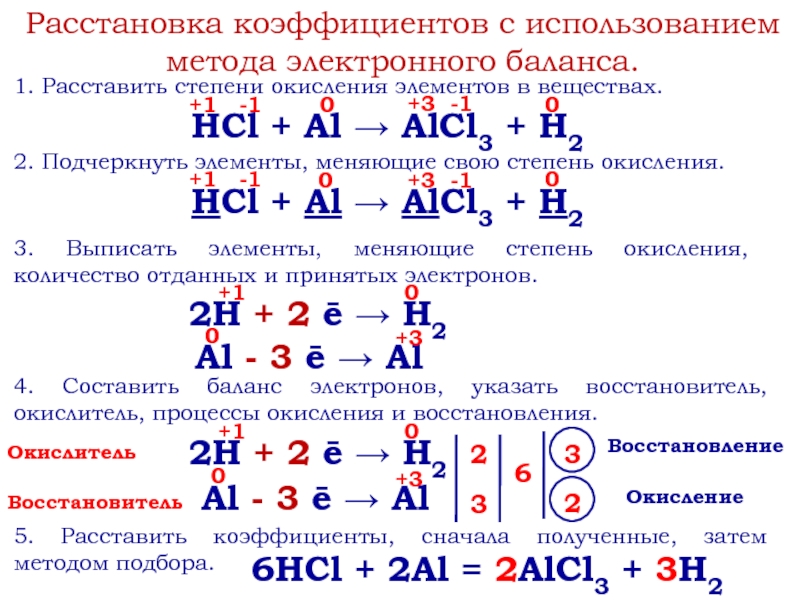
Слайд 6Расстановка коэффициентов с использованием метода электронного баланса.
1. Расставить степени окисления
элементов в веществах.
2. Подчеркнуть элементы, меняющие свою степень окисления.
3. Выписать
элементы, меняющие степень окисления, количество отданных и принятых электронов.Окислитель
Восстановитель
Окисление
Восстановление
4. Составить баланс электронов, указать восстановитель, окислитель, процессы окисления и восстановления.
2
3
6
3
2
5. Расставить коэффициенты, сначала полученные, затем методом подбора.
6HCl + 2Al = 2AlCl3 + 3H2
Слайд 7Расставить коэффициентов, используя метод электронного баланса:
1) Al +
CuO Cu + Al2O3
2) NH3
+ O2 NO + H2O3) MnO2 + HCl MnCl2 + Cl2 + H2O
4) HNO3 + Cu Cu(NO3)2 + NO + H2O
Слайд 8Используя метод электронного баланса,
преобразуйте схемы в уравнения реакций:
а) V2O5
+ Al Al2O3 +
Vб) NH3 + O2 N2 + H2O
в) HNO3 + Cu Cu(NO3)2 + NO2 + H2O
Домашнее задание: