Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация к уроку химии
Содержание
- 1. Презентация к уроку химии
- 2. Урок по химии в 8 классе на
- 3. Слайд 3
- 4. Цели урока: 1.Сформулировать понятие о кислотах2.Рассмотреть
- 5. Задачи:Обучающая: Развивающая: Формирование у
- 6. Воспитывающая:Продолжить формирование познавательного интереса к предмету «Химия»,
- 7. Оборудование к уроку.Тестовые задания, мини-лаборатория на каждый стол с необходимым количеством реактивов, мультимедийный проектор, компьютерный класс.
- 8. Структура урока
- 9. Проверка и повторение опорных знаний Преподаватель Какие
- 10. Выводы по первому этапу Целевая направленность задания
- 11. Проверка домашнего задания: Задание:Проанализировать блок информации «Развитие
- 12. Вывод по второму этапу Домашняя работа с
- 13. Задание: Напишите уравнения реакций получения хлорида меди
- 14. Вывод по третьему этапу Ребята дают объяснения, подкрепляют свои доводы аргументами.
- 15. ЭкспериментCaCl2 + HCl= CaCO3 + 2H+
- 16. В
- 17. Применение соляной кислоты и ее
- 18. Вывод по четвертому этапу У учеников формируется
- 19. Постановка заданий, стимулирующих творческую деятельность учениковРаспознавание соляной
- 20. Вывод по пятому этапуАлгоритмические предписания стимулируют учебно
- 21. Работа выполнена
- 22. Подведение итогов 1.Внимательно проанализируйте содержание урока и
- 23. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Урок по химии в 8 классе на тему «Соляная кислота,
её соли»
Преподавание химии в 8 классе, где был проведен данный
урок, ведется по программеНовошинской Н.С., Новошинского И.И. (2 часа в неделю).
Слайд 4Цели урока:
1.Сформулировать понятие о кислотах
2.Рассмотреть состав, название и классификацию
кислот
3.Познакомить учащихся с важнейшими неорганическими кислотами, с различными приёмами, способами
и методами достижения цели. 4.Способствовать умению учеников применять свои знания в более сложной ситуации.
1.Сформулировать понятие о кислотах
2.Рассмотреть состав, название и классификацию кислот
3.Познакомить учащихся с важнейшими неорганическими кислотами, с различными приёмами, способами и методами достижения цели.
4.Способствовать умению учеников применять свои знания в более сложной ситуации.
Слайд 5Задачи:
Обучающая:
Развивающая:
Формирование у учащихся знаний
основ химической науки – важнейших фактов, понятий, химических законов, химического
языка, специальных умений обращаться с веществами, выполнять несложные опыты, соблюдая правила техники безопасности.Развивать умения наблюдать и объяснять химические явления, происходящие в природе, в лаборатории, в повседневной жизни.
Слайд 6Воспитывающая:
Продолжить формирование познавательного интереса к предмету «Химия», пользоваться теоретическими и
экспериментальными методами химической науки для решения задач. Продолжить формирование творческих
задатков каждого ребенка, а так же воспитание элементов экологической культуры.Слайд 7Оборудование к уроку.
Тестовые задания, мини-лаборатория на каждый стол с необходимым
количеством реактивов, мультимедийный проектор, компьютерный класс.
Слайд 9Проверка и повторение опорных знаний
Преподаватель
Какие вещества называются кислотами?
Приведите примеры.
2. Выделите в определении кислот ключевые слова.
3. Закодируйте ответ
на вопрос: с какими веществами реагирует соляная кислота?Cu H3PO4 Fe(OH)3 NaH
MgO NaOH P2O5 CaS
SO3 Zn Ag NaN3
Обоснуйте свой выбор.
4. Запишите уравнения реакций соляной кислоты с выбранными веществами.
5. Сделайте вывод о химических свойствах соляной кислоты.
Ученики
Делятся по два человека и начинают отвечать на вопросы.
Ключевые слова : «Водород в кислоте способен замещаться на металл». Далее выстраивают логическую цепочку: все вещества, содержащие металл, должны реагировать с кислотами.
Код ответа:
0 0 1 1
1 1 0 1
0 1 0 1
Пишут уравнения в молекулярном виде:
MgO + 2HCl = MgCl2 + H2O
NaOH + HCl = NaCl + H2O
Zn + 2HCl = ZnCl2 + H2
Fe(OH)3 + 3HCl + 3H2O
NaH + HCl = NaCl + H2
CaS + 2HCl = FeCl3 + 3H2O
Na3N + 3HCl = 3NaCl + NH3
Слайд 10Выводы по первому этапу
Целевая направленность задания стимулирует познавательную активность.
Учитель выводит учащихся на уровень осознанного оперирования понятием «кислота».
Слайд 11Проверка домашнего задания:
Задание:
Проанализировать блок информации «Развитие взглядов на понятие
«кислота»».
Ответ:
Есть кислоты, не содержащие кислорода (HCl, H2S). Есть вещества (оксиды,
соли, основания), содержащие кислород, но не обладающие свойствами кислот.Либих был прав. В серной кислоте оба атома водорода, а в фосфорной кислоте только два атома водорода (из трех) обусловливают кислотные свойства.
O O-H
\\ /
H2SO4 S
// \
O O-H
O-H
/
H3PO3 O=P-O-H
\
H
Слайд 12Вывод по второму этапу
Домашняя работа с блоком новой информации
позволяет учащимся глубже понять содержание, подобрать примеры для анализа информации
о понятии «кислота». У школьников развивается аналитическое мышление.
Слайд 13Задание:
Напишите уравнения реакций получения хлорида меди (II) с использованием:
а) соляной кислоты; б) хлорида цинка.
Ответ:
а) CuO + 2HCl =
CuCl2 + H2OCu(OH)2 + 2HCl = CuCl2 + 2H2O
CuS + 2HCl = CuCl2 + H2S
2Cu + O2 + 4HHCl = 2CuCl2 + 2H2O
б) Zn +2H+ = Zn2+ + H2
Zn(OH)2 + 2H+= Zn2++ 2H2O
ZnO + 2H+ = Zn2+ + H2O
Применение знаний в простой ситуации
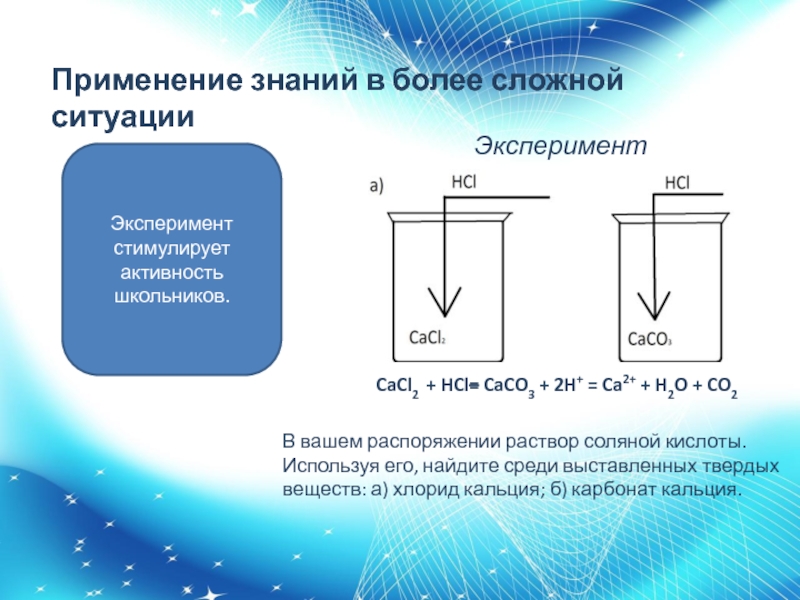
Слайд 15 Эксперимент
CaCl2 + HCl= CaCO3 + 2H+ = Ca2+ +
H2O + CO2
Эксперимент стимулирует активность школьников.
В вашем распоряжении раствор соляной
кислоты. Используя его, найдите среди выставленных твердых веществ: а) хлорид кальция; б) карбонат кальция.Применение знаний в более сложной ситуации
Слайд 16
В промышленно развитых странах
со времен второй мировой войны сохраняются большие запасы боевых отравляющих
веществ (БОВ), в том числе:а) иприт C4H8Cl2S
CH2-CH2Cl
/
S
\
CH2-CH2-Cl
В качестве одного из методов уничтожения этих БОВ предлагают сжигать их в избытке кислорода.
Какие устойчивые продукты образуются при полном сгорании каждого из перечисленных веществ и какие химико-технологические и экологические проблемы при этом возникают?
Предложите методы переработки продуктов сгорания БОВ в безопасные вещества.
Иприт при сжигании кроме SO2 и CO2 образует H2O, SO3, HCl, Cl2.
Зарин при сжигании кроме CO2 и H2O образует HF, P2O5.
Проблемы: кислотные дожди.
SO3 поглотить раствором H2SO4 . P2O5, HF, HCl поглотить водой.
Модно использовать сульфид аммония или сульфит магния:
(NH4)2SO3 + Cl2 + H2O = (NH4)2SO4 +2HCl
(NH4)2SO3 + 2HCl = 2NH4Cl + H2O + SO2
(NH4)2SO3 + SO2 + H2O = 2NH4HSO3
б) зарин C4H10O2PF
O
||
CH3-P-O-CH(CH3)2
|
F
Постановка задания:
Ответы:
Учащиеся читают информацию на ПК, пересказывают ее, используя таблицу «Применение соляной кислоты».
Дополнительное задание:
Слайд 17
Применение соляной кислоты и ее солей- хлоридов. Распознавание
соляной кислоты и хлоридов.
а) Применение соляной кислоты.
б) Хлориды – соли
соляной кислоты.( Учитель демонстрирует образцы хлоридов).в) Написать формулы хлоридов элементов 3-го периода. Какие из этих хлоридов являются солями, а какие не являются.
г) Применение хлоридов.
а)Один из учеников знакомит класс с исторической справкой.
в)Учащиеся записывают формулы хлоридов, делают вывод о составе солей.
NaCl, MgCl2, AlCl3, SiCl4, PCl5, SCl4.
г)Школьники читают информацию в ПК, пересказывают текст, используя рисунок из ПК.
Задание:
Работа учеников:
Слайд 18Вывод по четвертому этапу
У учеников формируется умение пересказывать текст.
В процессе общения учитель- ученик идет усвоение новых знаний.
Учащиеся
работают на уровне операции сравнения.Формируется навык к работе с ПК и дополнительной литературой.
Слайд 19Постановка заданий, стимулирующих творческую деятельность учеников
Распознавание соляной кислоты и хлоридов
Х.
Возьмите пробу вещества и прилейте метиловый оранжевый. Какое вещество обнаружили?
Возьмите новую пробу вещества Х и прилейте нитрат серебра. Напишите уравнение реакции и назовите вещество Х.Сделайте вывод: как отличить соляную кислоту от азотной кислоты?
Можно ли с помощью нитрата серебра отличить хлорид натрия от нитрата натрия? Проведите демонстрационный эксперимент.
Ag+ + Cl- = AgCl
Ответ: ион Cl- реагирует с ионом Ag+, давая осадок белого цвета. Один из учеников
проводит
демонстрационный эксперимент
Слайд 20Вывод по пятому этапу
Алгоритмические предписания стимулируют учебно – поисковую деятельность.
Учащиеся
строят
логичный ответ.
Поисковая экспериментальная работа ученика стимулирует его познавательную активность.
Конкретность
задания стимулирует речевую активность школьникаСлайд 22Подведение итогов
1.Внимательно проанализируйте содержание урока и подготовьте ответ на
вопрос: какое смысловое значение имеет понятие «соляная кислота»?
2. Оцените свое
участие на уроке в связке Я-МЫ-ДЕЛО.Учитель ставит оценки за труд, благодарит за урок.
Возможные ответы:
а) кислая на вкус;
б) диссоциирует в водных растворах на катион H+ и анион кислотного остатка Cl- ;
в) реагирует с веществами, содержащими металл;
г) содержится в желудочном соке;
д) проявляет свойства, общие для всех кислот.