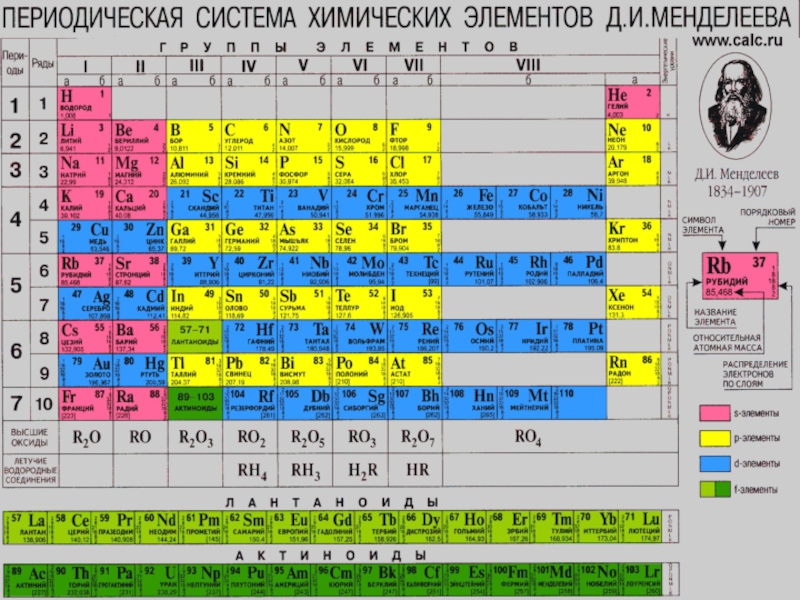
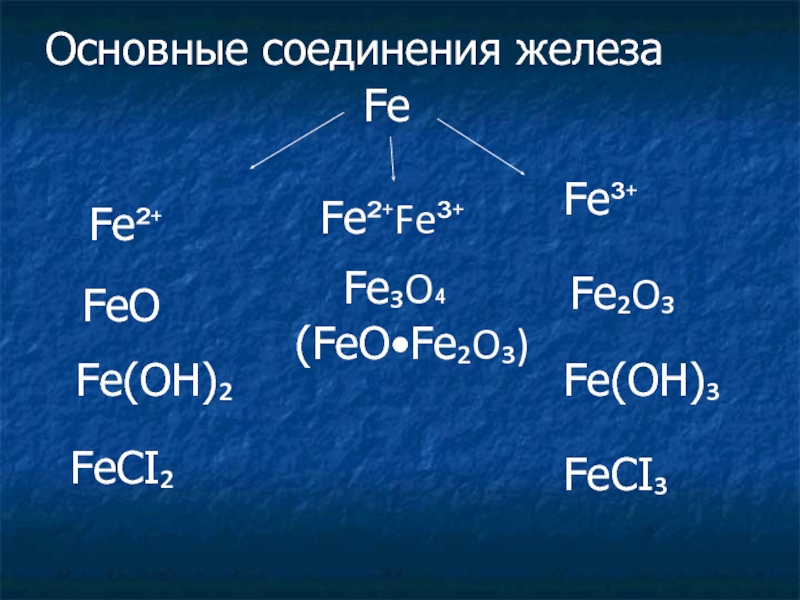
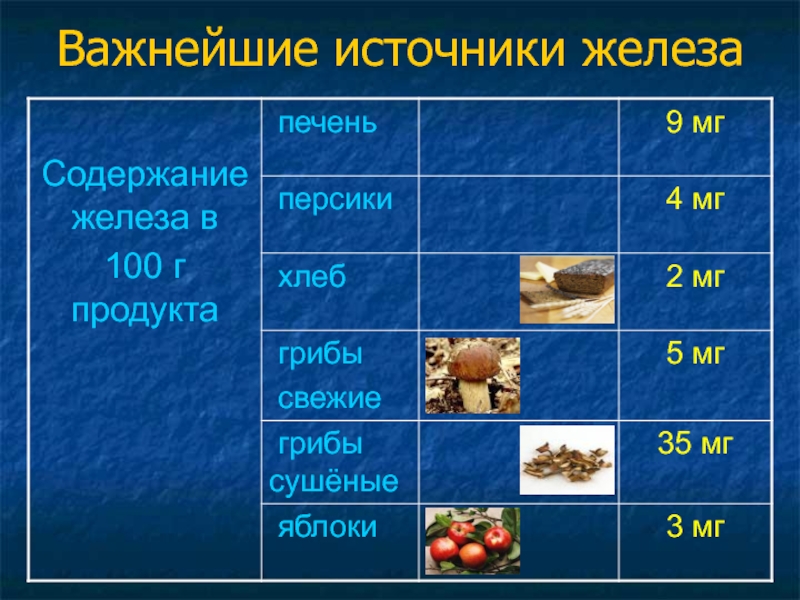
3 группе, в главной подгруппе
2. Алюминий – очень легкий серебристо
– белый металл, хорошо проводит Эл. ток и теплоту3. Алюминий – сложное вещество.
4. AI2O3 - проявляет амфотерные свойства
5. Алюминий встречается в природе только в свободном виде
6. Здоровому взрослому человеку необходимо примерно 30-50 мкг алюминия
7. Из сплавов алюминия изготовливают различных деталей космической аппаратуры.