Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация по химии 9 класс "Кислород" Габриелян
Содержание
- 1. Презентация по химии 9 класс "Кислород" Габриелян
- 2. Положение кислорода в п.с. Электронное строение.2 период,
- 3. Распространение кислорода в природе.Кислород – самый распространенный элемент на нашей планете.
- 4. На долю кислорода приходится приблизительно половина всей
- 5. Физические свойства кислорода.Газ без цвета, запаха и
- 6. Химические свойства кислорода.Сильный окислитель, взаимодействует, практически, со
- 7. Получение кислорода в лаборатории.Чаще всего кислород получают
- 8. Слайд 8
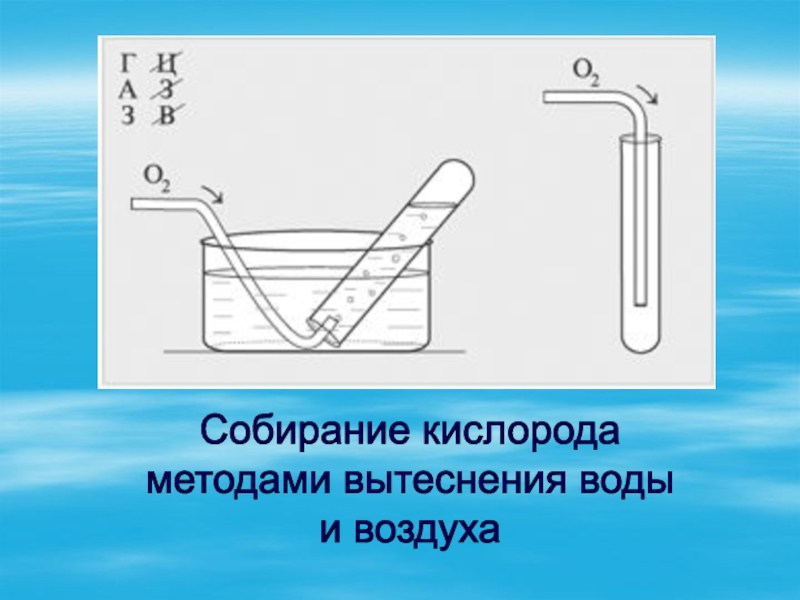
- 9. Собирание кислородаметодами вытеснения водыи воздуха
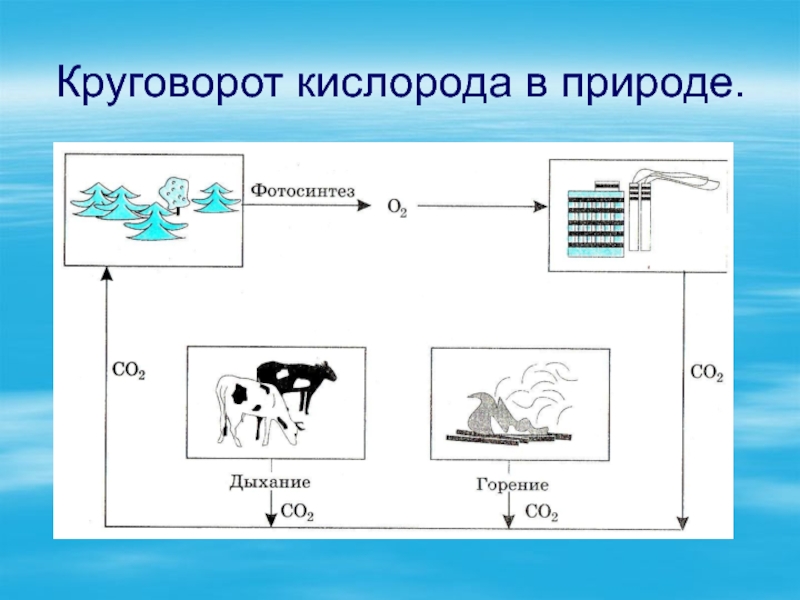
- 10. Круговорот кислорода в природе.
- 11. Фотосинтез
- 12. Открытие кислорода. Кислород был получен им многими способами:
- 13. Страница рукописиШееле
- 14. Джозеф Пристли (Joseph Priestley, 1733-1804)
- 15. Антуан Лавуазье (Lavoisier, Antoine Laurent,
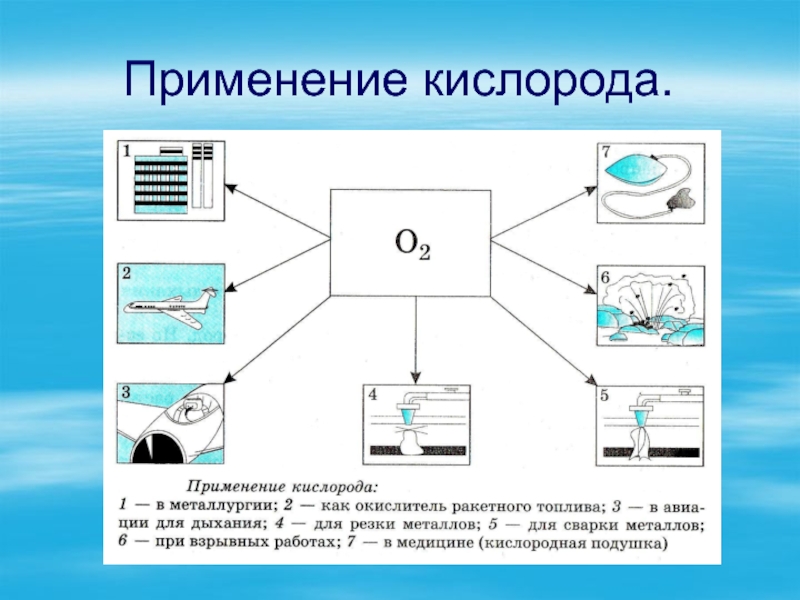
- 16. Применение кислорода.
- 17. Спасибо за внимание!
- 18. Скачать презентанцию
Положение кислорода в п.с. Электронное строение.2 период, 2 ряд, 6-А группаРодоначальник главной подгруппы 6 группы. «Халькогены» - рождающие руды (O,S,Se,Te,Po)
Слайды и текст этой презентации
Слайд 2Положение кислорода в п.с.
Электронное строение.
2 период, 2 ряд, 6-А группа
Родоначальник
главной подгруппы 6 группы.
Слайд 3Распространение кислорода в природе.
Кислород – самый распространенный элемент на нашей
планете.
Слайд 4На долю кислорода приходится приблизительно половина всей массы земной коры. В
почвах ,грунтовых , речных и морских водах кислород выступает настоящим
геохимическим диктатором.Слайд 5Физические свойства кислорода.
Газ без цвета, запаха и вкуса;
В жидком
состоянии имеет светло-голубую окраску, в твердом – синюю;
В воде газообразный
кислород растворим лучше, чем азот и водород.Слайд 6Химические свойства кислорода.
Сильный окислитель, взаимодействует, практически, со всеми элементами, образуя
оксиды. Степень окисления −2. Как правило, реакция окисления протекает с
выделением тепла и ускоряется при повышении температуры. Пример реакций, протекающих при комнатной температуре:4K + O2 → 2K2O
2Sr + O2 → 2SrO
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
2NO + O2 → 2NO2
Окисляет большинство органических соединений:
CH3CH2OH + 3O2 → 2CO2 + 3H2O
Кислород не окисляет Au и Pt, галогены и инертные газы.
С остальными неметаллами взаимодействует, образуя оксиды:
S+O2 →SO2
C+O2 →CO2
Активно взаимодействует со щелочными и щелочно-земельными металлами с образованием оксидов и пероксидов:
2Na+O2→Na2O2
С остальными металлами реагирует при нагревании, выделяя большое количество теплоты и света:
2Mg+O2 →2MgO