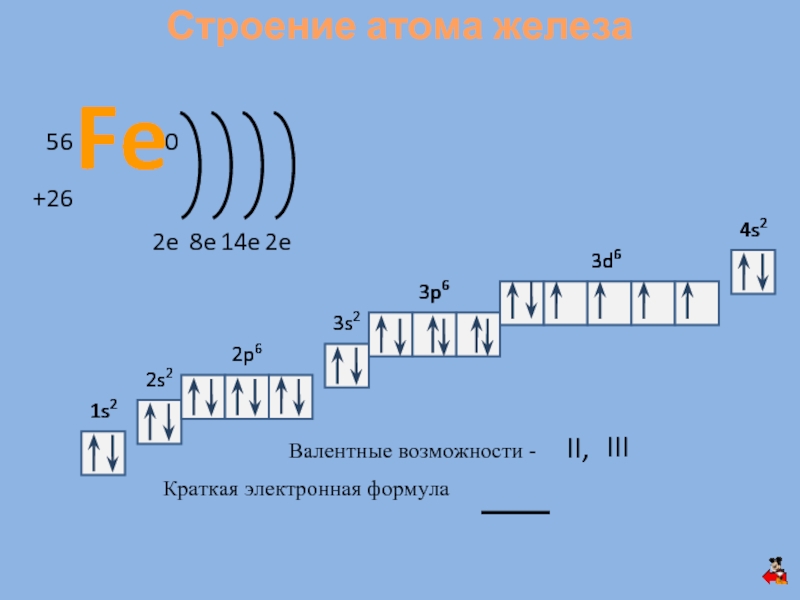
плавления – 1535 0С
Температура кипения около 2800 0С
При температуре ниже
770 0С железо обладает ферромагнитными свойствами (оно легко намагничивается, и из него можно изготовить магнит).Выше этой температуры ферромагнитные свойства железа исчезают, железо «размагничивается».
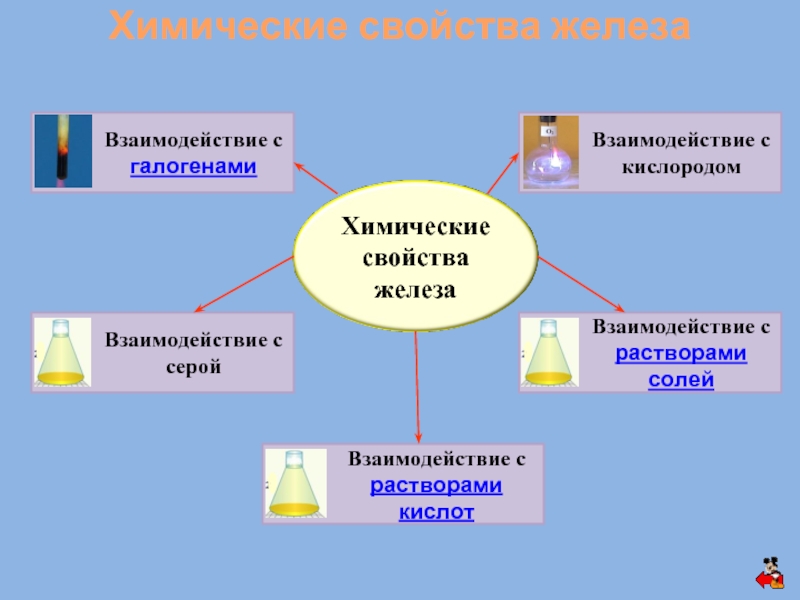
Железо – простое вещество