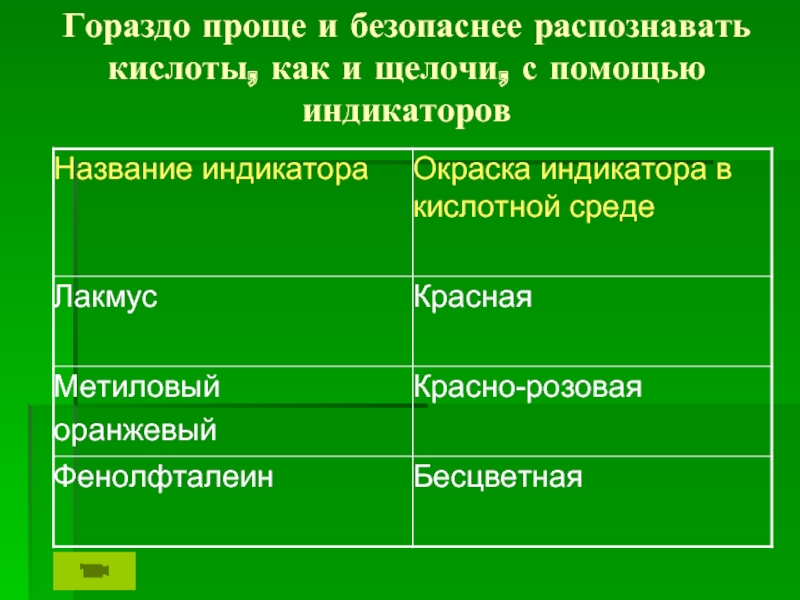
кислот.
Продолжить знакомство со сложными ионами на примере кислотных остатков кислородных
кислот.Продолжить формирование знаний о различиях между зарядами ионов и с.о. элементов, об индикаторах.