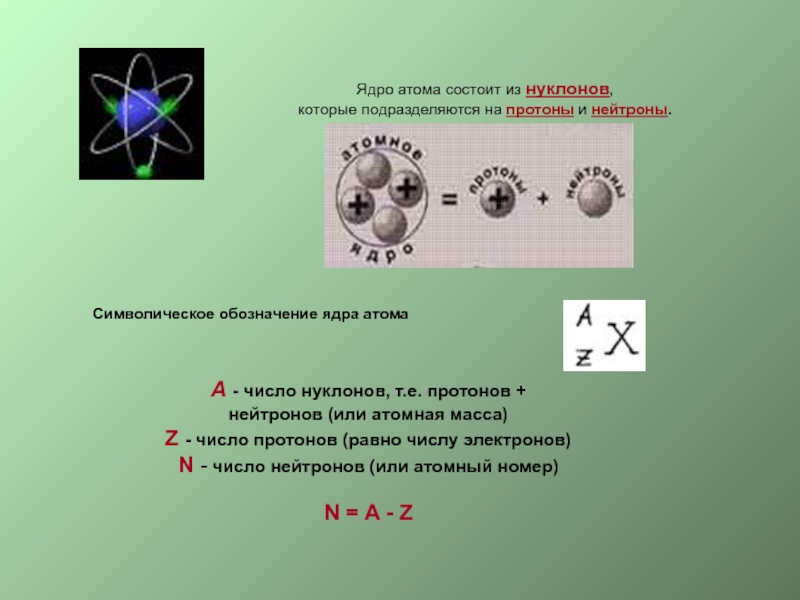
должны удерживаться внутри ядер огромными силами, во много раз превосходящими
силы кулоновского отталкивания протонов. Силы, удерживающие нуклоны в ядре, называются ядерными ( рис.8)
Особенности ядерных сил:
Ядерные силы примерно в 100 раз превосходят электростатические силы и на десятки порядков превосходят силы гравитационного взаимодействия нуклонов.
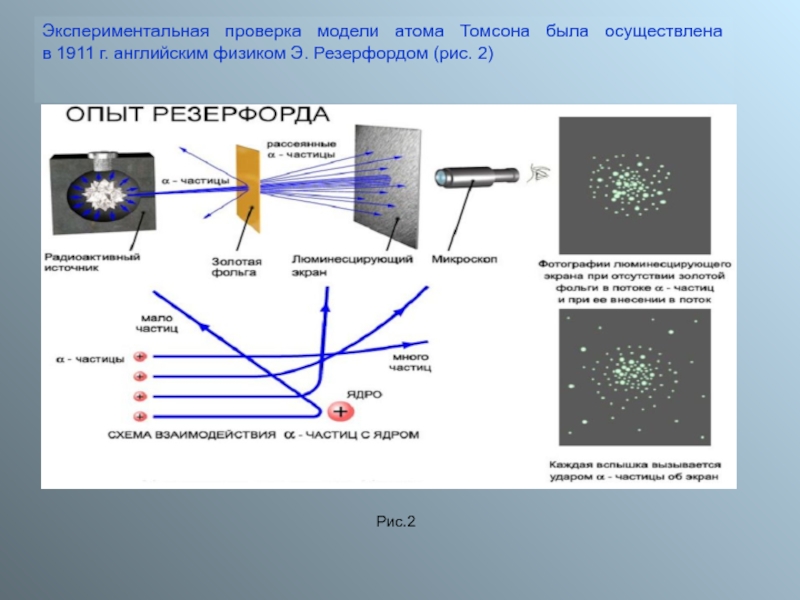
2. Важной особенностью ядерных сил является их короткодействующий характер. Ядерные силы заметно проявляются, как показали опыты Резерфорда по рассеянию
a-частиц, лишь на расстояниях порядка размеров ядра (10–14–10–15 м). Ядерные силы очень быстро спадают с расстоянием. Радиус их действия порядка 0,000 000 000 000 001 метра.
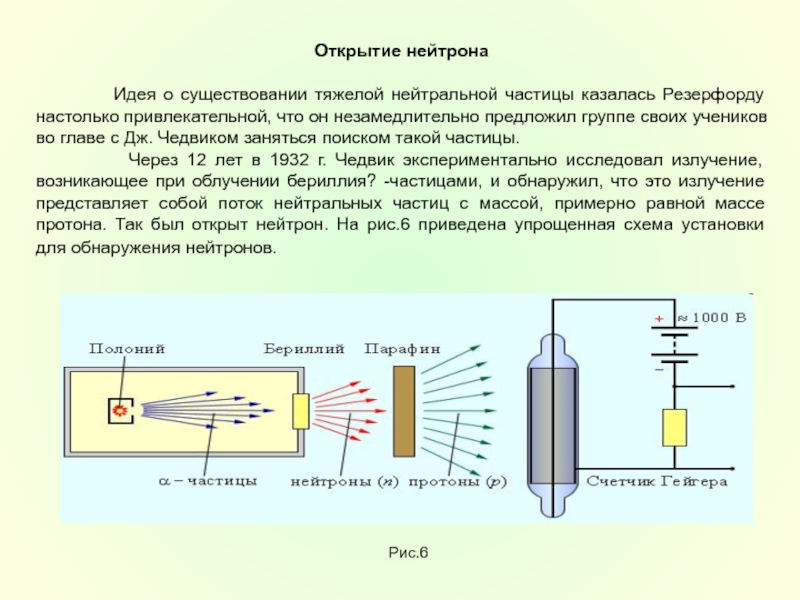
Для этой сверхмалой длины, характеризующей размеры атомных ядер, ввели специальное обозначение Фм (в честь итальянского физика Э. Ферми, 1901-1954)
Все ядра имеют размеры нескольких Ферми.
Радиус ядерных сил равен размеру нуклона, поэтому ядра – концентрация и очень плотной материи. Возможно, самой плотной в земных условиях.
Ядерные силы - сильные взаимодействия.
На больших расстояниях проявляется действие сравнительно медленно убывающих кулоновских сил.
На основании опытных данных можно заключить, что протоны и нейтроны в ядре ведут себя одинаково в отношении сильного взаимодействия, т. е. ядерные силы не зависят от наличия или отсутствия у частиц электрического заряда.
ЯДЕРНЫЕ СИЛЫ
силы притяжения;
действуют между всеми нуклонами в ядре;
короткодействующие.
.
Рис.8