Слайд 2Содержание
1/Локализации ферментов в клетке, органоспецифические и маркерные ферменты
2.Качественное обнаружение и количественное определение активности. Единицы активности (МE, катал),
удельная активность, число оборотов ферментов.
3. Сопряженные ферментные системе и их применение.
4. Номенклатура, классификациия ферментов (тривиальная, рациональная, систематическая).
Принципы классификации ферментов
Слайд 3Локализация ферментов в клетке
Все ферменты и метаболические процессы компартментализованы
(разделены и изолированы).
В нормальной клетке находится более 1000 ферментов.
Упорядоченное взаимодействие
ферментов достигается путем многоуровневой регуляции и компартментализации.
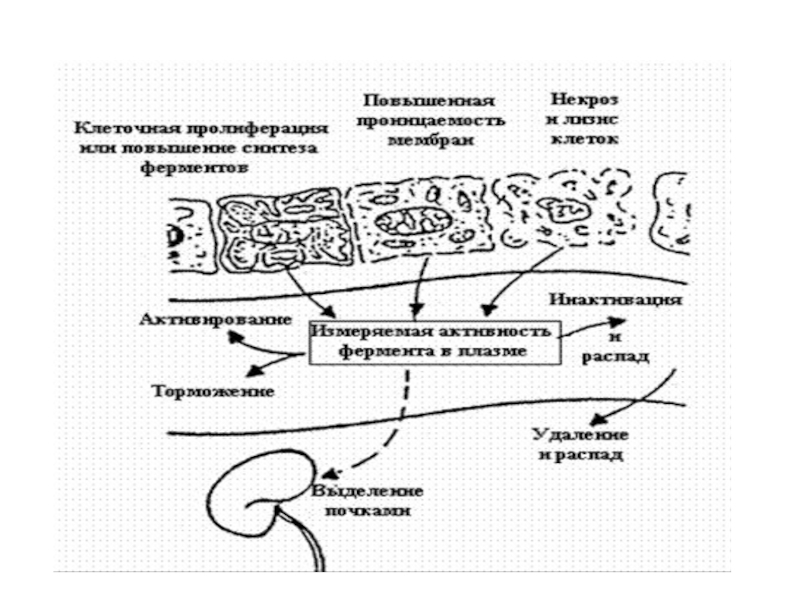
Зная локализацию ферментов в клетке и определяя их активность в крови, можно судить о степени деструкции ткани.
Слайд 4Ядро: локализованы РНК-полимеразы, НАД-синтетаза, ферменты, участвующие в репликации ДНК.
Митохондрии: ферменты
тканевого дыхания, окислительного фосфорилирования, ферменты b-окисления ЖК, цикла Кребса, пируватдегидрогеназного
комплекса, синтеза мочевины.
Лизосомы: гидролитические ферменты с оптимумом рН в области 5 (пептидазы, эстеразы, нуклеазы).
Слайд 5Мультиферментные системы локализуются в структуре органелл таким образом, что каждый
фермент располагается в непосредственной близости от следующего фермента данной последовательной
реакции.
Благодаря также компартментализации в клетке могут одновременно протекать 2 несовместимых процесса, например: b-окисление ЖК (в митохондриях) и синтез ЖК (в цитоплазме).
Слайд 6Органоспецифические ферменты:
Под органоспецифичностью понимают наличие метаболических путей, присущих только данному
органу.
Так вот органоспецифические ферменты - это ферменты, катализирующие определенные метаболические
пути, присущие определенному органу.
Хотя органы и имеют различное выражение того или иного метаболического пути, они имеют важное значение для диагностики многих заболеваний, путем определения их активности:
Слайд 7так для печени характерна высокая активность АсАТ, АлАТ, сорбитдегидрогеназы, ГДГ.
Причем активность АлАТ выше, чем АсАТ, т. к. АсАТ лучше
спрятана во внутриклеточных структурах
Слайд 8Костная ткань - щелочная фосфатаза.
Простата - кислая фосфатаза.
Glandula parotis et
pancreas - амилаза.
Миокард - ЛДГ1 и ЛДГ2 , креатинкиназа (ММ
и MB-изоферменты).
Мышцы - ЛДГ4,5; ММ.
Слайд 9При нарушении целостности тканей этих органов, ферменты выделяются в сыворотку
крови, где их активность резко повышается. В зависимости от того,
активность какого фермента повысилась можно судить не только локализации каталитического процесса, но и о степени его тяжести
Слайд 11Но для более конкретной и точной диагностики заболеваний, для определения
интенсивности и глубины повреждения тканей нужны маркерные ферменты. Это ферменты,
принадлежащие определенной конкретной органелле:
сукцинатдегидрогеназа - внутренняя мембрана митохондрий;
кислые гидролазы - лизосомы;
ферменты гликолиза - цитоплазма и т. д.
Слайд 12Активность фермента
Активность - это изменение количества субстрата
под влиянием фермента в единицу времени. Под изменением субстрата понимают
снижающееся в единицу времени количество субстрата или же увеличивающееся количество продукта.
Слайд 13 Понятие "активность фермента" по сути дела идентична понятию
"скорость ферментативной" реакции. Ферментативная активность выражается в единицах активности. В
связи с существованием различных систем единиц исчисления введена интернациональная (стандартная) единица активности. Она носит символ "U" (unit-единица) и определяется как 1 мкмоль субстрата/мин. В системе СИ в качестве единицы
Слайд 14
В системе СИ в качестве
единицы ферментативной активности используют "катал" (kat). Катал определяется как 1
моль/сек.
1kat = 1 моль/сек.
Слайд 15 Размерность её слишком велика, на практике пользуются
меньшими кратными значениями, начиная с нанокатала (нкат). Это одна миллиардная
катала или 10-9 кат. В сравнении с международной единицей следующее уравнение
1 U = 16,67 нкат
Слайд 16 В практике лабораторий широко пользуются понятием удельная
активность. Для этого число cтандартных единиц пересчитывают на какую-либо единицу
сравнения. Это может быть мг белка в пробе или объем исследуемой биологической жидкости. Определение активности ферментов широко распространено в любой современной клинической лаборатории.
Слайд 17 При исследовании кинетики реакций используется и такое
понятие как молекулярная активность. Она показывает, сколько молекул субстрата в
секунду превращаются в продукт 1 молекулой фермента и используется для сравнительной характеристики активности нескольких ферментов.
Слайд 18Методы исследования активности
Эти методы применяют и для определения количества
продуктов или субстратов реакции, и для изменений количества коферментов, участвующих
в реакции. Последнее нашло широкое применение в практике клинических биохимических лабораторий. В основе этих методов лежит закон Beer-Lambert: A = e x c x l = log (I0/I) (e, поглощение 1 M раствора вещества при специфической длине волны или молярный коэффициент экстинкции; c, концентрация ; A, поглощение ; l, длина в см кюветы спектрофотометра ; I0, интенсивность падающего света; I, интенсивность прошедшего света).
Слайд 19В случае, если молярный коэффициент экстинкции ( исследуемого вещества неизвестен,
исследователь определяет экспериментально зависимость между поглощением света исследуемого раствора
и концентрацией этого вещества и использует полученную закономерность в форме стандартного (калибровочного) графика.
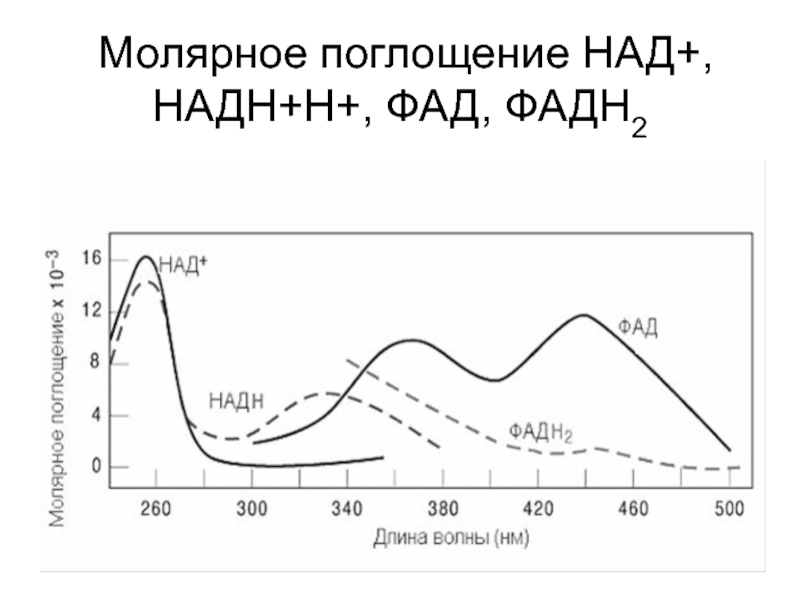
Слайд 20 Молярное поглощение НАД+,НАДН+Н+, ФАД, ФАДН2
Слайд 214 показаны спектральные характеристики коферментов НАД и ФАД в окисленной
и восстановленной форме. Измерение поглощения при 340 нм используется для
количественной оценки активности ферментов, катализирующих окислительно-восстановительные реакции c участием НАД. Вот пример такого расчета для реакции, катализируемой лактатдегидрогеназой В этой реакции молочная кислота окисляется, передавая водороды на НАД+. При этом НАД+ восстанавливается до НАДН +Н+., который в отличие от НАД+ поглощает свет с длиной волны 340 нм.
Слайд 22Допустим, за время проведения реакции поглощение при длине волны 340
нм изменялось на 0.31 единицы в минуту. Измерения проводили в
кювете шириной 1 см. Коэффициент молярной экстинкции для НАДН при 340 нм e = 6200 л моль-1 см-1 .
Слайд 23Классификация ферментов
В настоящее время известны и используются 3 вида классификации
ферментов:
1. Тривиальная (исторически сложившаяся) номенклатура: (пепсин, трипсин).
2. Рациональная предложена французским физиологом П.
Дюкло в 1883 году (к корню названия субстрата прибавляется суффикс
- аза (липид - липаза, протеин - протеаза и т.д.).
3. Современная классификация рассмотрена и утверждена V Всемирным биохимическим конгрессом в г. Москве в 1961 г. В основу ее положен тип катализируемой реакции (всего 6 классов):
Слайд 241) Оксидоредуктазы: катализируют окислительно-восстановительные реакции, лежащие в основе биологического окисления. Название
дается по схеме: донор: « акцептор-оксидоредуктаза» ---> лактат: НАД-оксидоредуктаза.
Различают аэробные
дегидрогеназы или оксидазы, катализирующие перенос протонов (е) непосредственно на кислород; анаэробные дегидрогеназы ускоряющие перенос протонов (е) на промежуточный S, но не на кислород; цитохромы - катализируют перенос только е. Сюда также относятся каталаза и пероксидаза.
Слайд 252) Трансферазы: ферменты, катализирующие перенос (внутри- и межмолекулярный) различных групп атомов.
Название дается по форме: «донор - транспортируемая группа - трансфераза
---> метил-, формилтрансферазы, аминотрансферазы.
Оба этих класса ферментов работают при участии коферментов, которые являются водорастворимыми витаминами: В6, В12, В1, В15.
Слайд 263) Гидролазы: ферменты, катализирующие расщепление внутримолекулярных связей при участии молекулы воды.
Название:
«субстрат-гидролаза». К ним относятся все ферменты ЖКТ; в частности: эстеразы
- гидролиз сложных эфиров; гликозидазы - гидролиз гликозидных связей углеводов; пептидгидролазы - гидролиз пептидных связей.
Слайд 274) Лиазы - ферменты, расщепляющие C-C, C-N, C-O связи не гидролитическим
путем с образованием двойной связи. Название: «субстрат-лиаза». Они обеспечивают отщепление
CO2, H2O, NH3. Декарбоксилазы.
5) Изомеразы: ферменты, катализирующие различные типы реакций изомеризации. Сюда относятся рацемазы и эпимеразы.
Слайд 286) Лигазы (синтетазы) - ферменты, катализирующие синтез органических веществ из 2-х
исходных молекул с использованием энергии АТФ. Название: «X-Y-лигаза». X и
Y - исходные вещества. Например: глутомат-аммиак-лигаза.
Кроме всего этого все существующие ферменты (более 2000) имеют свой цифровой шифр, который присваивается по 4-х значному коду. Т. о. шифр каждого фермента состоит из 4-х цифр, разделенных точками и составляется по следующему принципу.
Слайд 29Первая цифра указывает на номер одногоиз классов ферментов.
Вторая цифра озночает
подкласс, который характеризует тип связи, на которую действует фермент.
Третья цифра
означает подподкласс, который характеризует химическую природу донора или акцептора, участвующего в реакции.
Четвертая цифра обозначает порядковый номер фермента.
Алкогольдегидрогеназа (АДГ); КФ: 1. 1. 1. 1.
Лактатдегидрогеназа (ЛДГ); КФ: 1. 1. 1. 27.
Слайд 30В основе классификации ферментов - тип катализируемой реакции
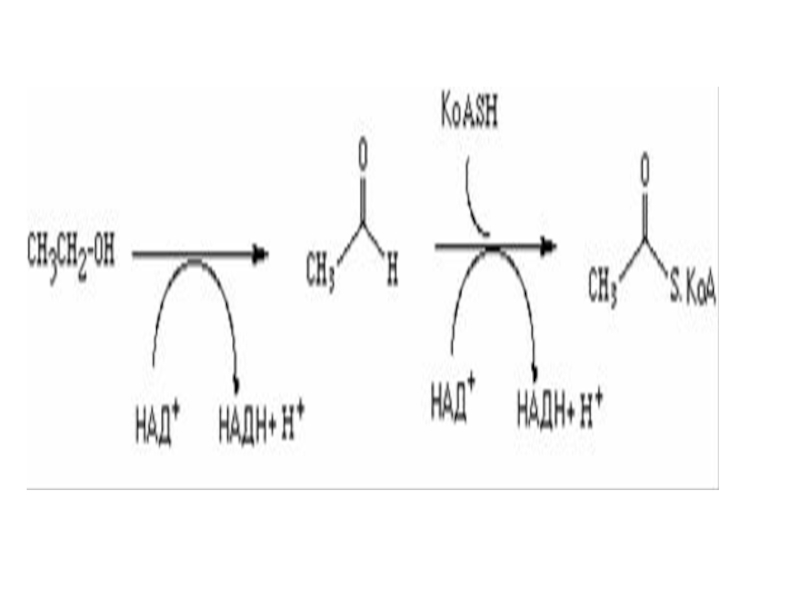
Слайд 31Оксидоредуктазы - ферменты, которые катализируют реакции восстановления или окисления. Например
алкогольдегидрогеназа, фермент, который окисляет этиловый спирт в уксусный альдегид. Второй
фермент, известный как альдегиддегидрогеназа затем преобразовывает уксусный альдегид в ацетил КoA. Оксидоредуктазы часто требуют участия кофакторов, выполняющих роль промежуточных акцепторов водорода в приводимом ниже примере это НАД+.
Слайд 34Различают аэробные дегидрогеназы или оксидазы, катализирующие перенос протонов (е) непосредственно
на кислород; анаэробные дегидрогеназы ускоряющие перенос протонов (е) на промежуточный
S, но не на кислород; цитохромы - катализируют перенос только е. Сюда также относятся каталаза и пероксидаза.
Слайд 35Оксидоредуктазы (1.0.0.0.)
1.1.0.0. Действуют на СН-ОН группы доноров
1.1.1.0. НАД+ или НАДФ+ в качестве акцепторов
1.1.1.1. Алкогольдегидрогеназа
1.14.0.0. Действуют на парные доноры при включении в один из них кислорода
1.14.15.0. Один из доноров восстановленный железо-серный белок и
включение одного атома кислорода
1.14.15.1. Цитохром Р-450
1.14.15.5. Кортикостерон 18-монооксигеназа
Слайд 36Трансферазы:
ферменты, катализирующие перенос (внутри- и межмолекулярный) различных групп атомов.
Название дается по форме: «донор - транспортируемая группа - трансфераза
---> метил-, формилтрансферазы, аминотрансферазы.
Оба этих класса ферментов работают при участии коферментов, которые являются водорастворимыми витаминами: В6, В12, В1, В15.
Слайд 37Трансферазы (2.0.0.0.)
2.1.0.0.Переносят одноуглеродные группы
2.1.1.0.
Метилтрансферазы
2.1.1.1. Никотинамид метилтрансфераза
2.1.1.45. Тимидилат синтаза
2.3.0.0. Ацилтрансферазы
2.3.1.6. холинацетил трансфераза
Слайд 38Гидролазы:
Гидролазы: ферменты, катализирующие расщепление внутримолекулярных связей при участии молекулы воды.
Название:
«субстрат-гидролаза». К ним относятся все ферменты ЖКТ; в частности: эстеразы
- гидролиз сложных эфиров; гликозидазы - гидролиз гликозидных связей углеводов; пептидгидролазы - гидролиз пептидных связей.
Слайд 39Гидролазы (3.0.0.0.)
3.1.0.0.Действуют на эфирные связи
3.1.1.0.Гидролазы эфиров карбоновых кислот
3.1.1.17. Ацетилхолинэстераза
3.2.1.0. Гликозидгидролазы
3.2.1.1. амилаза
3.2.1.2. -амилаза
3.4.0.0. Действуют на пептидные связи
3.4.21.0.Сериновые протеазы
3.4.21.1.Химотрипсин
3.4.21.4. Трипсин
3.4.21.5. Тромбин
Слайд 40Лиазы (десмолазы) –ферменты, которые катализируют распад C-C, C-O и C-N
связями негидролитическим путем с образованием двойных связей. Примером может быть
фермент ДОФА декарбоксилаза, которая является ключевым ферментом в синтезе биогенных аминов адреналина и норадреналина.
Слайд 41Лиазы(4.0.0.0)4.1.0.0.Углерод-углерод лиазы 4.1.1.0.Карбокси лиазы
4.1.1.1. Пируватдекарбоксилаза 4.2.0.0. Углерод-кислород-лиазы 4.2.1.0. Гидролиазы 4.2.1.11. Енолаза 4.2.1.12. Фосфоглюконатдегидраза
Слайд 42Изомеразы: ферменты, катализирующие различные типы реакций изомеризации. Сюда относятся рацемазы
и эпимеразы.
Слайд 43Изомеразы (5.0.0.0.)5.1.0.0. Рацемазы и эпимеразы
5.1.1.0. Действуют на аминокислоты и их производные
5.1.1.1. Аланинрацемаза 5.3.0.0. Внутримолекулярные оксидоредуктазы. 5.3.1.0.Взаимопревращают альдозы и кетозы 5.3.1.9. Фосфоглюкоизомераза 5.3.1.20. Рибозоизомераза
Слайд 446) Лигазы (синтетазы) - ферменты, катализирующие синтез органических веществ из 2-х
исходных молекул с использованием энергии АТФ. Название: «X-Y-лигаза». X и
Y - исходные вещества. Например: глутомат-аммиак-лигаза.
Слайд 45
Лигазы (6.0.0.0)6.1.0.0. Образуют С-О связи
6.1.1.0.Образуют молекулы аминоацил-тРНК и родственные им соединения.
6.1.1.1. Тирозил-тРНК синтаза 6.5.0.0. Образуют фосфоэфирные связи 6.5.1.1. ДНК-лигаза (АТФ -зависимая) 6.5.1.2. ДНК-лигаза (НАД+-зависимая)