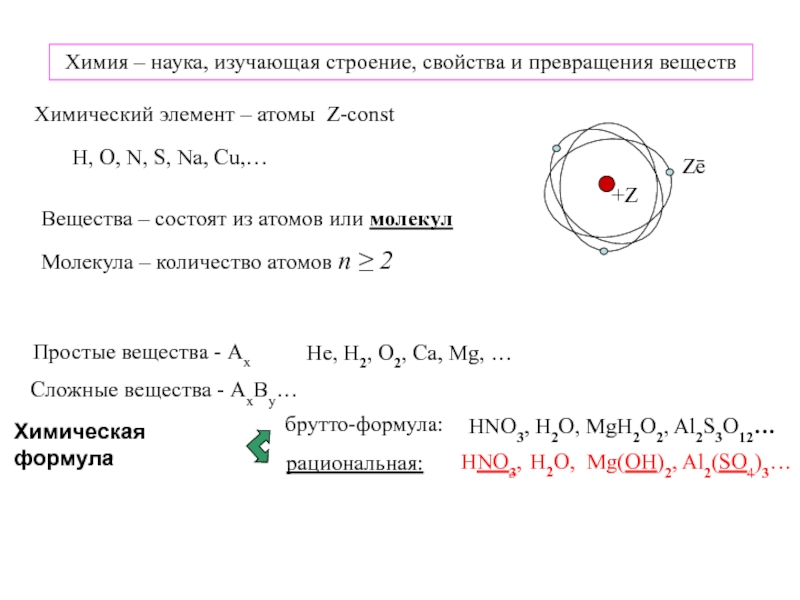
элемент – атомы Z-const
Zē
Молекула – количество атомов n ≥ 2
H,
O, N, S, Na, Cu,…Вещества – состоят из атомов или молекул
Простые вещества - Ax
Сложные вещества - AxBy…
Химическая формула
H2O,