Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Материаловедение
Содержание
- 1. Материаловедение
- 2. Материаловедениедоц. Лазарева Н.П.т.234-31-64, NPLazareva@mail.eltech.ruКафедра микроэлектроники, а.5270Учебный график(по учебным неделям)Расписание лекций
- 3. Материаловедениедоц. Лазарева Н.П.т.234-31-64, NPLazareva@mail.eltech.ruКафедра микроэлектроники, а.5270ЛИТЕРАТУРА
- 4. ОСНОВНЫЕ СВЕДЕНИЯ О СТРОЕНИИ ВЕЩЕСТВА Материаловедениедоц. Лазарева
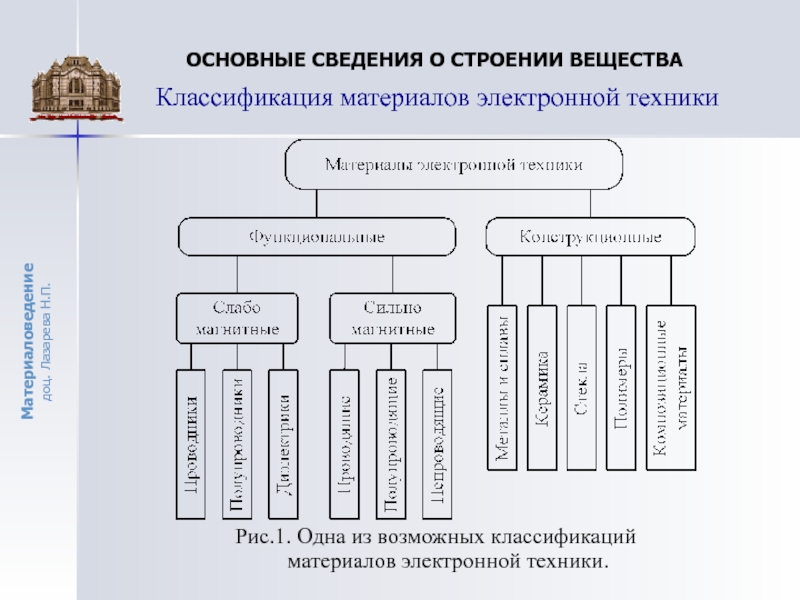
- 5. Рис.1. Одна из возможных классификаций материалов электронной
- 6. Классификация материалов Материалы, используемые в электронной технике
- 7. Классификация материаловПо реакции на внешнее электрическое поле
- 8. Стрктура атома и молекулы водорода:а – простейшая
- 9. Строение атомовОСНОВНЫЕ СВЕДЕНИЯ О СТРОЕНИИ ВЕЩЕСТВА Энергетические
- 10. Энергетические уровни атома водородаСтроение атомовОСНОВНЫЕ СВЕДЕНИЯ О
- 11. Энергетические уровни атома водородаСтроение атомовОСНОВНЫЕ СВЕДЕНИЯ О
- 12. Заселение электронных состояний в атомах начинается с
- 13. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Материаловедение
доц. Лазарева Н.П.
Министерство образования Российской Федерации
Санкт-Петербургский государственный электротехнический университет
«ЛЭТИ»
Факультет электроники
Слайд 2Материаловедение
доц. Лазарева Н.П.
т.234-31-64, NPLazareva@mail.eltech.ru
Кафедра микроэлектроники, а.5270
Учебный график
(по учебным неделям)
Расписание лекций
Слайд 3Материаловедение
доц. Лазарева Н.П.
т.234-31-64, NPLazareva@mail.eltech.ru
Кафедра микроэлектроники, а.5270
ЛИТЕРАТУРА
Слайд 4ОСНОВНЫЕ СВЕДЕНИЯ О СТРОЕНИИ ВЕЩЕСТВА
Материаловедение
доц. Лазарева Н.П.
Министерство образования Российской
Федерации
Санкт-Петербургский государственный электротехнический университет
«ЛЭТИ»
Факультет электроники
Кафедра микроэлектроники
тема 1
Слайд 5
Рис.1. Одна из возможных классификаций материалов электронной техники.
ОСНОВНЫЕ СВЕДЕНИЯ
О СТРОЕНИИ ВЕЩЕСТВА
Классификация материалов электронной техники
Слайд 6Классификация материалов
Материалы, используемые в электронной технике (МЭТ), можно подразделить
на функциональные и конструкционные. Под функциональными МЭТ следует понимать материалы,
которые обеспечивают реализацию определенных функций в элементах электронной аппаратуры.В качестве примеров функциональных МЭТ можно назвать резистивные, конденсаторные и электроизоляционные материалы, высокопроводящие и сверхпроводящие вещества, материалы для хранения и записи информации, материалы с нелинейными электрическими свойствами, материалы для активных элементов полупроводниковой электроники, таких как диоды, транзисторы, лазеры, фотодетекторы и др.
Конструкционными называют материалы, предназначенные для из-готовления корпусов и деталей различных приборов и устройств элек-тронной техники.
К ним предъявляются прежде всего жесткие эксплуатационные, технологические и экономические требования.
Слайд 7Классификация материалов
По реакции на внешнее электрическое поле функциональные МЭТ принято
подразделять на проводники, полупроводники и диэлектрики.
Объективным критерием, по которому
определяют принадлежность материала к той или иной группе, является удельное электрическое сопротивление ρ в нормальных условиях эксплуатации. удельное электрическое сопротивление ρ=1/γ,
где γ=enμ; μ=(e2nλ)/(2mu);
е [A·c], n [м-3], μ [м2/(В·с)], λ [м], m [кг], u [м/с]
γ [См/м], ρ [Ом∙м]
К проводникам относят материалы с удельным электрическим сопротивлением ρ < 10−5 Ом∙м, к диэлектрикам – материалы, у которых
ρ > 108 Ом∙м.
Удельное сопротивление полупроводников может изменяться в очень широких пределах – от 10−5 до 108 Ом∙м.
По поведению в магнитном поле функциональные МЭТ классифицируют на слабомагнитные и сильномагнитные вещества.
Слайд 8Стрктура атома и молекулы водорода:
а – простейшая планетарная модель атома
водорода Э. Резерфорда (пунктиром показана разрешенная орбита электрона в возбужденном состоянии);
где
е и m – заряд и масса электрона, соответственно; Ze – заряд ядра; v – скорость движения электрона по орбите; ε0 – электрическая постоянная (ε0 = 8,85· 10-12 Ф/м). б – квантовомеханическая модель электронной структуры двух уединенных атомов водорода; в – то же, для молекулы водорода.
ОСНОВНЫЕ СВЕДЕНИЯ О СТРОЕНИИ ВЕЩЕСТВА
Строение атомов
Слайд 9Строение атомов
ОСНОВНЫЕ СВЕДЕНИЯ О СТРОЕНИИ ВЕЩЕСТВА
Энергетические соотношения для простейшей
модели атома водорода:
1 – ядро;
2 – электронная орбита;
3 –
разрешенный энергетический уровень электрона Полная энергия электрона Э в атоме складывается из кинетической энергии движения по орбите ЭК и потенциальной энергии ЭП, обусловленной полем протонов:
Характерная особенность потенциальной кривой ЭП (r) заключается в сильном увеличении ее крутизны по мере уменьшения r.
При движении электрона в поле центральных сил полная и кинетическая энергия одинаковы по величине, но противоположны по знаку, причем каждая из них равна половине потенциальной энергии.
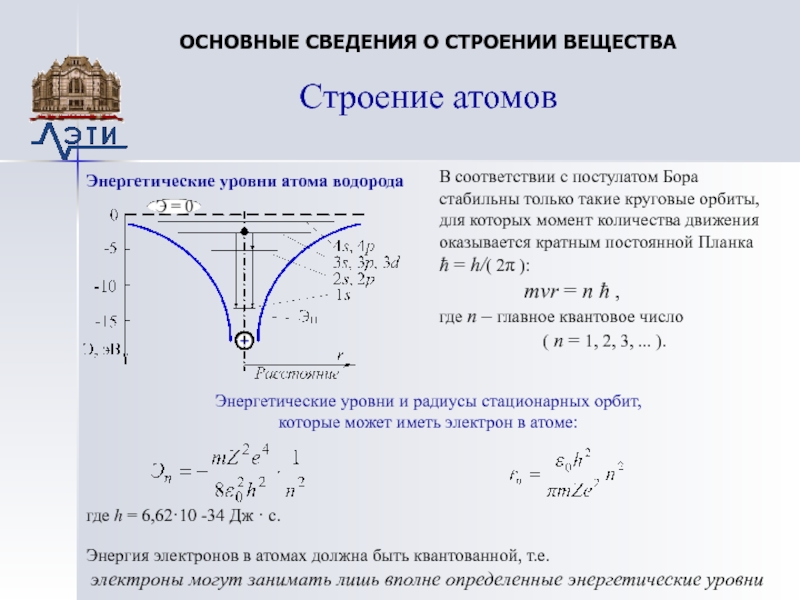
Слайд 10Энергетические уровни атома водорода
Строение атомов
ОСНОВНЫЕ СВЕДЕНИЯ О СТРОЕНИИ ВЕЩЕСТВА
В
соответствии с постулатом Бора стабильны только такие круговые орбиты, для
которых момент количества движения оказывается кратным постоянной Планка ћ = h/( 2π ):mvr = n ћ ,
где n – главное квантовое число
( n = 1, 2, 3, ... ).
Энергетические уровни и радиусы стационарных орбит,
которые может иметь электрон в атоме:
где h = 6,62·10 -34 Дж · с.
Энергия электронов в атомах должна быть квантованной, т.е.
электроны могут занимать лишь вполне определенные энергетические уровни
Слайд 11Энергетические уровни атома водорода
Строение атомов
ОСНОВНЫЕ СВЕДЕНИЯ О СТРОЕНИИ ВЕЩЕСТВА
По
мере возрастания главного квантового числа n увеличивается плотность расположения уровней
на энергетической шкале. Соответственно, уменьшается дискретность энергии и поведение электрона приближается к классическому.Значение n = ∞ определяет границу между сплошными и дискретными состояниями.
Переход электрона в область состояний со сплошным энергетическим спектром означает его отрыв от атома с некоторой кинетической энергией, т.е. ионизацию атома.
Энергия ионизации определяется глубиной залегания основного состояния относительно сплошного спектра. Для атома водорода Э1 = – 13,6 эВ.
Этому состоянию соответствует радиус электронной орбиты r = a0 = 0,53·10-10 м, который в физике принято называть боровским радиусом.
Постулат Бора: в атоме разрешенными являются лишь те электронные орбиты,
на длине которых укладывается целое число длин волн де Бройля λ = h/( mv).
Слайд 12Заселение электронных состояний в атомах начинается с самых низких энергетических
уровней, затем заполняются более высокие, а верхние уровни остаются свободными
и соответствуют возбужденному состоянию атома.В квантовой теории атома каждое электронное состояние описывается набором четырех квантовых чисел. Главное квантовое число n определяет энергию электрона. Совокупность электронов, обладающих одинаковым значением главного квантового числа, называют электронной оболочкой.
Состояниям с квантовыми числами n = 1, 2, 3, 4, 5, ... присвоены буквенные обозначения K, L, M, N, O, P, Q.
В свою очередь, оболочки подразделяют на под-оболочки, отличающиеся значением азимутального квантового числа l. Последнее определяет орбитальный (вращательный) момент количества движения электрона MLв соответствии с формулой
Строение атомов
ОСНОВНЫЕ СВЕДЕНИЯ О СТРОЕНИИ ВЕЩЕСТВА
l = (n – 1) = 0, 1, 2, 3, ... .
Спектроскопические обозначения электронных состояний в атоме:
1s, 2s, 2p, 3s, 3p, 3d, 4s, 4p, 4d, 4f и т.д.
первая цифра всегда указывает главное квантовое число n.