Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Алкадиены: получение и свойства
Содержание
- 1. Алкадиены: получение и свойства
- 2. Изучив тему следует Знать:Физические и химические
- 3. Ответьте на вопросы:Что такое алкадиены?Какие виды алкадиенов
- 4. Слайд 4
- 5. Слайд 5
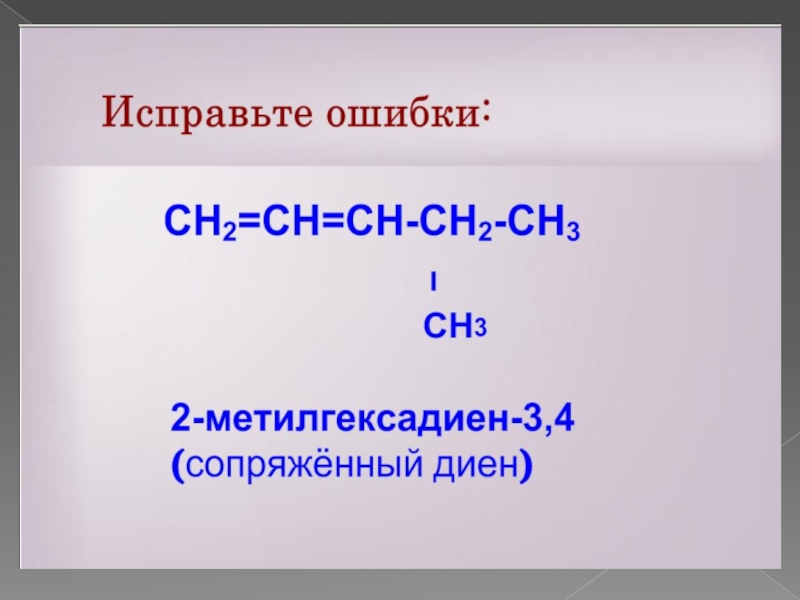
- 6. Какие виды изомерии характерны для алкадиенов?1. CH2
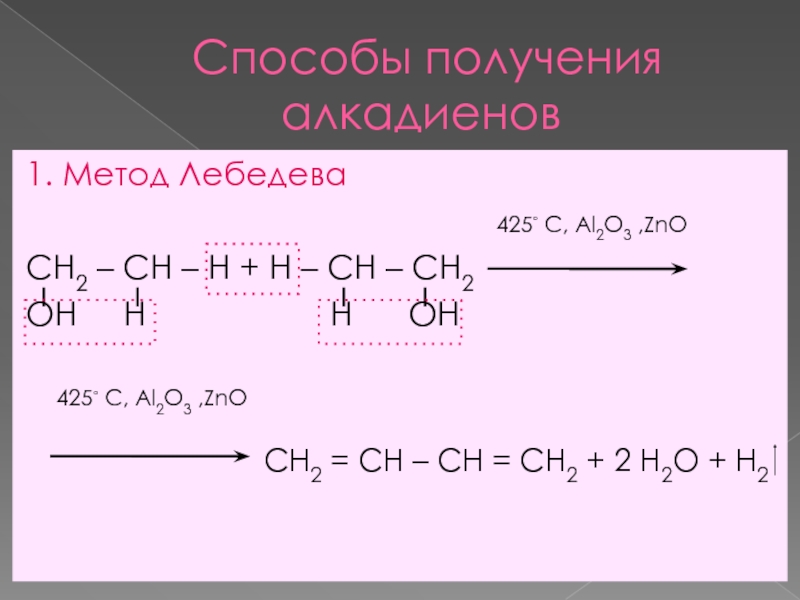
- 7. Способы получения алкадиенов1. Метод Лебедева
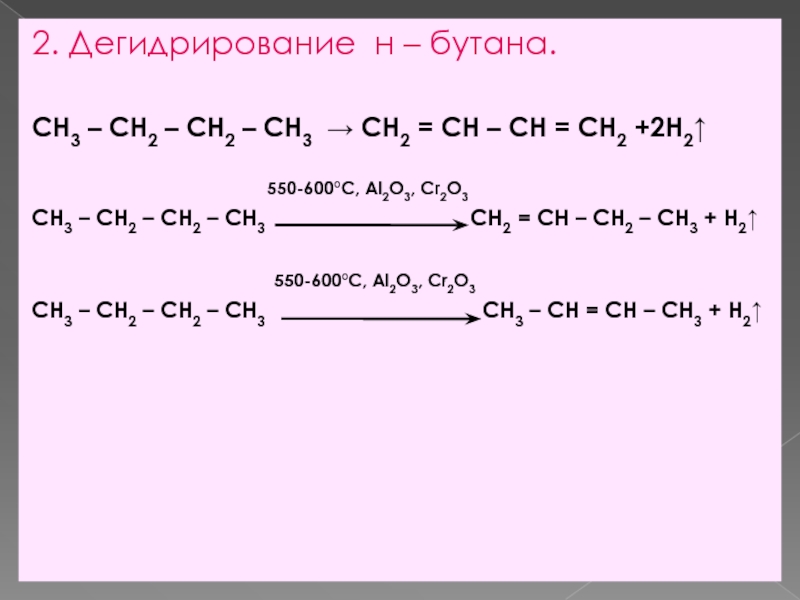
- 8. 2. Дегидрирование н – бутана.CH3 – CH2
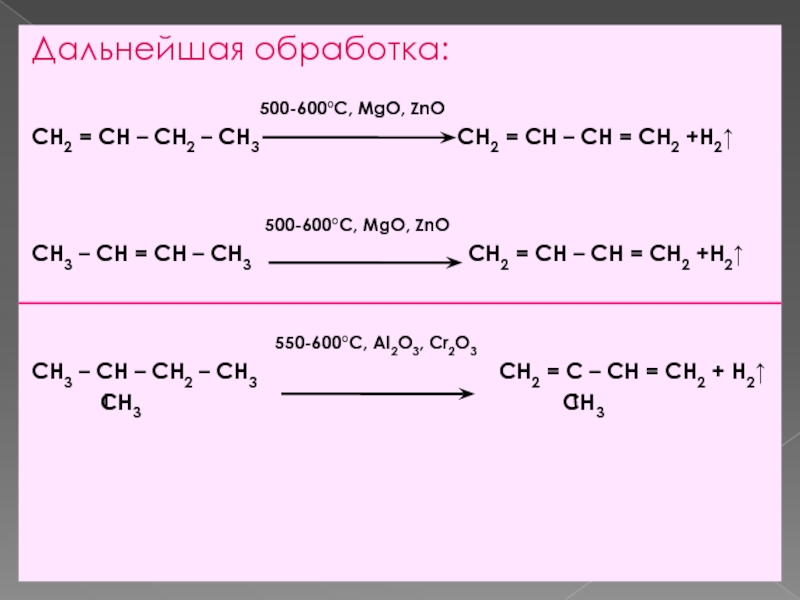
- 9. Дальнейшая обработка:
- 10. 3. Способ дегидрогалогенирования.Br
- 11. Химические свойства алкадиенов1. Реакции присоединенияа) гидрированияCH2 =
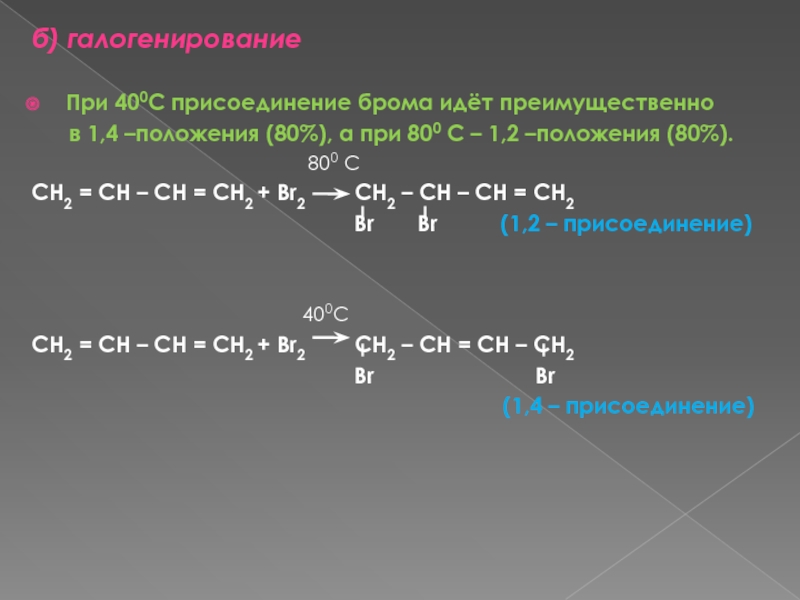
- 12. б) галогенированиеПри 400С присоединение брома идёт преимущественно
- 13. в) гидрогалогенированиеЗапишите уравнение реакции гидрогалогенирования на примере
- 14. Механизм электрофильного присоединения галогеноводорода к алкадиену.1,2 -
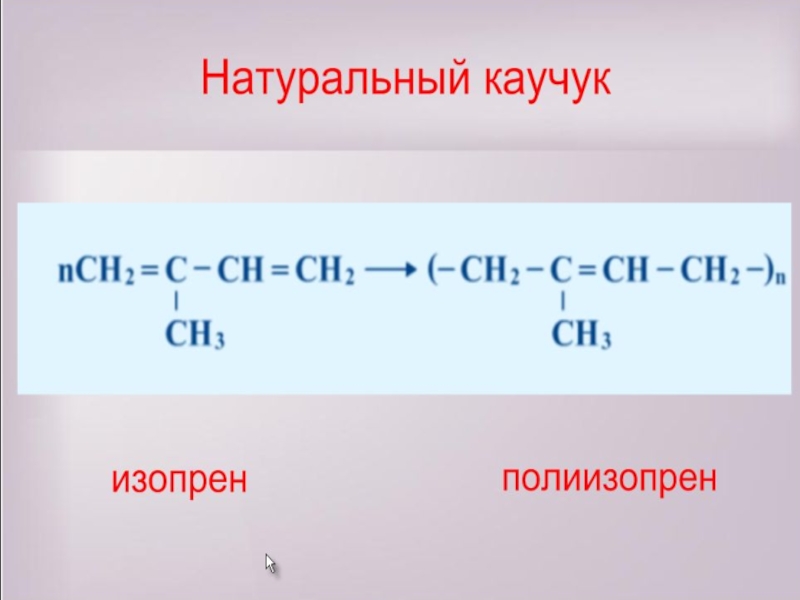
- 15. 2. Реакции полимеризации
- 16. Слайд 16
- 17. Слайд 17
- 18. Скачать презентанцию
Изучив тему следует Знать:Физические и химические свойства алкадиеновСпособы получения алкадиеновУметь:Объяснять взаимосвязь строения и свойствСоставлять уравнения химических реакций, характеризующих химические свойства способы получения алкадиенов
Слайды и текст этой презентации
Слайд 2Изучив тему следует
Знать:
Физические и химические свойства алкадиенов
Способы получения алкадиенов
Уметь:
Объяснять
взаимосвязь строения и свойств
способы получения алкадиеновСлайд 3Ответьте на вопросы:
Что такое алкадиены?
Какие виды алкадиенов различают в зависимости
от взаимного расположения двойных связей в молекулах?
Как образуется единая π
– система в бутадиене – 1,3?Слайд 6Какие виды изомерии характерны для алкадиенов?
1. CH2 = CH –
CH = CH2
2. CH2 = C – CH =
CH2 СН3
3. CH2 = C = CH – CH3
4. CH2 = CH – CH2 - CH = СН2
5. CH ≡ C – CH2 – CH3
Распределите вещества по группам
а)гомологи б) изомеры.
Дайте название изомерам и сгруппируйте по видам.
Слайд 7 Способы получения алкадиенов
1. Метод Лебедева
425◦ С, Al2O3 ,ZnO
СН2 – СН – Н + Н – СН – СН2
OH H H OH
425◦ С, Al2O3 ,ZnO
CH2 = CH – CH = CH2 + 2 H2O + H2
Слайд 82. Дегидрирование н – бутана.
CH3 – CH2 – CH2 –
CH3 CH2 = CH – CH = CH2 +2Н2
550-600°C, Al2O3, Cr2O3
CH3 – CH2 – CH2 – CH3 CH2 = CH – CH2 – CH3 + H2
550-600°C, Al2O3, Cr2O3
CH3 – CH2 – CH2 – CH3 CH3 – CH = CH – CH3 + H2
Слайд 9Дальнейшая обработка:
500-600°С, MgO, ZnO
CH2 = CH – CH2 – CH3 CH2 = CH – CH = CH2 +Н2
500-600°С, MgO, ZnO
CH3 – CH = CH – CH3 CH2 = CH – CH = CH2 +Н2
550-600°C, Al2O3, Cr2O3
CH3 – CH – CH2 – CH3 CH2 = C – CH = CH2 + Н2
СН3 СН3
Слайд 103. Способ дегидрогалогенирования.
Br
Br
CH2 – CH2 –
CH2 – CH2 + 2 КОН (спирт) CH2 = CH – CH = CH2 ++ 2KBr + 2H2O
Br Br
CH2 – CH2 – CH – CH3 + 2 КОН (спирт) CH2 = CH – CH = CH2 +
+ 2KBr + 2H2O
Слайд 11Химические свойства алкадиенов
1. Реакции присоединения
а) гидрирования
CH2 = CH – CH
= CH2 + H2 [CH2 – CH –
CH – CH2 ]H H
CH3 – CH = CH – CH3 ( 1,4 – присоединение)
В присутствии катализатора получают продукт полного гидрирования:
Ni
CH2 = CH – CH = CH2 + H2 CH3 – CH2 – CH2 – CH3
Слайд 12б) галогенирование
При 400С присоединение брома идёт преимущественно
в 1,4 –положения (80%), а при 800 С – 1,2
–положения (80%).800 С
CH2 = CH – CH = CH2 + Br2 CH2 – CH – CH = CH2
Br Br (1,2 – присоединение)
400С
CH2 = CH – CH = CH2 + Br2 CH2 – CH = CH – CH2
Br Br
(1,4 – присоединение)
Слайд 13в) гидрогалогенирование
Запишите уравнение реакции гидрогалогенирования на примере
бутадиена – 1,3.
Объясните 1,2 - присоединение галогенаводорода к алкадиену.
Почему у
алкадиенов с сопряженными двойными связями возможно 1,4 – присоединение ?Слайд 14Механизм электрофильного присоединения галогеноводорода к алкадиену.
1,2 - присоединение
CH2 = CH
– CH = CH2 +Н+ → CH3 – CH+ –
CH = CH2CH3 – CH+ – CH = CH2 + Br- → CH3 – CHBr – CH = CH2
1,4 - присоединение
CH3 – CH+ – CH = CH2 ↔ CH3 – CH = CH – CH2+
CH3 – CH = CH – CH2+ + Br- → CH3 – CH = CH – CH2Br
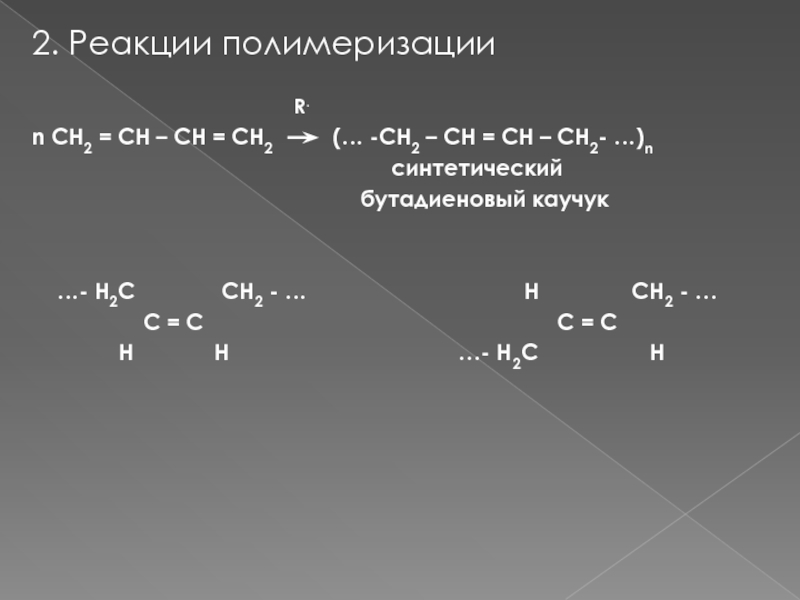
Слайд 152. Реакции полимеризации
R.
n CH2 = CH – CH = CH2 (… -CH2 – CH = CH – CH2- …)n
синтетический
бутадиеновый каучук
…- Н2С СН2 - … Н СН2 - …
С = С С = С
Н Н …- Н2С Н