Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
АЛКЕНЫ
Содержание
- 1. АЛКЕНЫ
- 2. АлкеныАлкенами называются ненасыщенные углеводороды, молекулы которых содержат одну двойную связь. СnН2n олефины
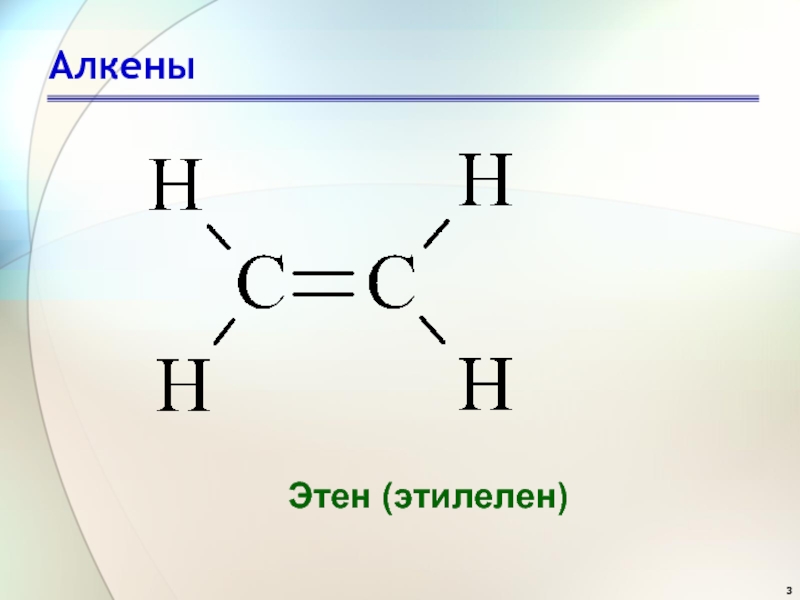
- 3. АлкеныЭтен (этилелен)
- 4. АлкеныНоменклатура1) в алкенах с неразветвленной цепью нумерацию
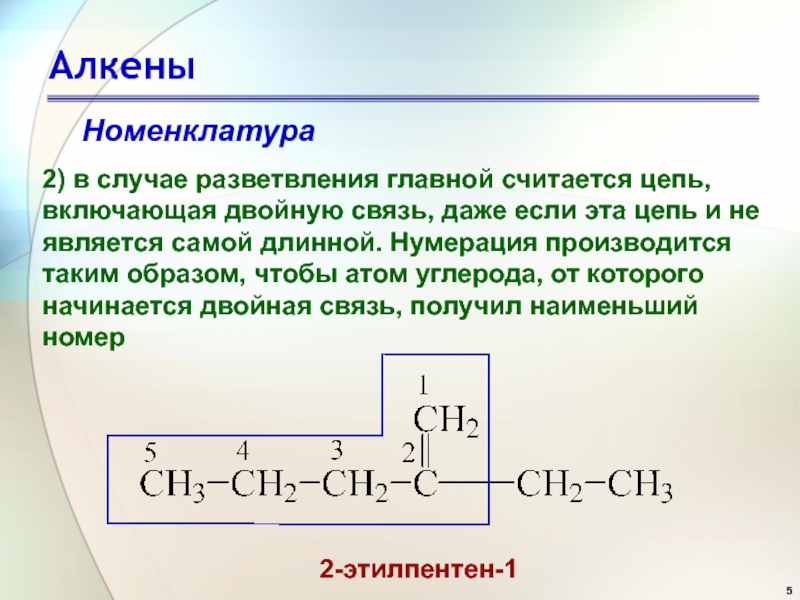
- 5. АлкеныНоменклатура2) в случае разветвления главной считается цепь,
- 6. АлкеныНоменклатура3) Углеводородные заместители обозначаются префиксом. Положение их
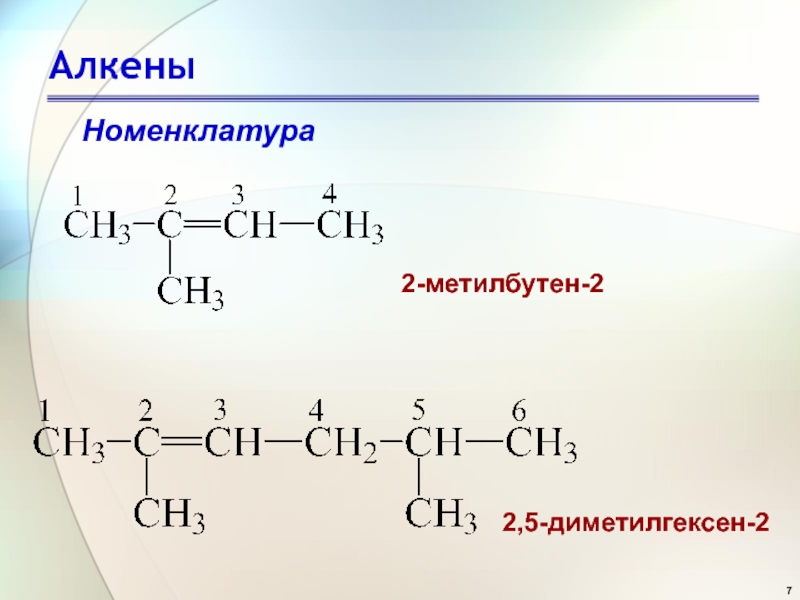
- 7. АлкеныНоменклатура2-метилбутен-2 2,5-диметилгексен-2
- 8. АлкеныНоменклатураэтенил(винил) 2-пропенил(аллил)
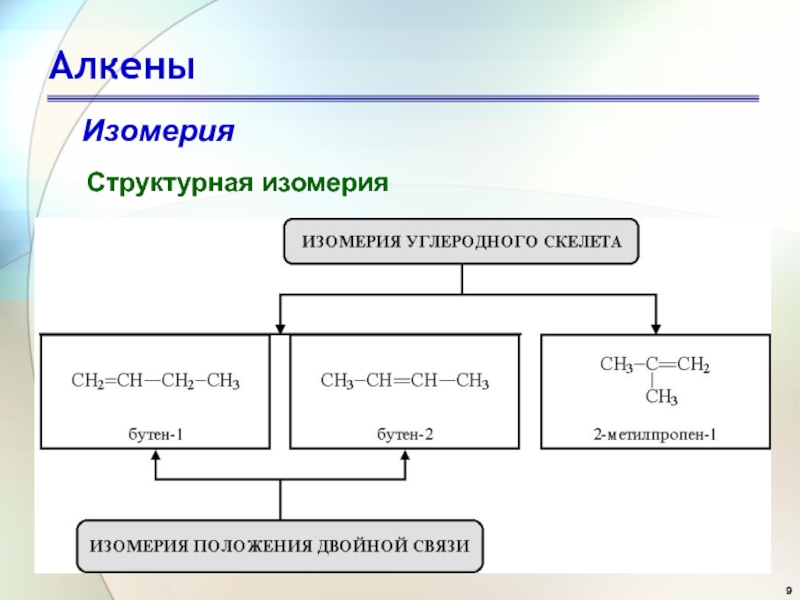
- 9. АлкеныИзомерияСтруктурная изомерия
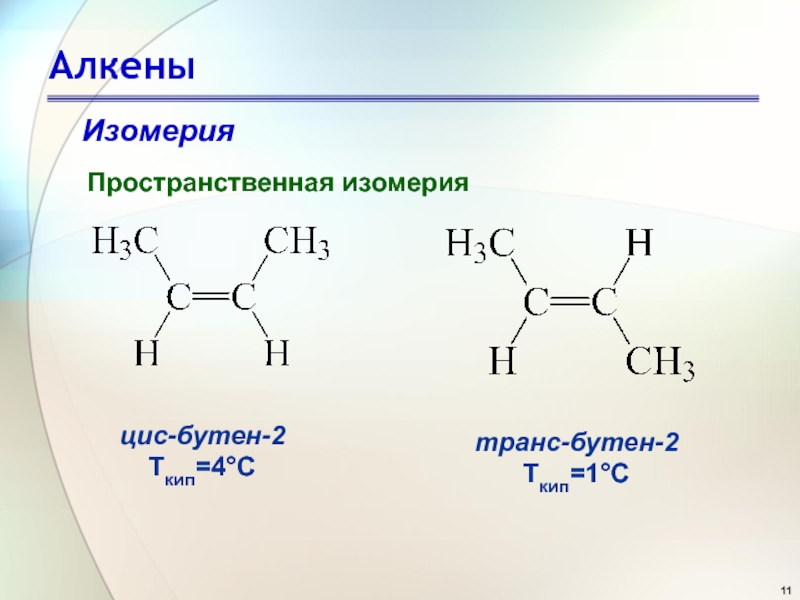
- 10. АлкеныИзомерияПространственная изомерия Цис- и транс-изомеры бутена-2
- 11. АлкеныИзомерияПространственная изомерия цис-бутен-2Ткип=4°С транс-бутен-2Ткип=1°С
- 12. АлкеныНоменклатура цис-, транс-изомеров
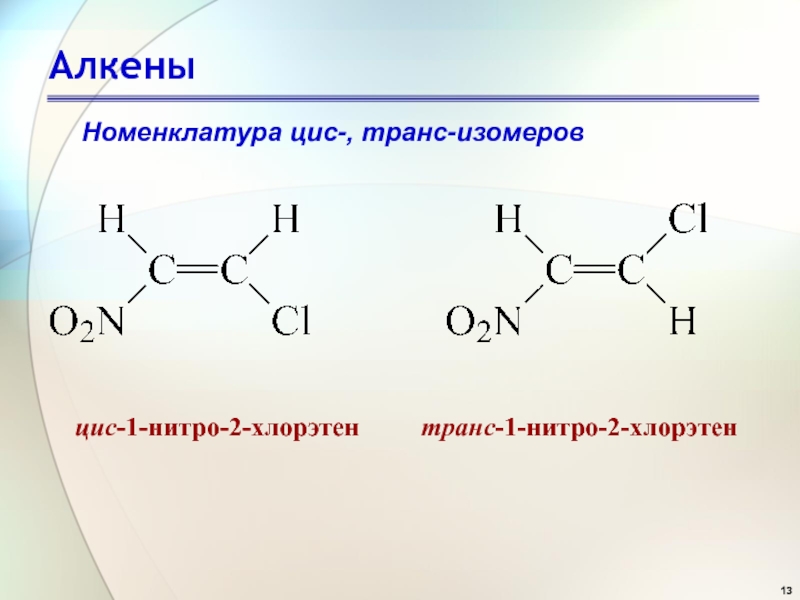
- 13. АлкеныНоменклатура цис-, транс-изомеров
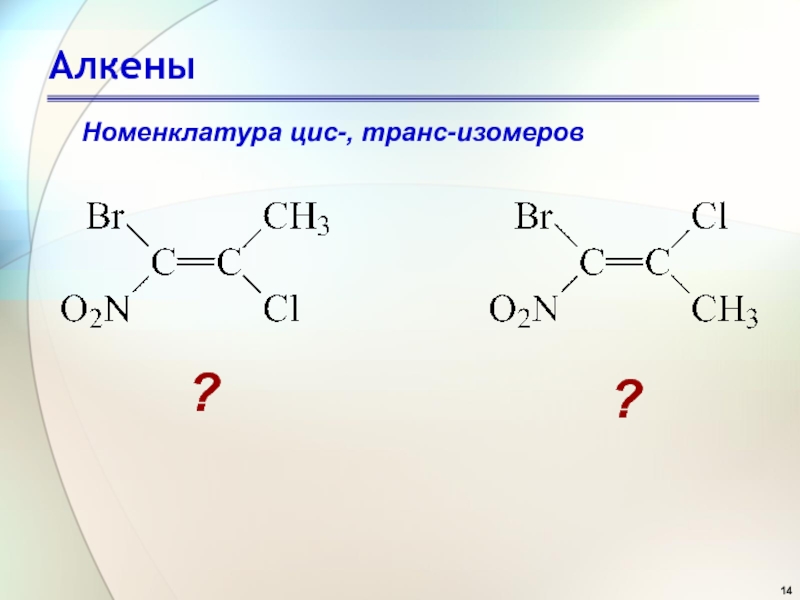
- 14. АлкеныНоменклатура цис-, транс-изомеров ??
- 15. АлкеныНоменклатура цис-, транс-изомеров Система Кана–Ингольда–Прелога Прелог Владимир(23.07.1906–07.01.1998) (Швейцария)Ингольд Кристофер (28.10.1893–8.10.1970) (Великобритания)Роберт Сидни Кан(9.06.1899-15.09.1981) (Великобритания)?
- 16. АлкеныНоменклатура цис-, транс-изомеров 1. Используя систему Кана–Ингольда–Прелога,
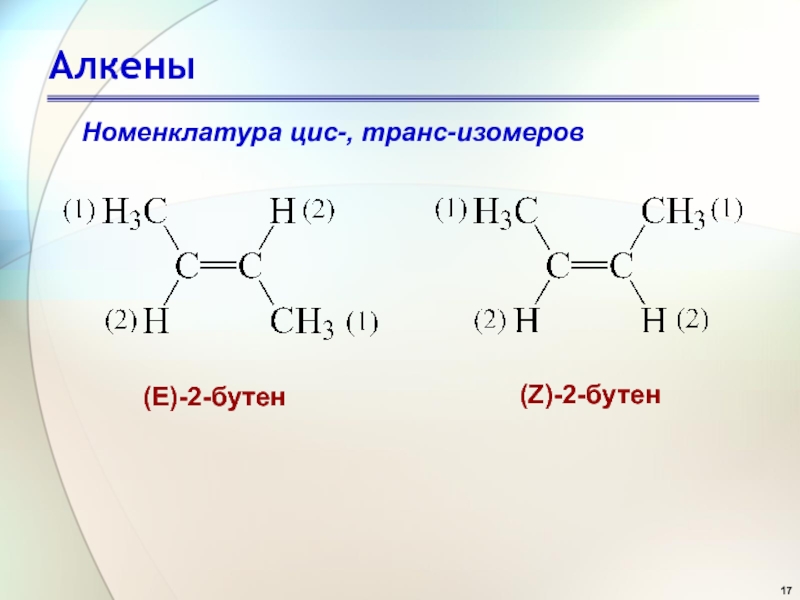
- 17. АлкеныНоменклатура цис-, транс-изомеров (Е)-2-бутен (Z)-2-бутен
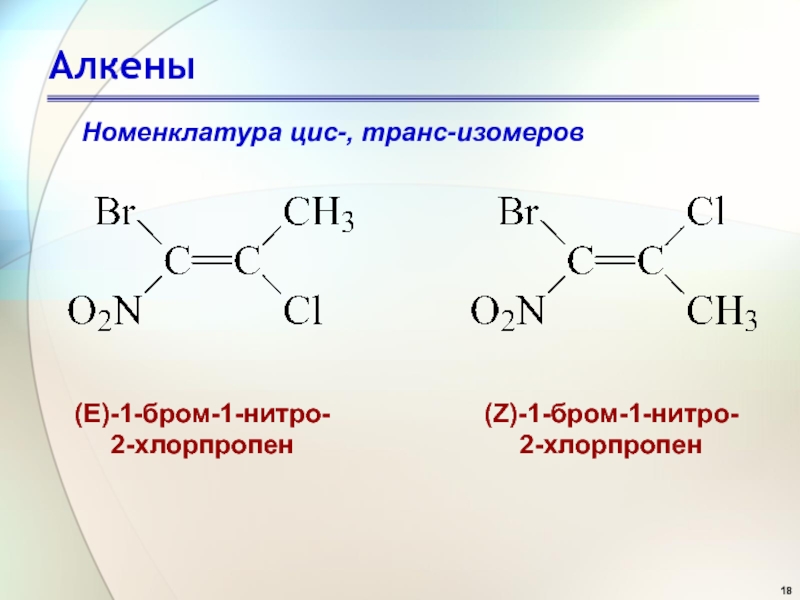
- 18. АлкеныНоменклатура цис-, транс-изомеров (Е)-1-бром-1-нитро-2-хлорпропен (Z)-1-бром-1-нитро-2-хлорпропен
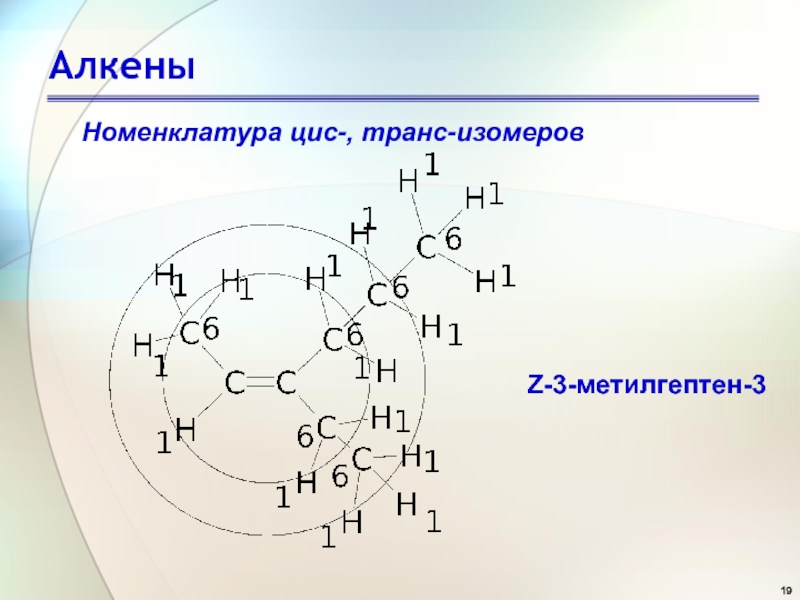
- 19. АлкеныНоменклатура цис-, транс-изомеров Z-3-метилгептен-3
- 20. АлкеныФизическиесвойства
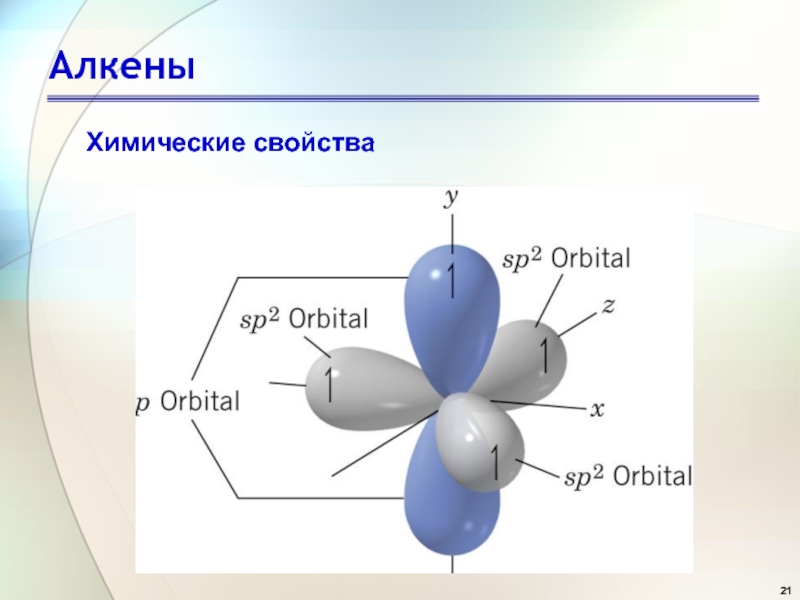
- 21. АлкеныХимические свойства
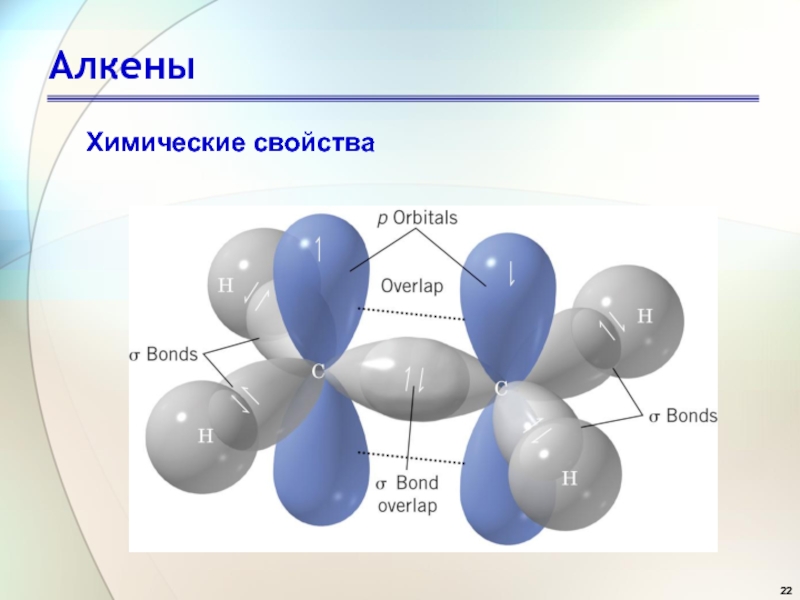
- 22. АлкеныХимические свойства
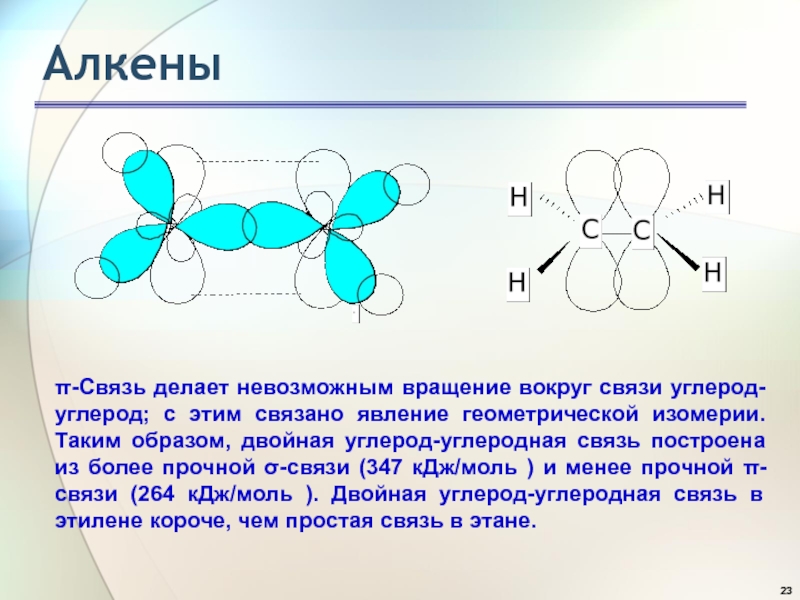
- 23. Алкеныπ-Связь делает невозможным вращение вокруг связи углерод-углерод;
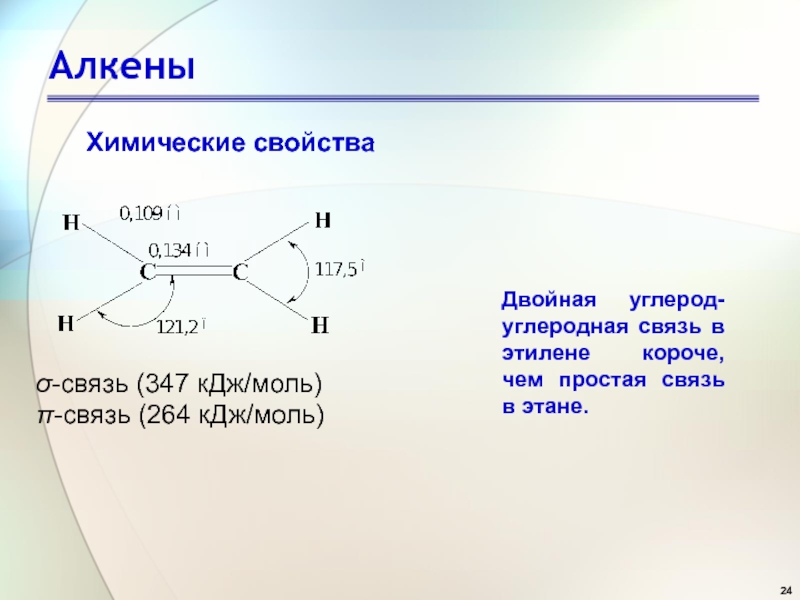
- 24. Алкеныσ-связь (347 кДж/моль)π-связь (264 кДж/моль) Химические свойства
- 25. АлкеныХимические свойства Расстояние С-Н в этилене равно
- 26. АлкеныХимические свойства Чем больше доля s-состояния в
- 27. АлкеныТипичными реакциями двойной связи являются реакции, в
- 28. АлкеныОблака π-электронов находятся над и под плоскостью,
- 29. АлкеныХимические свойства
- 30. АлкеныСуществуют реагенты другого типа, также обедненные электронами,
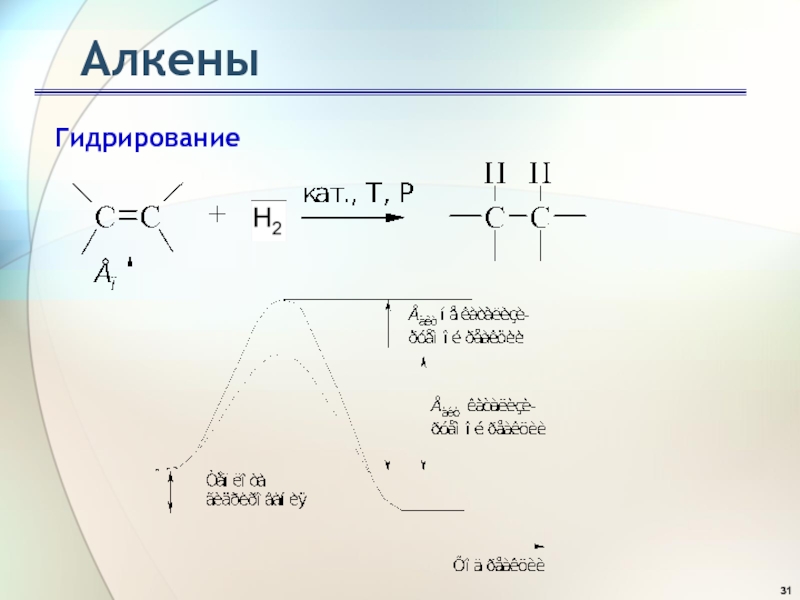
- 31. АлкеныГидрирование
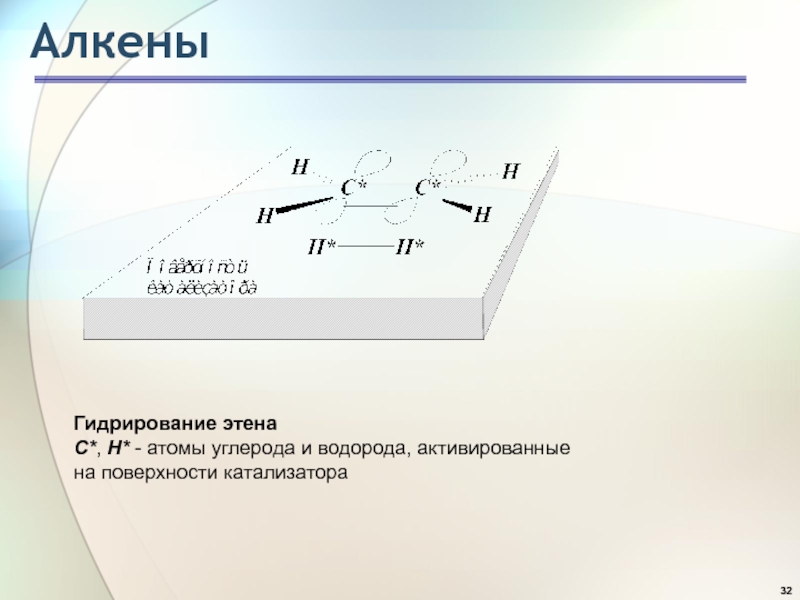
- 32. АлкеныГидрирование этенаС*, H* - атомы углерода и водорода, активированные на поверхности катализатора
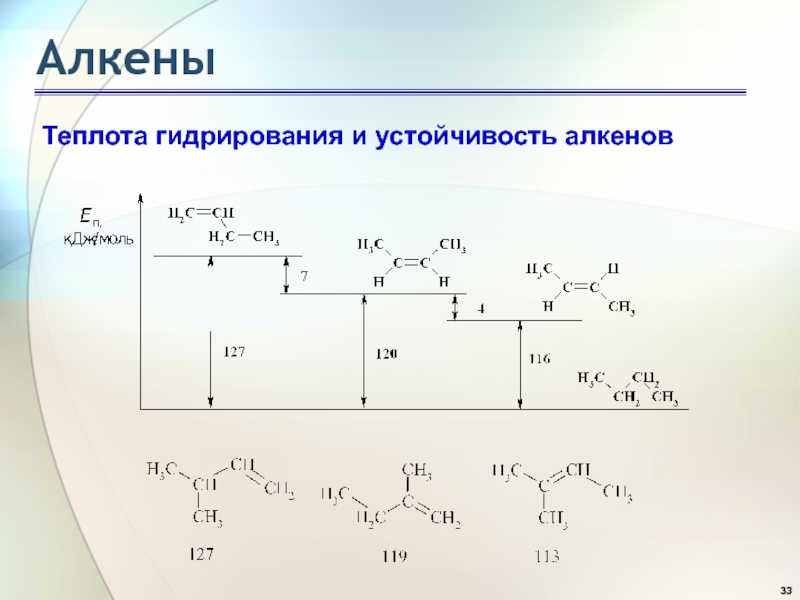
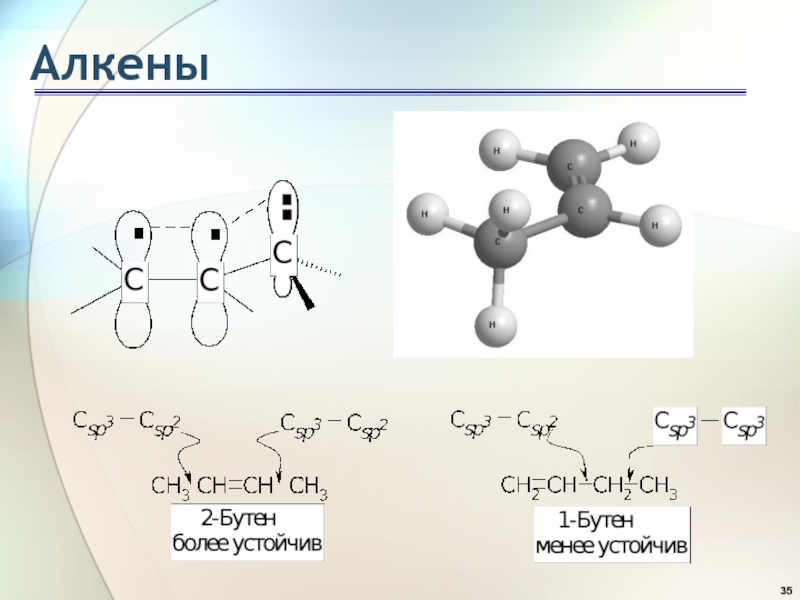
- 33. АлкеныТеплота гидрирования и устойчивость алкенов
- 34. АлкеныТеплота гидрирования и устойчивость алкенов Чем больше
- 35. Алкены
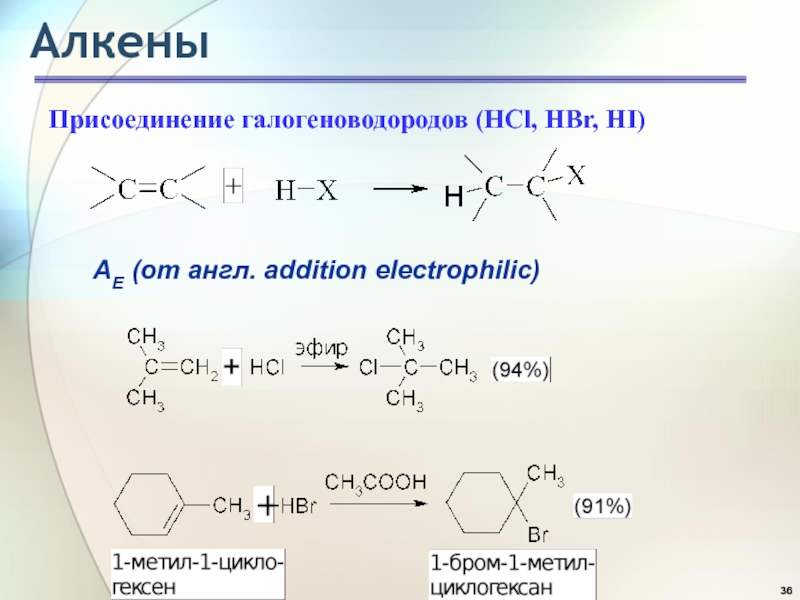
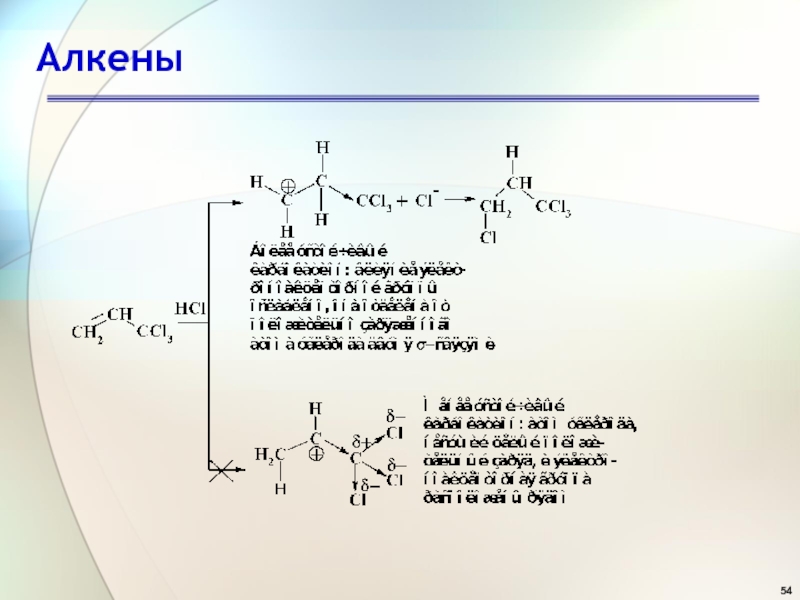
- 36. АлкеныПрисоединение галогеноводородов (HCl, HBr, HI)АE (от англ. addition electrophilic)
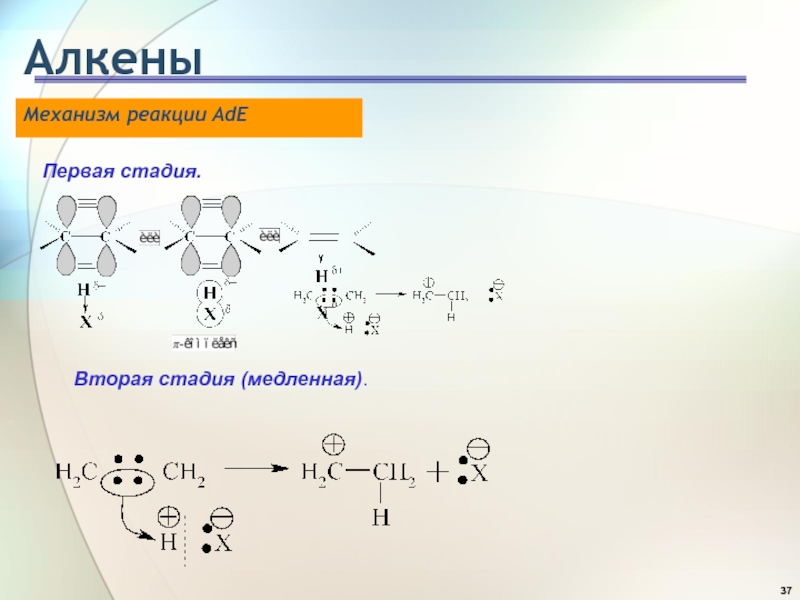
- 37. АлкеныМеханизм реакции AdE Первая стадия. Вторая стадия (медленная).
- 38. АлкеныМеханизм реакции AdE Третья стадия (быстрая). Порядок
- 39. АлкеныНаправление электрофильного присоединения1869 г. В. Марковников
- 40. АлкеныМАРКОВНИКОВ Владимир Васильевич13.12.1837 – 29.01.1904
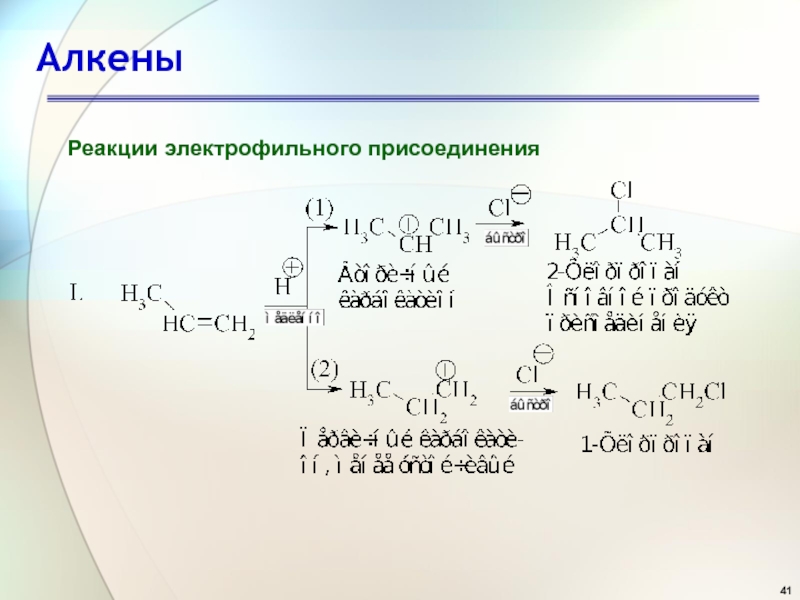
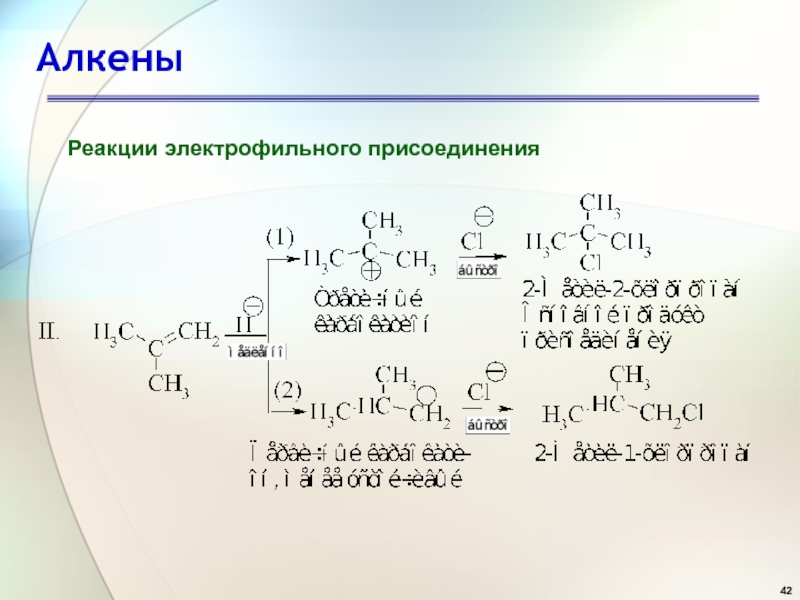
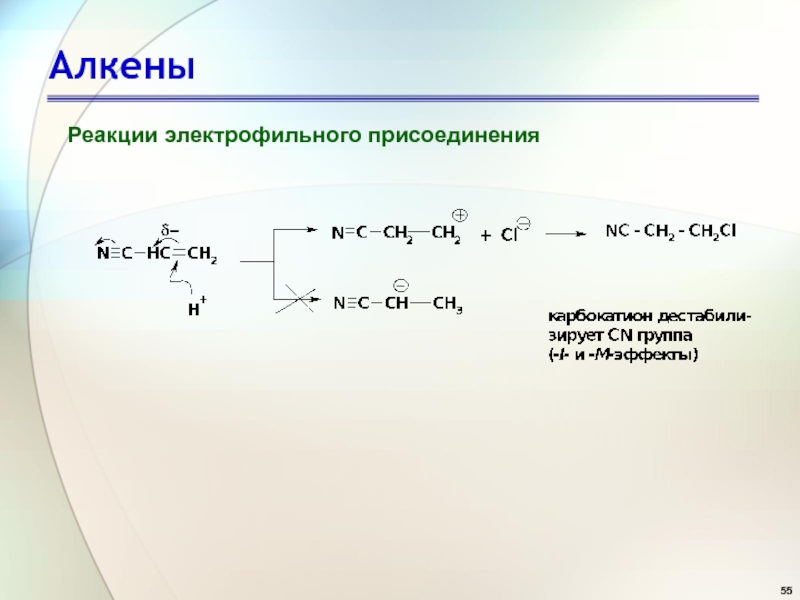
- 41. АлкеныРеакции электрофильного присоединения
- 42. АлкеныРеакции электрофильного присоединения
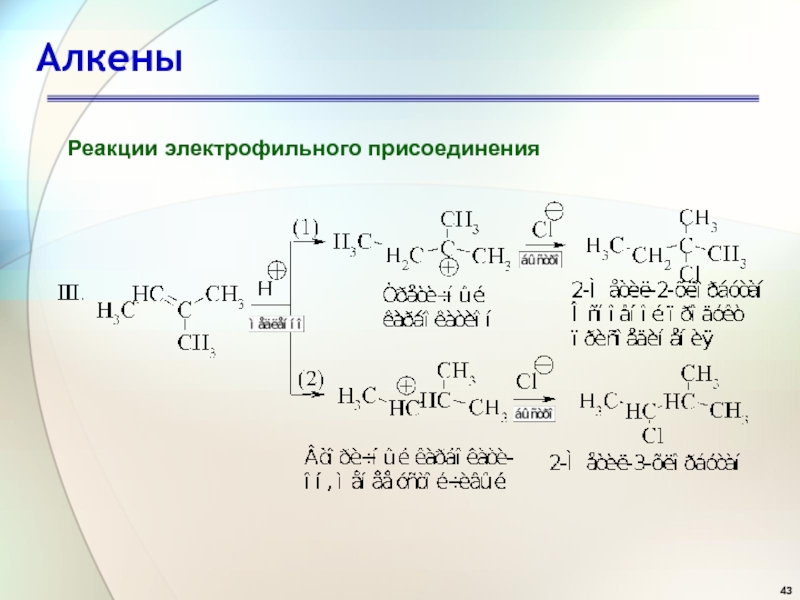
- 43. АлкеныРеакции электрофильного присоединения
- 44. АлкеныРеакции электрофильного присоединения Состав продуктов реакции показывает,
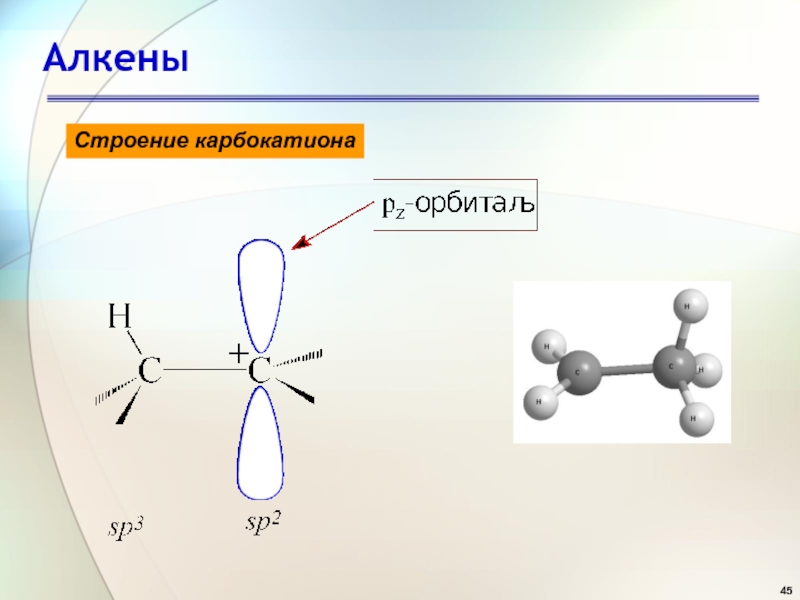
- 45. АлкеныСтроение карбокатиона
- 46. АлкеныРеакции электрофильного присоединения Подавая электроны на положительно
- 47. АлкеныРеакции электрофильного присоединения Устойчивость карбокатионов изменяется в таком же порядке, как и лёгкость их образования.
- 48. АлкеныРеакции электрофильного присоединения Современная трактовка правила Марковникова
- 49. АлкеныИндуктивный эффект – перераспределение электронной плотности внутри
- 50. АлкеныЗаместитель (Х), притягивающий электронную плотность σ-связи сильнее,
- 51. АлкеныЭффект, проявляющийся в смещении электронной плотности в
- 52. АлкеныВ отличие от индуктивного, мезомерный эффект передается
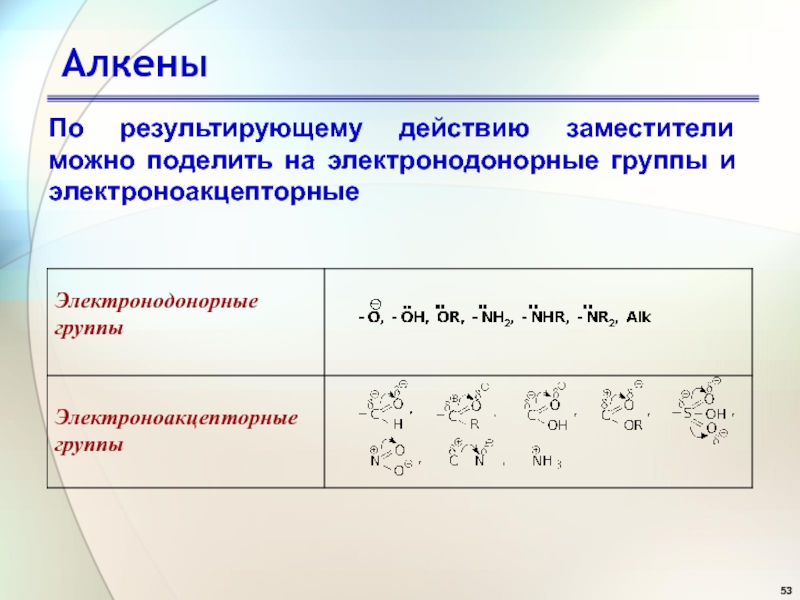
- 53. АлкеныПо результирующему действию заместители можно поделить на электронодонорные группы и электроноакцепторные
- 54. Алкены
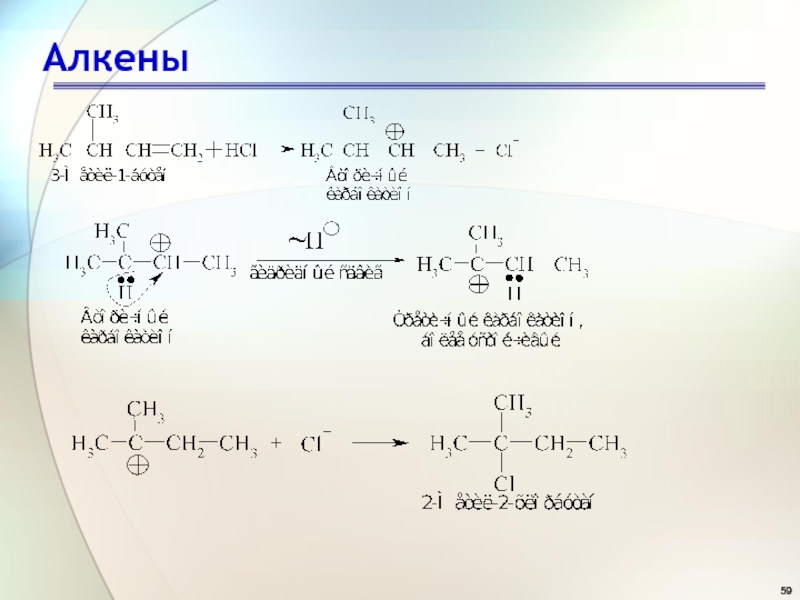
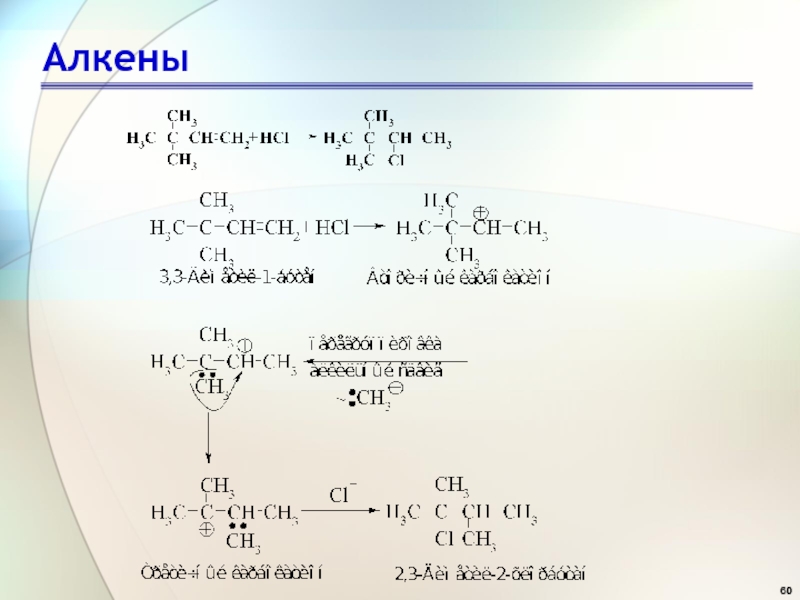
- 55. АлкеныРеакции электрофильного присоединения
- 56. АлкеныРеакционная способность и селективность Наиболее реакционноспособным должен быть алкен, дающий наиболее устойчивый карбокатион:
- 57. АлкеныРеакционная способность и селективность Влияние, которое повышает
- 58. АлкеныПерегруппировка
- 59. Алкены
- 60. Алкены
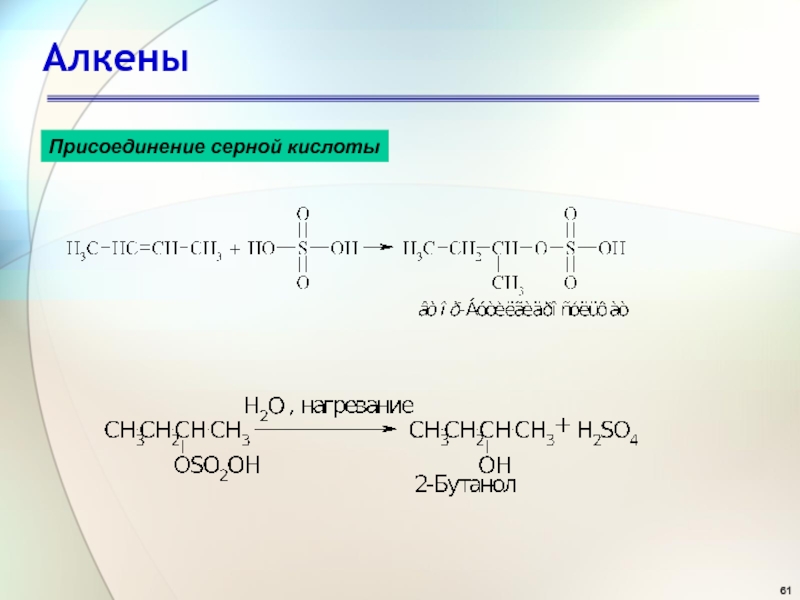
- 61. АлкеныПрисоединение серной кислоты
- 62. АлкеныМеханизм реакции AdE
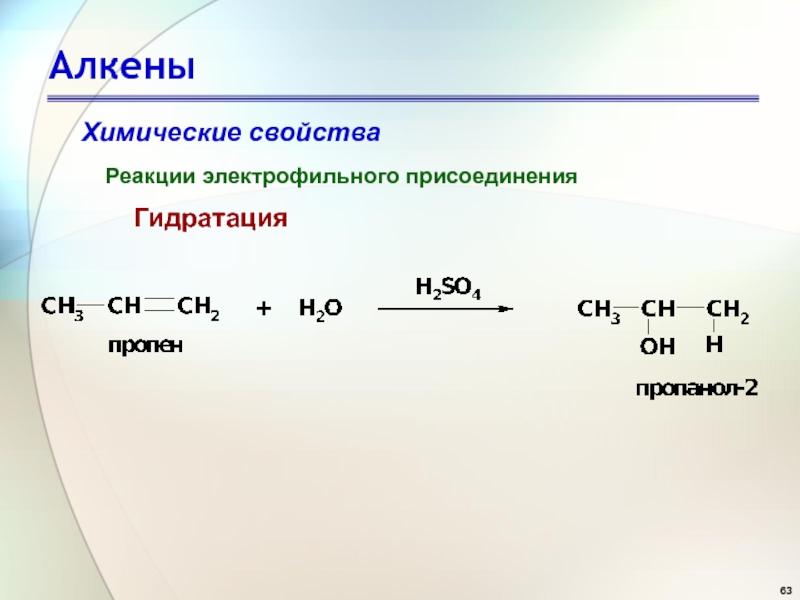
- 63. АлкеныХимические свойстваРеакции электрофильного присоединения Гидратация
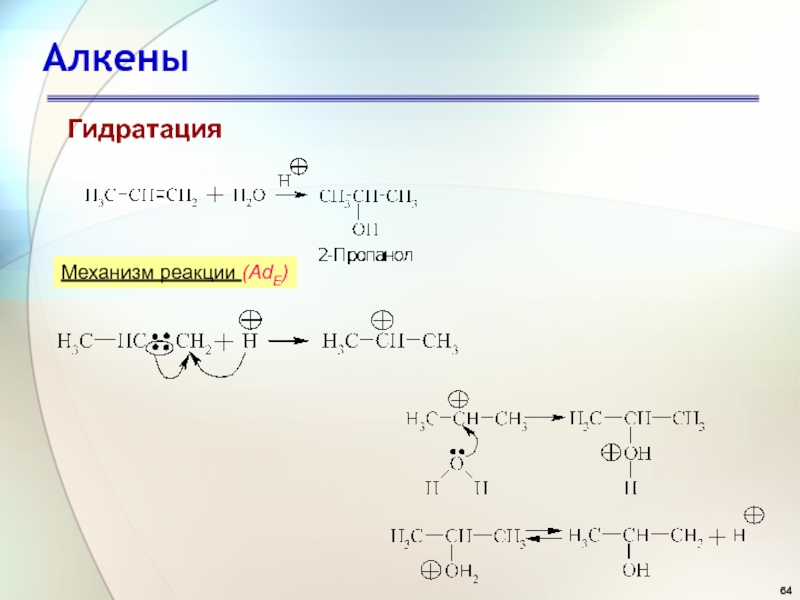
- 64. АлкеныГидратацияМеханизм реакции (AdE)
- 65. АлкеныСинтез простых эфиров
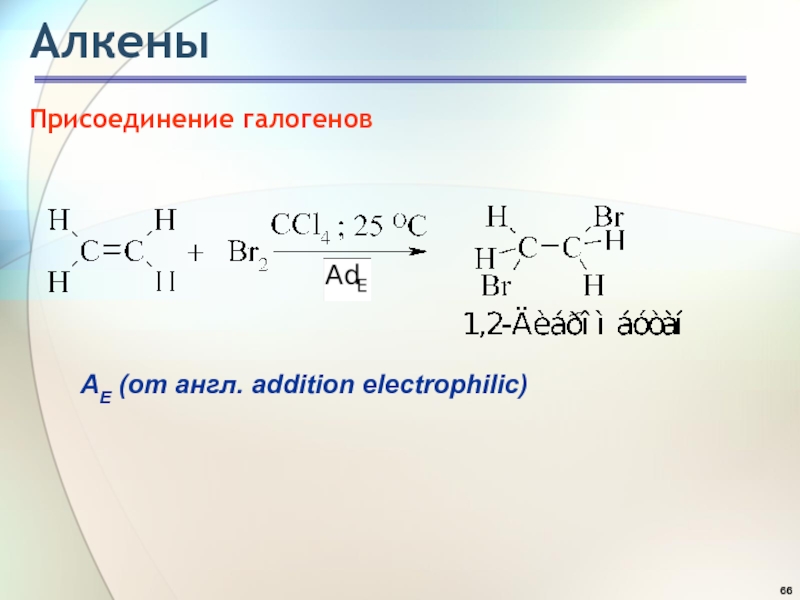
- 66. АлкеныПрисоединение галогеновАE (от англ. addition electrophilic)
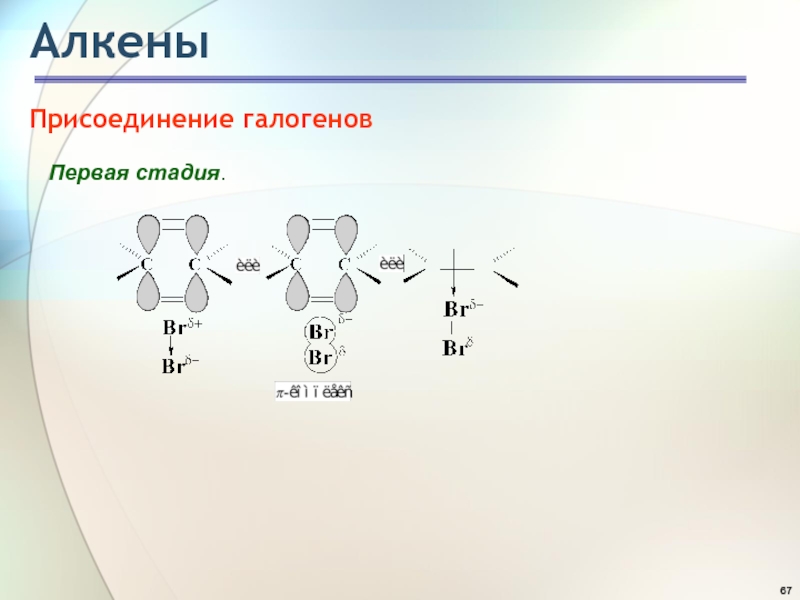
- 67. АлкеныПрисоединение галогеновПервая стадия.
- 68. Алкены
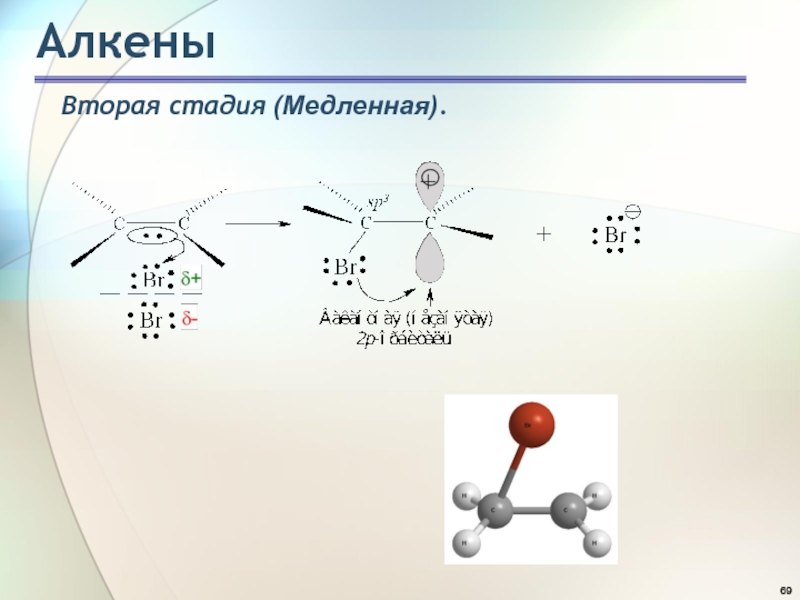
- 69. АлкеныВторая стадия (Медленная).
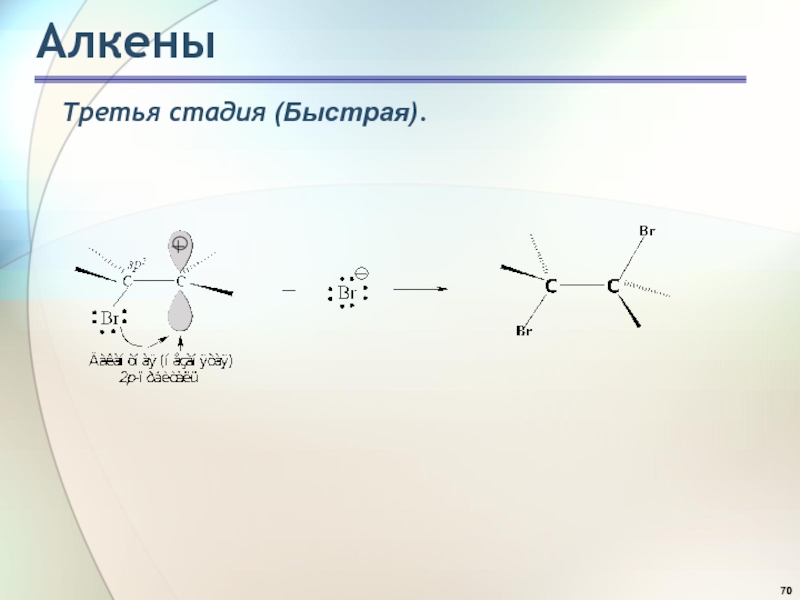
- 70. АлкеныТретья стадия (Быстрая).
- 71. АлкеныСопряженное присоединениеСтереоспецифическим называется процесс, в котором орбаразуется
- 72. АлкеныРеакционная способность галогенов в реакции АdЕ Присоединение
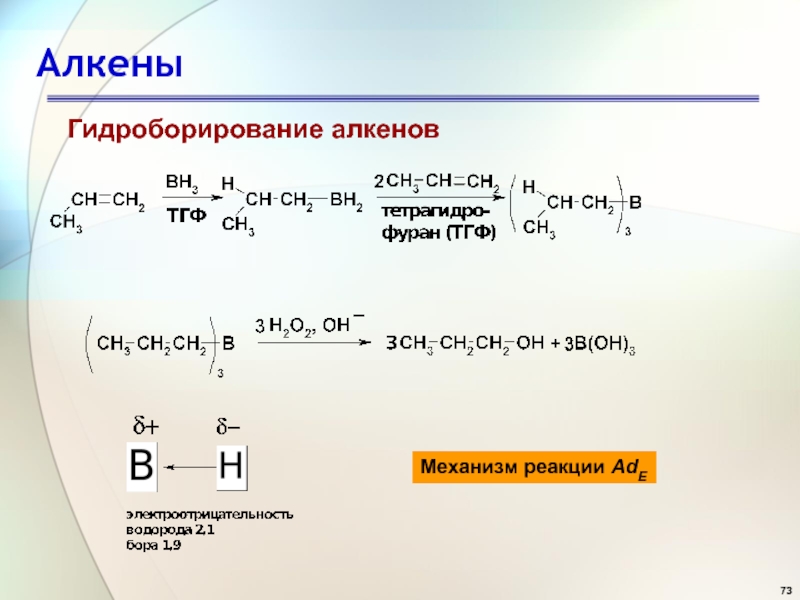
- 73. АлкеныГидроборирование алкеновМеханизм реакции AdE
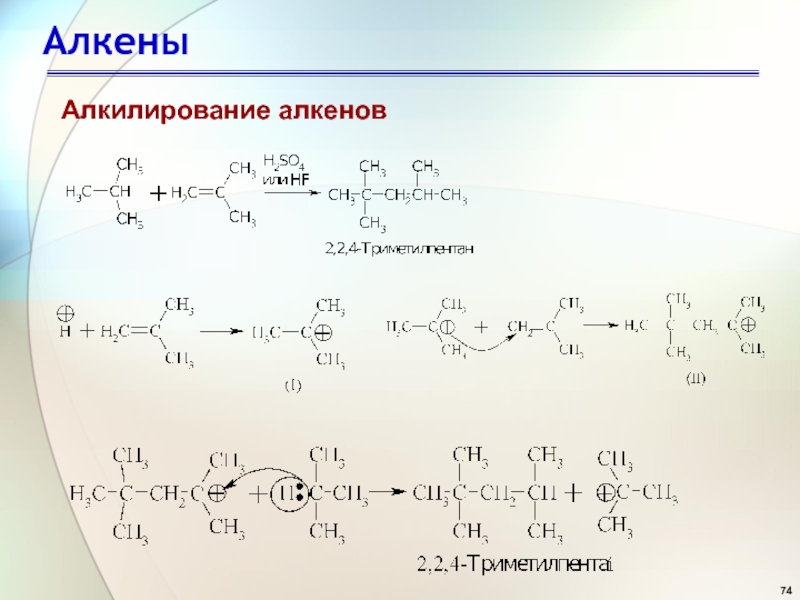
- 74. АлкеныАлкилирование алкенов
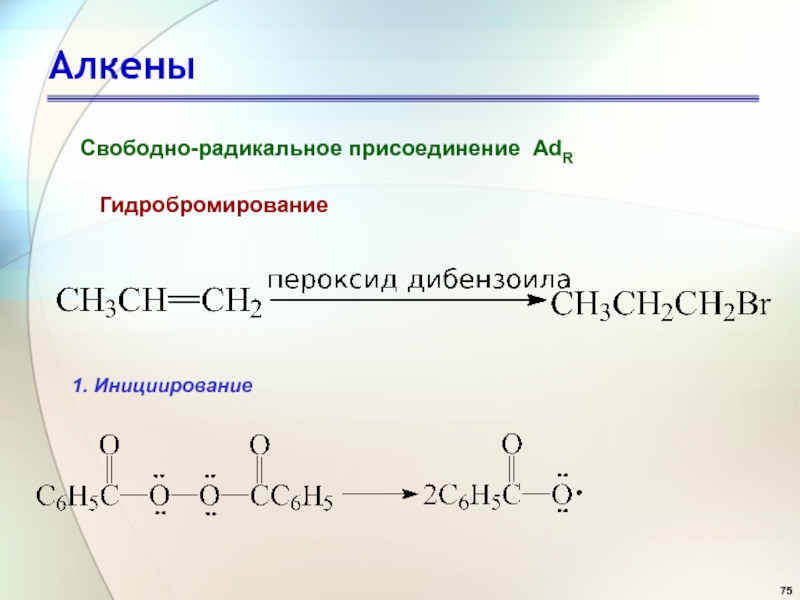
- 75. АлкеныСвободно-радикальное присоединение AdRГидробромирование1. Инициирование
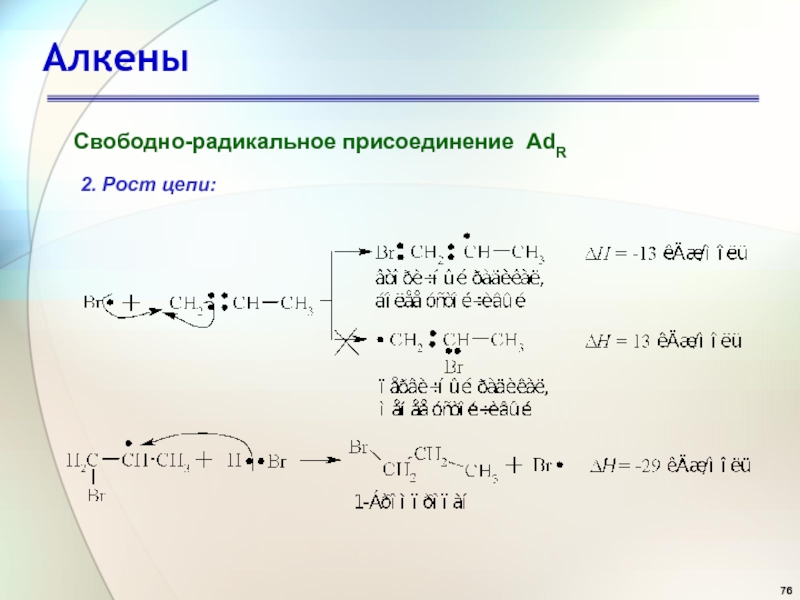
- 76. АлкеныСвободно-радикальное присоединение AdR2. Рост цепи:
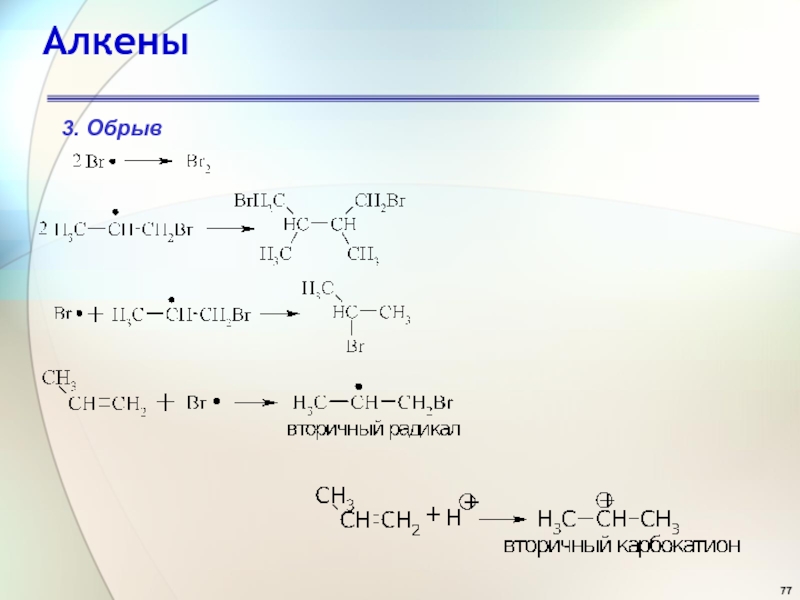
- 77. Алкены3. Обрыв
- 78. АлкеныСвободно-радикальное присоединениеПрисоединение HBr против правила Марковникова происходит
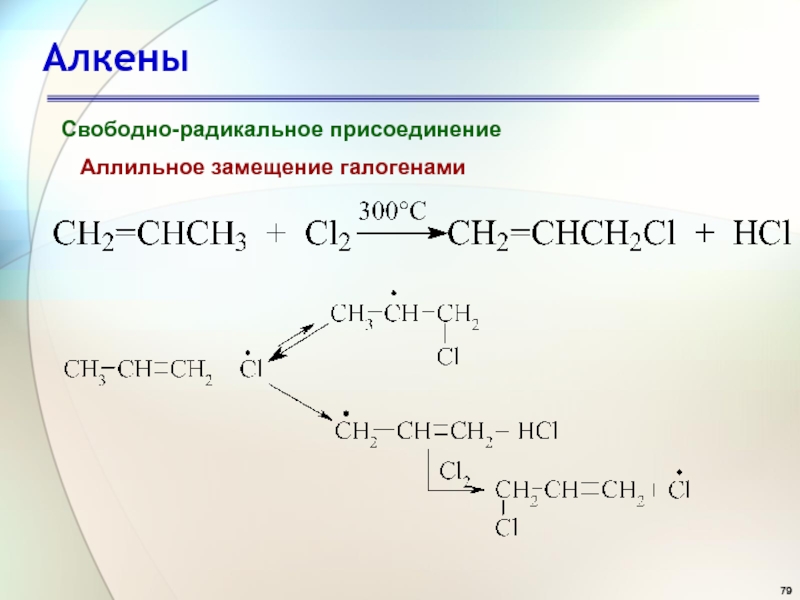
- 79. АлкеныСвободно-радикальное присоединениеАллильное замещение галогенами
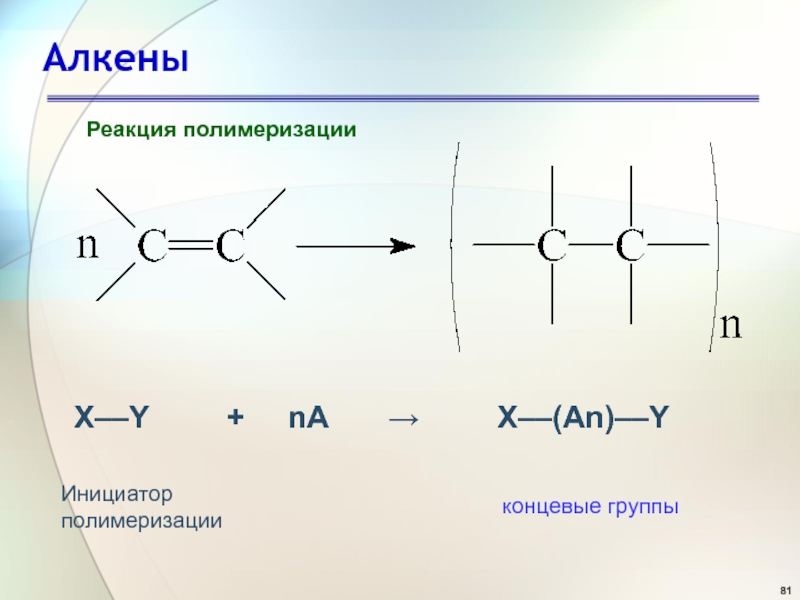
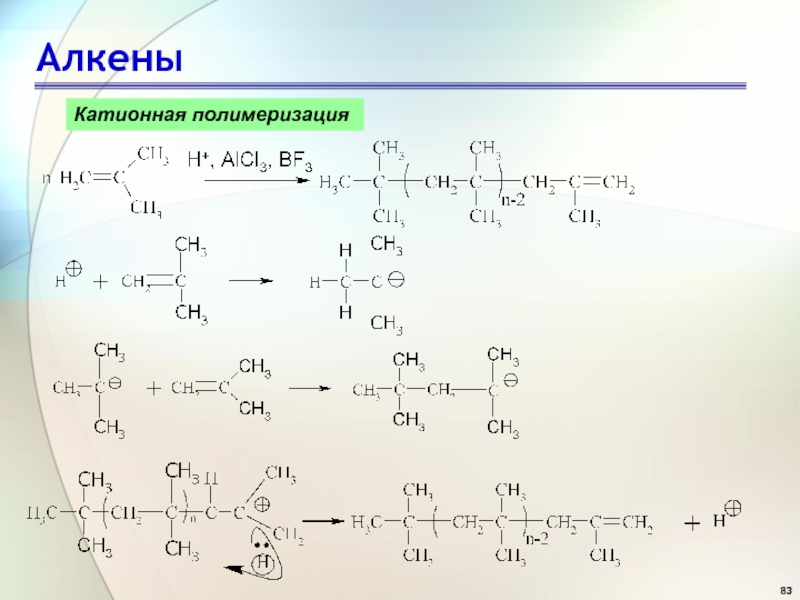
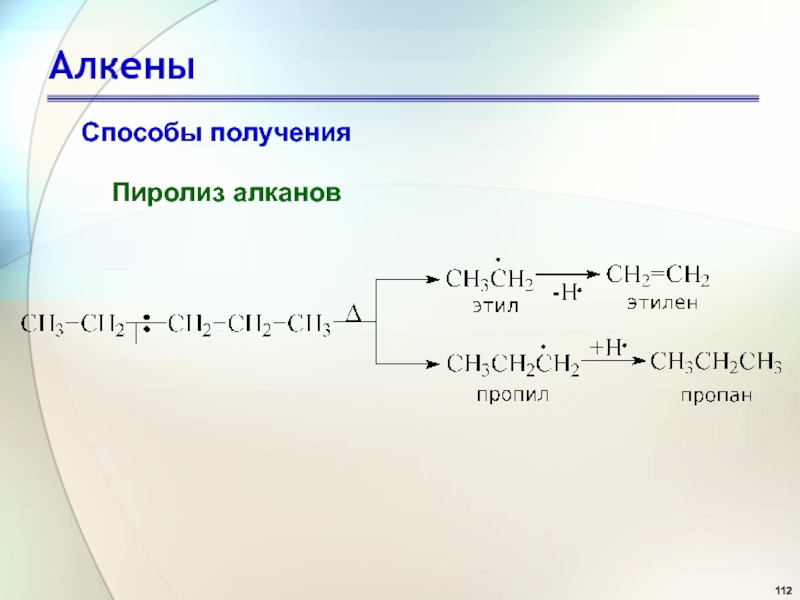
- 80. АлкеныРеакция полимеризацииПолимер - это макромолекула, состоящая из
- 81. АлкеныРеакция полимеризацииX––Y +
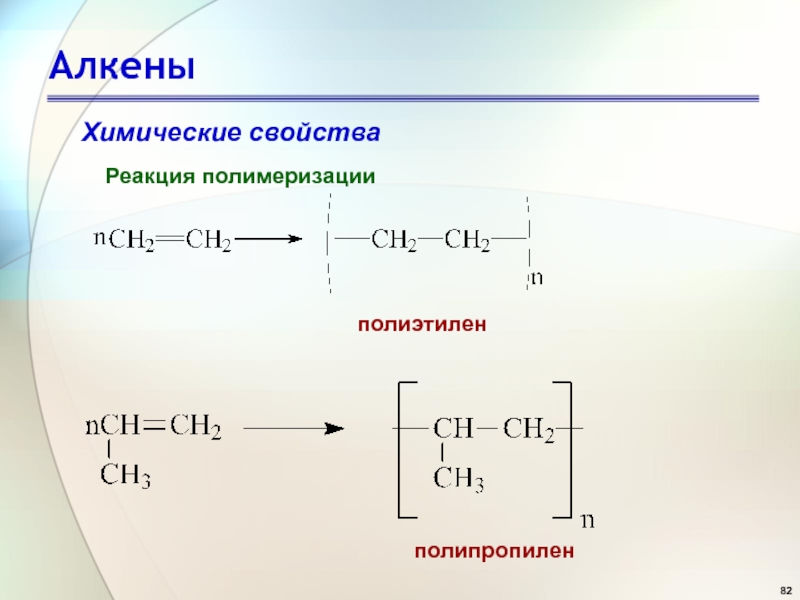
- 82. АлкеныХимические свойстваРеакция полимеризацииполиэтиленполипропилен
- 83. АлкеныКатионная полимеризация
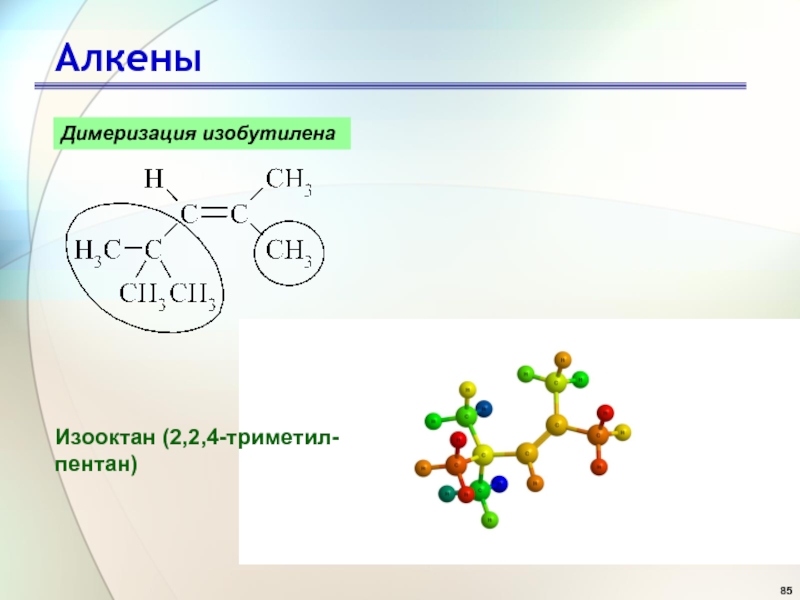
- 84. АлкеныДимеризация изобутилена
- 85. АлкеныДимеризация изобутилена Изооктан (2,2,4-триметил-пентан)
- 86. АлкеныАнионная полимеризация
- 87. АлкеныСвободнорадикальная полимеризация инициированиецепизарождениецепиростцепи
- 88. АлкеныСвободнорадикальная полимеризация обрыв цепирекомбинациядиспропорционирование
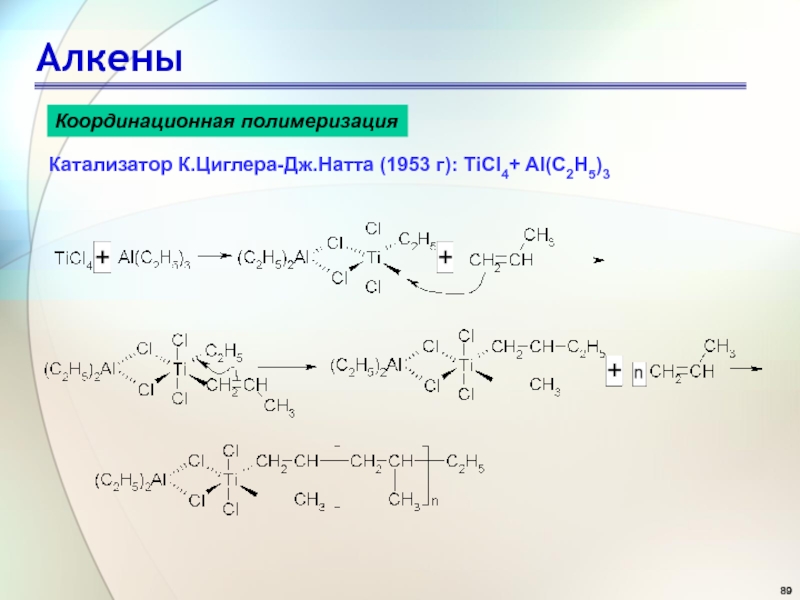
- 89. АлкеныКоординационная полимеризацияКатализатор К.Циглера-Дж.Натта (1953 г): TiCl4+ Al(C2H5)3
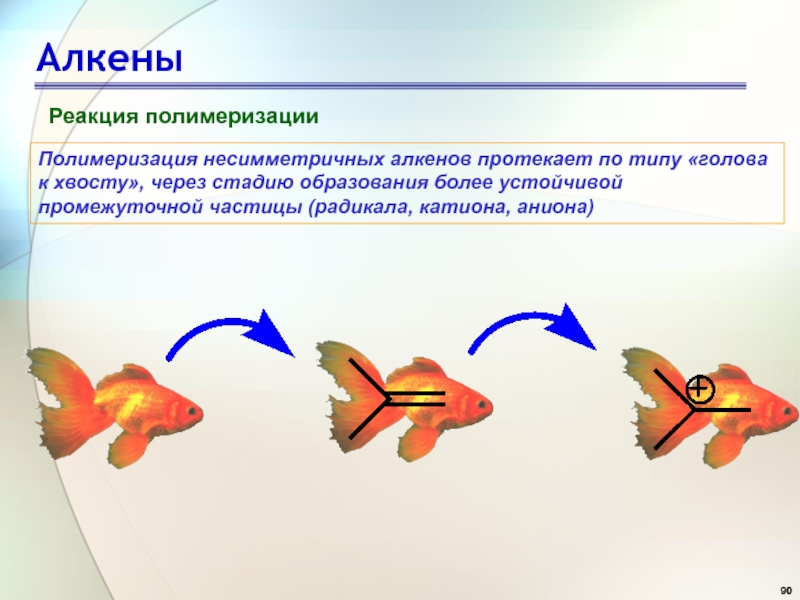
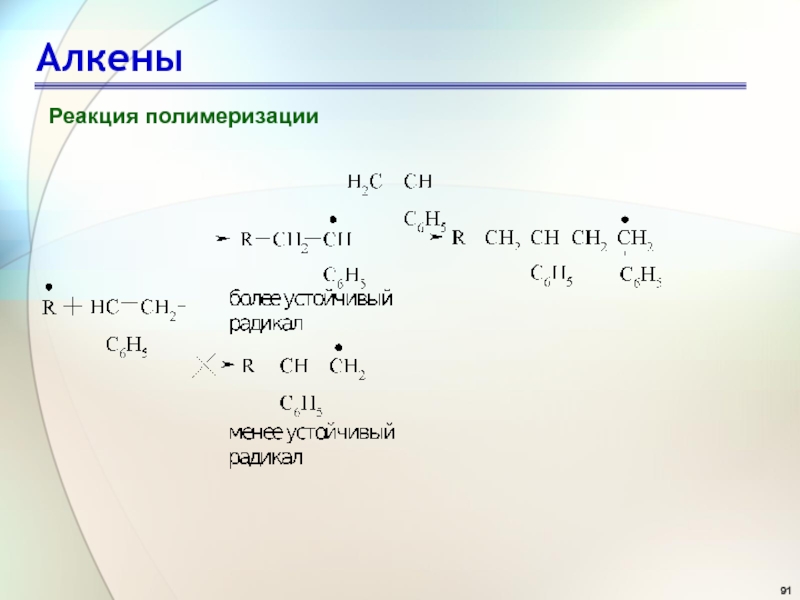
- 90. АлкеныРеакция полимеризацииПолимеризация несимметричных алкенов протекает по типу
- 91. АлкеныРеакция полимеризации
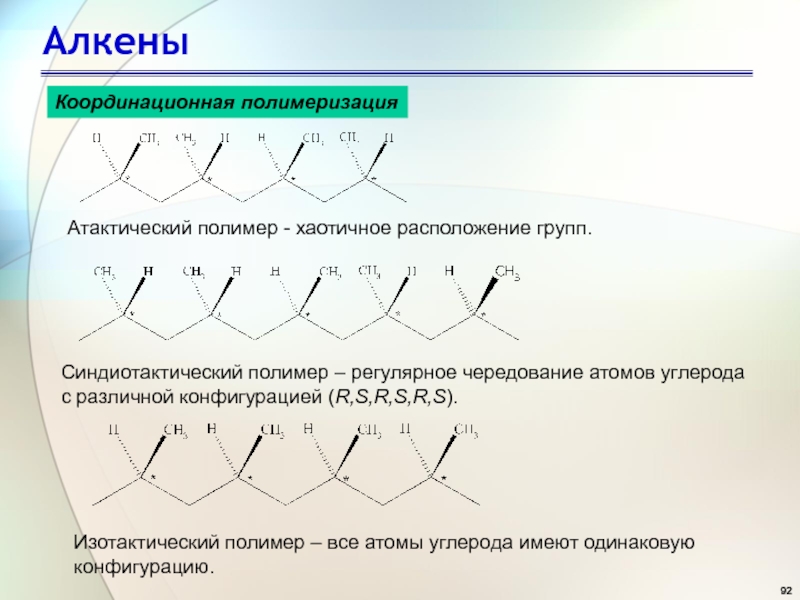
- 92. АлкеныКоординационная полимеризацияАтактический полимер - хаотичное расположение групп.Синдиотактический
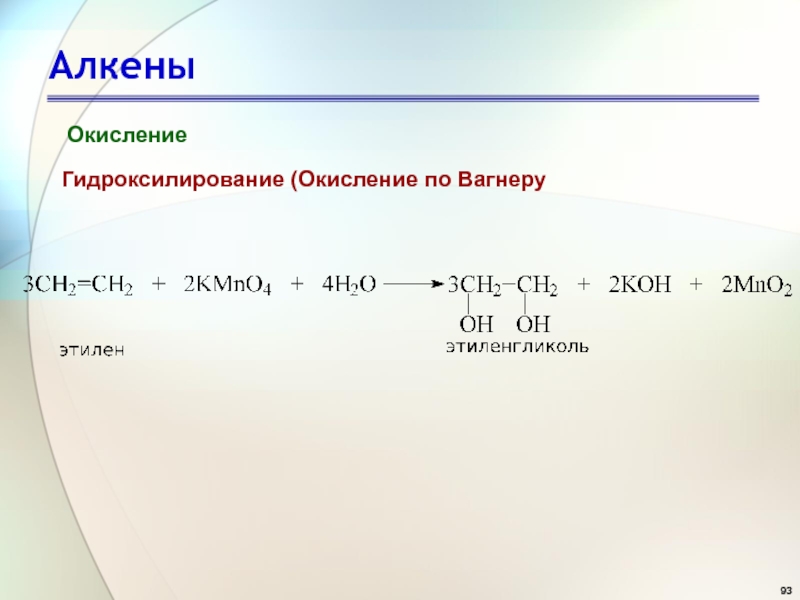
- 93. АлкеныОкислениеГидроксилирование (Окисление по Вагнеру
- 94. АлкеныВАГНЕР Егор Егорович (9.XII.1849 – 27.XI.1903)
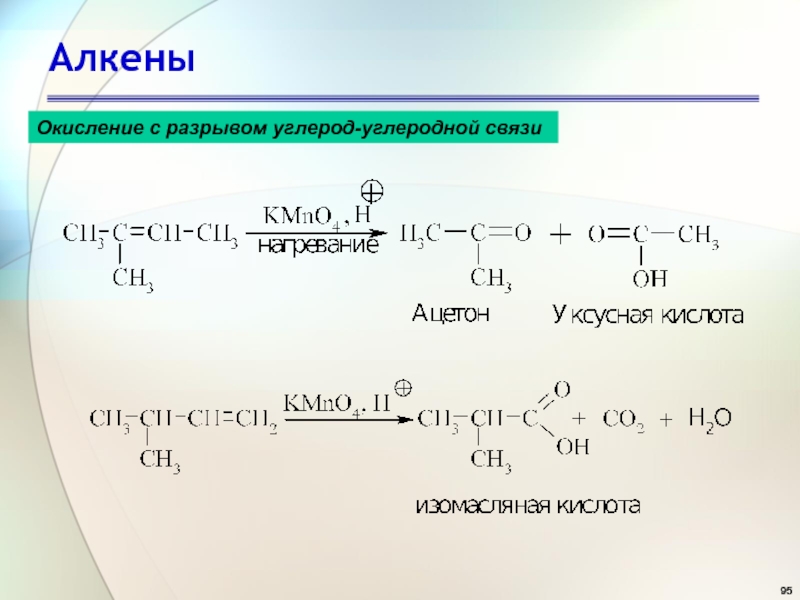
- 95. АлкеныОкисление с разрывом углерод-углеродной связи
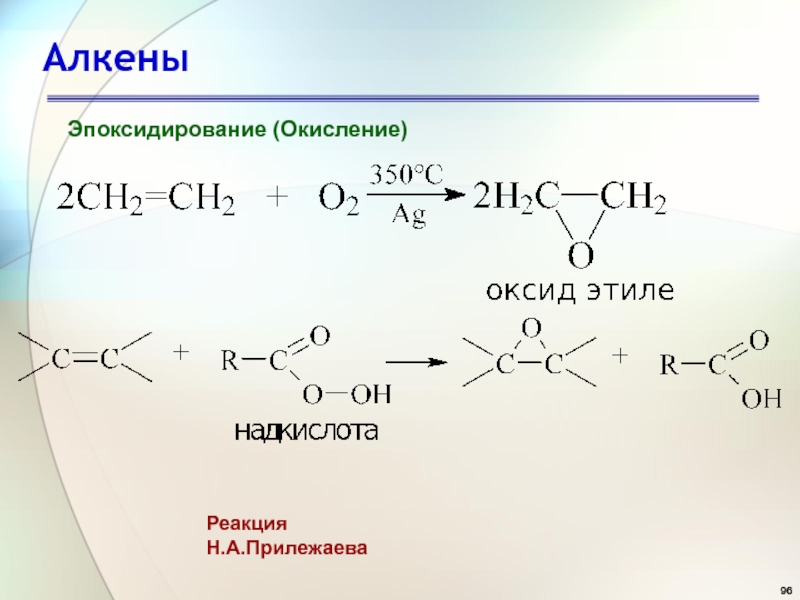
- 96. АлкеныЭпоксидирование (Окисление)Реакция Н.А.Прилежаева
- 97. АлкеныПрилежаев Николай Александрович (1872—1944)
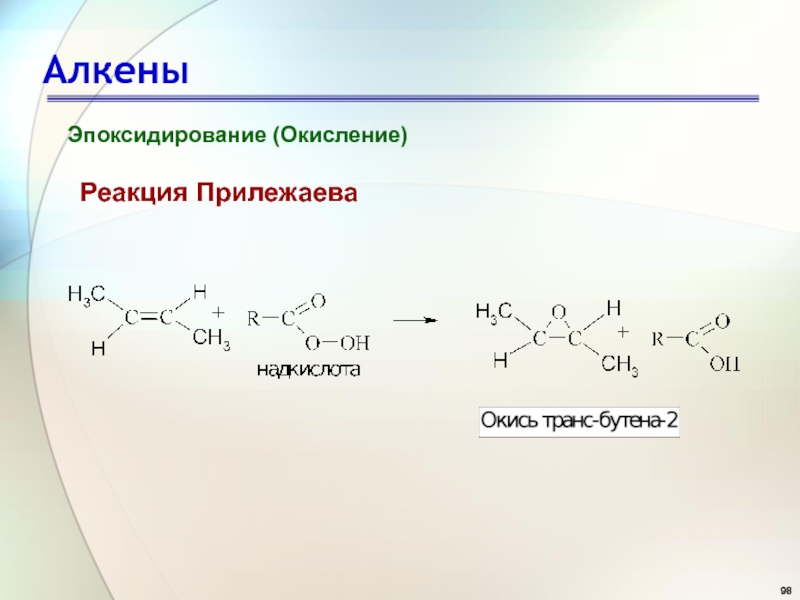
- 98. АлкеныРеакция ПрилежаеваЭпоксидирование (Окисление)
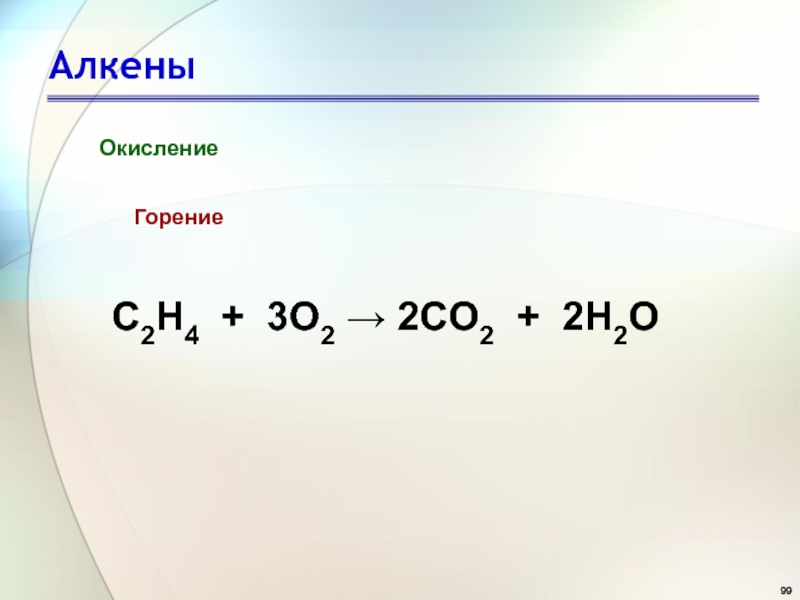
- 99. АлкеныОкислениеГорениеC2H4 + 3O2 → 2CO2 + 2H2O
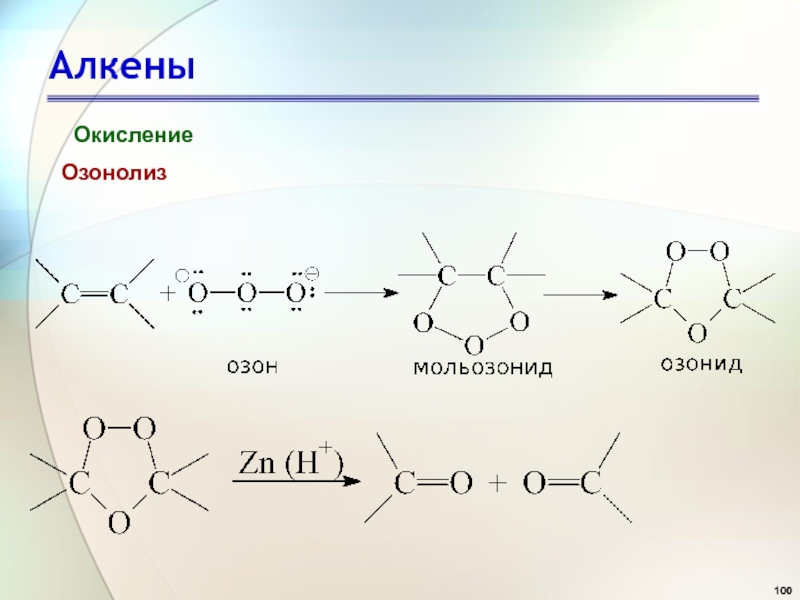
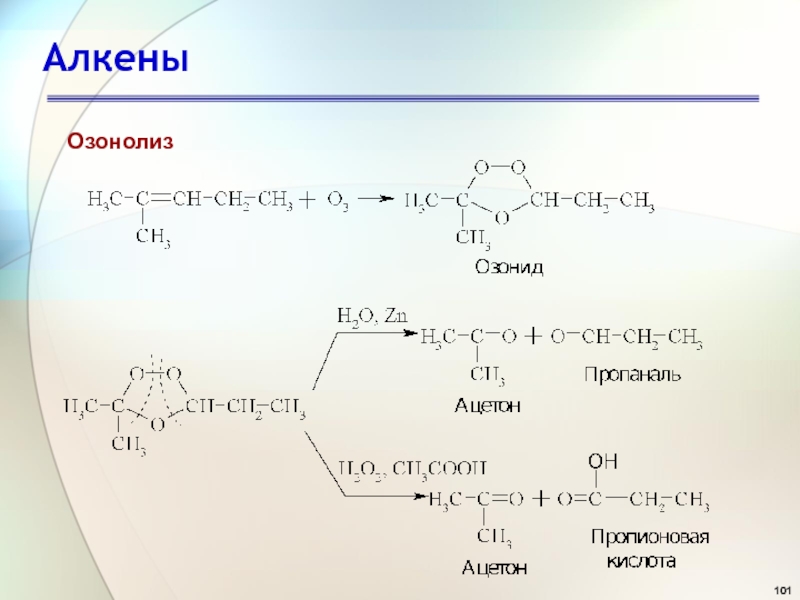
- 100. АлкеныОкислениеОзонолиз
- 101. АлкеныОзонолиз
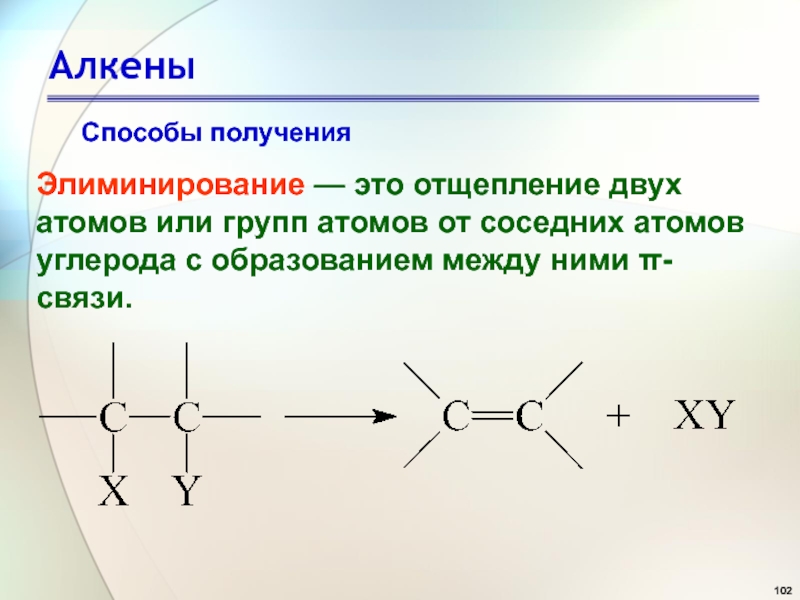
- 102. АлкеныЭлиминирование — это отщепление двух атомов или
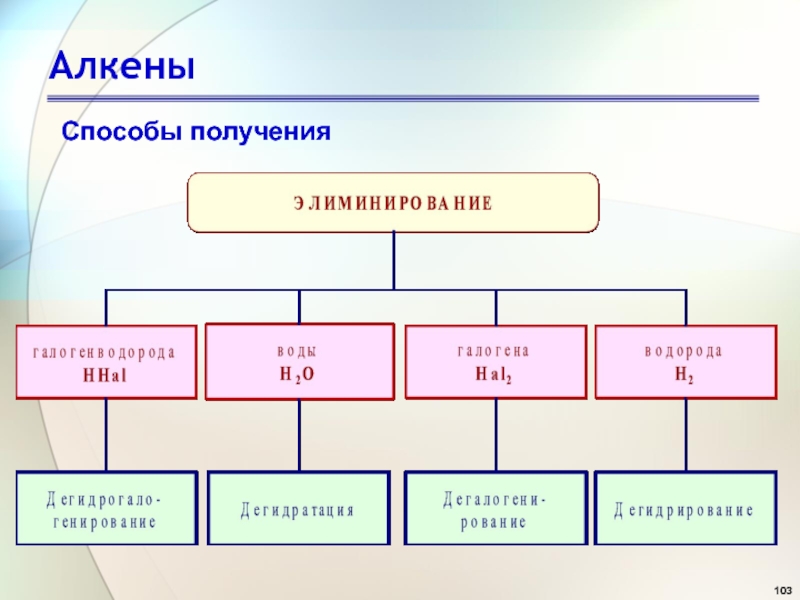
- 103. АлкеныСпособы получения
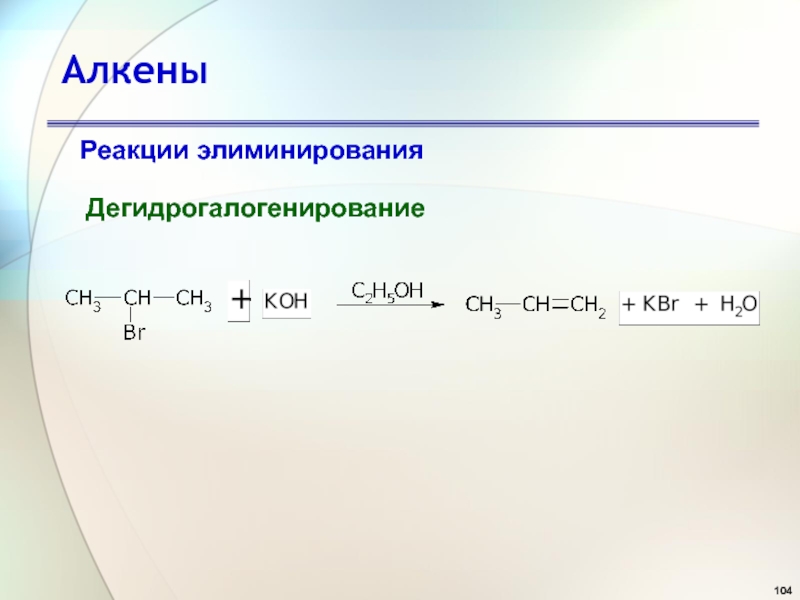
- 104. АлкеныРеакции элиминированияДегидрогалогенирование
- 105. АлкеныРеакции элиминированияДегидрогалогенирование Правило Зайцева
- 106. АлкеныРеакции элиминированияДегидрогалогенирование ЗАЙЦЕВ Александр Михайлович (Россия)(2.VII.1841 - 1.IX.1910)
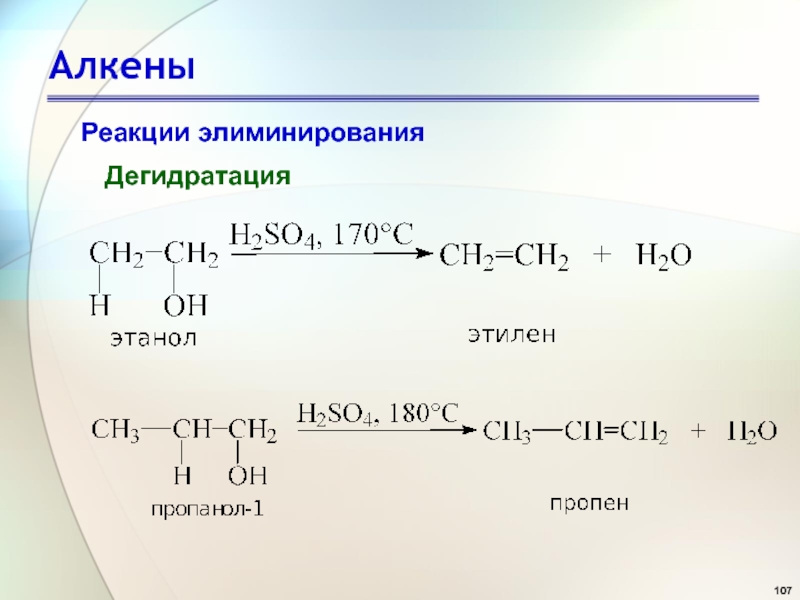
- 107. АлкеныРеакции элиминированияДегидратация
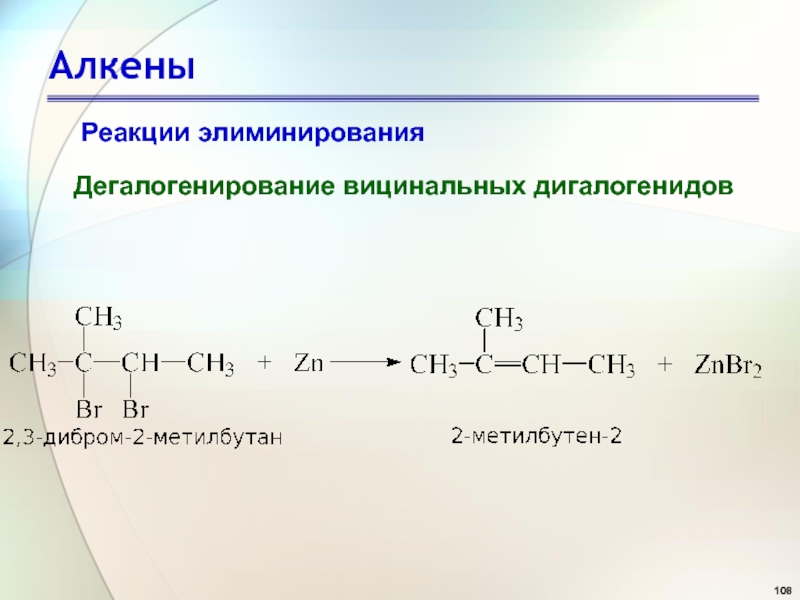
- 108. АлкеныРеакции элиминированияДегалогенирование вицинальных дигалогенидов
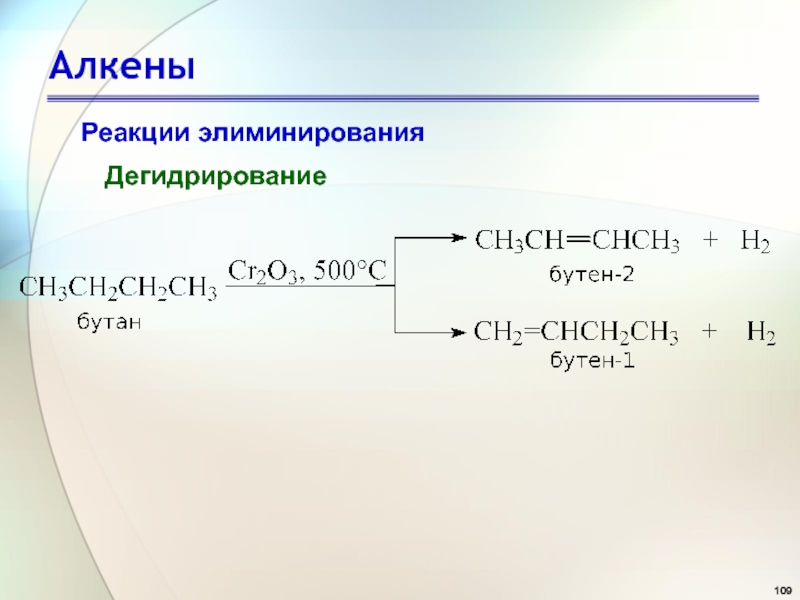
- 109. АлкеныРеакции элиминированияДегидрирование
- 110. АлкеныГидрирование алкинов
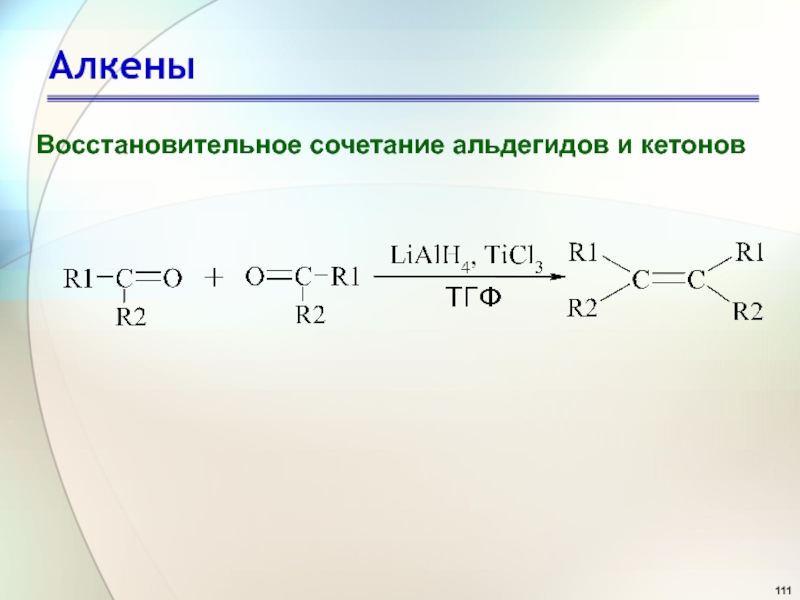
- 111. АлкеныВосстановительное сочетание альдегидов и кетонов
- 112. АлкеныСпособы полученияПиролиз алканов
- 113. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Алкены
Алкенами называются ненасыщенные углеводороды, молекулы которых содержат одну двойную связь.
Слайд 4Алкены
Номенклатура
1) в алкенах с неразветвленной цепью нумерацию производят с того
конца, ближе к которому находится двойная связь. В названии алкана,
соответствующего этой родоначальной структуре, суффикс -ан заменяется на –ен.Этен (этилен)
Пропен (пропилен)
гексен-2
Слайд 5Алкены
Номенклатура
2) в случае разветвления главной считается цепь, включающая двойную связь,
даже если эта цепь и не является самой длинной. Нумерация
производится таким образом, чтобы атом углерода, от которого начинается двойная связь, получил наименьший номер2-этилпентен-1
Слайд 6Алкены
Номенклатура
3) Углеводородные заместители обозначаются префиксом. Положение их указывается цифрой, соответствующей
номеру того атома углерода, у которого находится заместитель.
Заместители перечисляются
в алфавитном порядке. В случае нескольких одинаковых углеводородных заместителей перед их названием ставится умножительная приставка ди-, три- и т. д.Слайд 15Алкены
Номенклатура цис-, транс-изомеров
Система Кана–Ингольда–Прелога
Прелог Владимир
(23.07.1906–07.01.1998)
(Швейцария)
Ингольд Кристофер
(28.10.1893–8.10.1970)
(Великобритания)
Роберт Сидни Кан
(9.06.1899-15.09.1981)
(Великобритания)
?
Слайд 16Алкены
Номенклатура цис-, транс-изомеров
1. Используя систему Кана–Ингольда–Прелога, определяют сначала относительное
старшинство заместителей, связанных с двойной связью, и дают им номера
по старшинству 1 или 2.2. Если две наиболее старшие группы расположены по одну сторону от плоскости π-связи, то конфигурация заместителей обозначается символом Z, если же эти группы находятся по разные стороны от плоскости π-связи, то конфигурация обозначается символом Е.
Слайд 18Алкены
Номенклатура цис-, транс-изомеров
(Е)-1-бром-1-нитро-
2-хлорпропен
(Z)-1-бром-1-нитро-
2-хлорпропен
Слайд 23Алкены
π-Связь делает невозможным вращение вокруг связи углерод-углерод; с этим связано
явление геометрической изомерии. Таким образом, двойная углерод-углеродная связь построена из
более прочной σ-связи (347 кДж/моль ) и менее прочной π-связи (264 кДж/моль ). Двойная углерод-углеродная связь в этилене короче, чем простая связь в этане.Слайд 24Алкены
σ-связь (347 кДж/моль)
π-связь (264 кДж/моль)
Химические свойства
Двойная углерод-углеродная связь
в этилене короче, чем простая связь в этане.
Слайд 25Алкены
Химические свойства
Расстояние С-Н в этилене равно 0,109 нм, что
меньше, чем расстояние С-Н в этане (0,110 нм). Гибридизация атомов
углерода в этих соединениях неодинакова. По сравнению с sp3- орбиталью, sp2-орбиталь имеет меньшую долю p-орбитали и большую долю s-орбитали. p-Орбиталь находится на большем расстоянии от ядра, чем s- орбиталь. По мере возрастания s-характера гибридной орбитали её эффективный размер уменьшается и одновременно уменьшается длина связи с другим атомом.Слайд 26Алкены
Химические свойства
Чем больше доля s-состояния в гибридной орбитали атома
углерода, тем более электроотрицательным он будет
50 %
33 % 25 %
Слайд 27Алкены
Типичными реакциями двойной связи являются реакции, в которых происходит разрыв
π-связи и образование вместо нее двух более прочных σ -связей.
Такие реакции называются реакциями присоединения. Они обозначаются символом Аd (Addition - присоединение).Химические свойства
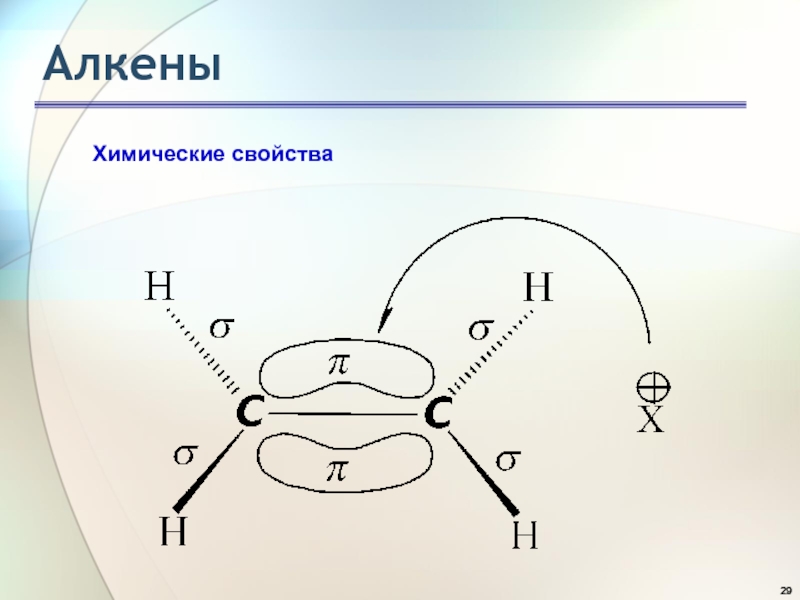
Слайд 28Алкены
Облака π-электронов находятся над и под плоскостью, в которой лежат
атомы углерода и водорода. Двойная углерод-углеродная связь служит донором электронов,
т.е. ведет себя как основание (По Льюису, основание - соединение, предоставляющее пару электронов для образования связи, донор пары электронов; кислота - акцептор пары электронов).Она реагирует с соединениями, которые обеднены электронами, т.е. с кислотами (по Льюису). Эти реагенты, не имеющие пары электронов, называются электрофильными реагентами (электрофил - любящий электроны). Следовательно, типичными реакциями алкенов являются реакции электрофильного присоединения (AdE).
Химические свойства
Слайд 30Алкены
Существуют реагенты другого типа, также обедненные электронами, - свободные радикалы.
С ними алкены вступают в реакции радикального присоединения (AdR) .
Большинство
алкенов содержит алкильные группы, которые являются остатками алканов, следовательно, такие алкены могут подобно алканам участвовать в реакциях свободнорадикального замещения атома водорода в алкильном остатке (SR).Химические свойства
Слайд 32Алкены
Гидрирование этена
С*, H* - атомы углерода и водорода, активированные
на
поверхности катализатора
Слайд 34Алкены
Теплота гидрирования и устойчивость алкенов
Чем больше степень алкилирования атомов
углерода при двойной связи, тем более устойчив алкен:
Слайд 38Алкены
Механизм реакции AdE
Третья стадия (быстрая).
Порядок увеличения реакционной способности
галогеноводородов
по отношению к алкенам совпадает с порядком увеличения их
кислотности: HF << HCI < HBr < HI.
Слайд 44Алкены
Реакции электрофильного присоединения
Состав продуктов реакции показывает, что в первой
стадии вторичный карбокатион образуется быстрее, чем первичный по реакции 1,
а третичный - быстрее, чем первичный и вторичный, как следует из реакций II и III.Слайд 46Алкены
Реакции электрофильного присоединения
Подавая электроны на положительно заряженный атом углерода,
алкильная группа в какой-то степени уменьшает его ⊕-заряд, сама при
этом приобретает некоторый положительный заряд. В третичном карбокатионе положительный заряд распределен между третичным углеродом и тремя алкильными группами, поэтому третичный карбокатион наиболее устойчив. Наоборот, метильный - наименее устойчив, т.к. в нем заряд локализован на одном атоме углерода.Слайд 47Алкены
Реакции электрофильного присоединения
Устойчивость карбокатионов изменяется в таком же порядке,
как и лёгкость их образования.
Слайд 49Алкены
Индуктивный эффект – перераспределение электронной плотности внутри σ-связей, которое возникает
вследствие разности величин электроотрицательности атомов, участвующих в этих связях.
Слайд 50Алкены
Заместитель (Х), притягивающий электронную плотность σ-связи сильнее, чем атом водорода,
проявляет отрицательный индуктивный эффект (-I). Такие заместители в целом снижают
электронную плотность системы и их называют электроноакцепторными (галогены, ОН, NO2, СООН, катионы и др.).Если заместитель (Y) по сравнению с атомом водорода смещает электронную плотность σ-связи в сторону атома углерода цепи, то он проявляет положительный индуктивный эффект (+I). Такие заместители ведут к повышению электронной плотности в цепи и называются электронодонорными. К их числу относятся алкильные группы, металлы и анионы.
Слайд 51Алкены
Эффект, проявляющийся в смещении электронной плотности в ненасыщенных и, особенно,
в сопряженных системах называют мезомерным (М-эффектом) или эффектом сопряжения.
Он
обусловлен смещением π-электронов сопряженных связей или неподеленных пар в сторону атомов с недостроенной до октета электронной оболочкой. Электронное смещение (обозначается изогнутой стрелкой) приводит к появлению частичных зарядов на концах сопряженной цепи. Слайд 52Алкены
В отличие от индуктивного, мезомерный эффект передается по системе сопряженных
связей на значительно большее расстояние. Заместители, способные к эффекту сопряжения,
одновременно проявляют и индуктивный эффект.При этом М- и I-эффекты могут иметь как одинаковое, так и противоположное направление. При оценке влияния заместителей на распределение электронной плотности надо учитывать результирующее действие индуктивного и мезомерного эффектов
Слайд 53Алкены
По результирующему действию заместители можно поделить на электронодонорные группы и
электроноакцепторные
Слайд 56Алкены
Реакционная способность и селективность
Наиболее реакционноспособным должен быть алкен,
дающий
наиболее устойчивый карбокатион:
Слайд 57Алкены
Реакционная способность и селективность
Влияние, которое повышает электронную плотность двойной
связи, будет увеличивать ее реакционную способность, тогда как влияние понижающее
электронную плотность, будет уменьшать реакционную способность.Виниловые эфиры CH2=CHOR присоединяют НХ (X=Hal) по правилу Марковникова с гораздо большей скоростью, чем все перечисленные выше замещенные алкены.
Это связано со значительным +М-эффектом RО-группы. В отличие от нитрогруппы, RО-группа по суммарному электронному эффекту (+М > -I) является сильным электронодонорным заместителем, эффективно стабилизирующим соседний карбокатионный центр.
Слайд 71Алкены
Сопряженное присоединение
Стереоспецифическим называется процесс, в котором орбаразуется только один из
возможных стереоизомеров.
Стереоселективным называется процесс, в котором преимущественно образуется один стереоизомер.
Слайд 72Алкены
Реакционная способность галогенов в реакции АdЕ
Присоединение хлора и брома
к алкенам происходит легко и во многих случаях с количественным
выходом. Присоединения йода к алкенам осуществить не удается. Взаимодействие фтора с алкенами происходит так энергично, что углеводород распадается на осколки с меньшим числом атомов углерода.I2 << Br2 < Cl2 < F2
Слайд 78Алкены
Свободно-радикальное присоединение
Присоединение HBr против правила Марковникова происходит следующим образом: Br∙
(а не Н∙) реагирует в первую очередь с π-системой и
быстрее всего образуется наиболее стабильный радикал.Независимо от механизма реакции в медленной стадии из двух возможных промежуточных частиц более устойчивая образуется быстрее.
Эффект Хараша, 1929 г.
Слайд 80Алкены
Реакция полимеризации
Полимер - это макромолекула, состоящая из очень большого числа
повторяющихся звеньев.
Он образуется путем последовательного присоединения малых молекул, называемых
мономерами.Полимер, получаемый из одинаковых мономеров,
называется гомополимером, Полимер, получаемый из двух различных мономеров – сополимером или гетерополимером.
Слайд 89Алкены
Координационная полимеризация
Катализатор К.Циглера-Дж.Натта (1953 г): TiCl4+ Al(C2H5)3
Слайд 90Алкены
Реакция полимеризации
Полимеризация несимметричных алкенов протекает по типу «голова к хвосту»,
через стадию образования более устойчивой промежуточной частицы (радикала, катиона, аниона)
Слайд 92Алкены
Координационная полимеризация
Атактический полимер - хаотичное расположение групп.
Синдиотактический полимер – регулярное
чередование атомов углерода
с различной конфигурацией (R,S,R,S,R,S).
Изотактический полимер – все атомы
углерода имеют одинаковуюконфигурацию.