Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
АРЕНЫ (ароматические углеводороды)
Содержание
- 1. АРЕНЫ (ароматические углеводороды)
- 2. Простейшие представители (одноядерные арены): Многоядерные арены: нафталин
- 3. Простейший представитель аренов – бензол С6Н6 выделен
- 4. Строение бензолаАтомы С в бензоле находится в
- 5. Все связи С – С в бензоле
- 6. Гомологический ряд бензола Гомологи бензола – соединения, образованные
- 7. Номенклатура ареновСистематические названия строят из названия углеводородного
- 8. Для дизамещенных бензолов R-C6H4-R используется также и
- 9. Изомерия ареновСтруктурная изомерия Изомерия положения заместителей для
- 10. Физические свойства аренов Бензол и его ближайшие гомологи
- 11. Химические свойства ареновПо химическим свойствам арены отличаются
- 12. Реакции замещения в бензольном кольце1. Галогенирование: Замещение
- 13. 2. Нитрование: Бензол реагирует с нитрующей смесью (смесью концентрированных азотной и серной кислот):
- 14. 3. Алкилирование: Замещение атома Н в бензольном
- 15. Замещение в алкилбензолах При нитровании толуола С6Н5CH3
- 16. Под влиянием бензольного кольца метильная группа СH3
- 17. Реакции присоединения к аренамГидрирование Присоединение Н2
- 18. Реакции окисления ареновПри действии раствора KMnO4 в
- 19. Получение аренова) дегидроциклизация алканов, содержащих в основной
- 20. Тримеризация алкинов над активированным углем (реакция Зелинского):Гомологи
- 21. Применение ареновБензол С6Н6 используется как исходный продукт
- 22. Домашнее задание по теме «Арены. Химические свойства
- 23. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1АРЕНЫ
(ароматические углеводороды)
- это соединения, молекулы которых содержат устойчивые циклические
группы атомов (бензольные ядра) с замкнутой системой сопряженных связей
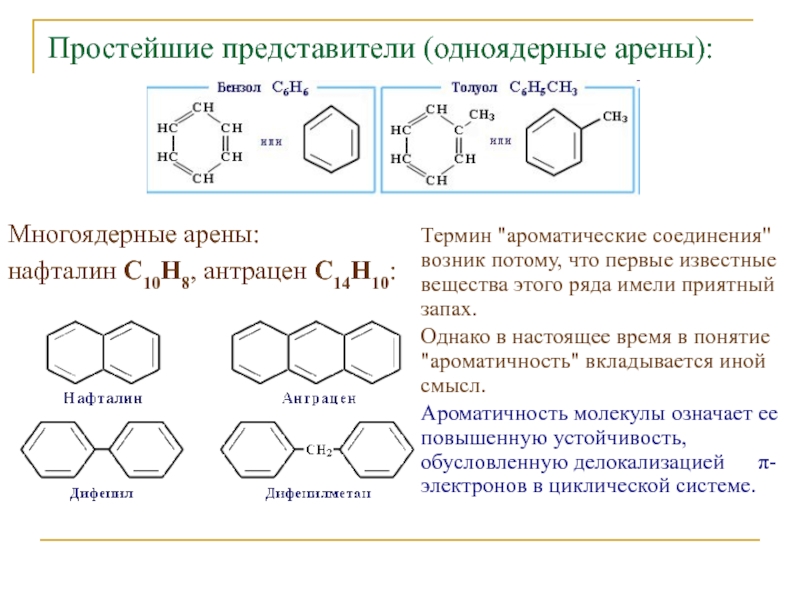
Слайд 2Простейшие представители (одноядерные арены):
Многоядерные арены:
нафталин С10Н8, антрацен С14Н10:
Термин "ароматические соединения" возник потому, что первые известные вещества этого
ряда имели приятный запах.Однако в настоящее время в понятие "ароматичность" вкладывается иной смысл.
Ароматичность молекулы означает ее повышенную устойчивость, обусловленную делокализацией π-электронов в циклической системе.
Слайд 3Простейший представитель аренов – бензол С6Н6 выделен в 1825 г
из «светильного газа» М. Фарадеем. По поводу его строения долго
не было единого мнения.Если скелет бензола незамкнутый
СН2 = СН – СН = СН – С ≡ СН,
то должны были существовать несколько изомеров однозамещенного производного бензола.
В 1865 г немецкий химик Ф. Кекуле предложил циклическую формулу бензола - правильного шестиугольника с чередующимися одинарными и двойными связями.
По Кекуле: бензол должен вступать в реакции, характерные для непредельных УВ. Однако бензол не обесцвечивает бромную воду и раствор перманганата калия.
Для него характерны реакции замещения. Реакции присоединения протекают только в жестких условиях.
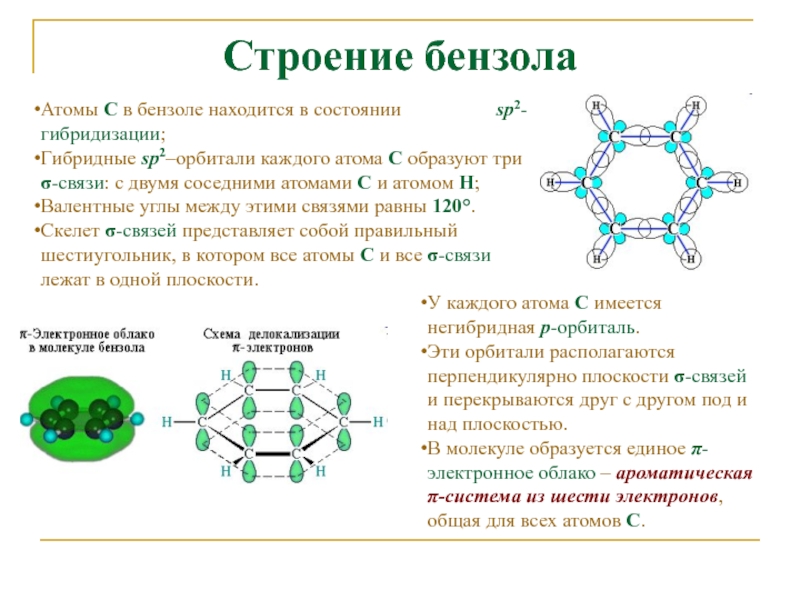
Слайд 4Строение бензола
Атомы С в бензоле находится в состоянии
sp2-гибридизации;
Гибридные sp2–орбитали каждого
атома С образуют три σ-связи: с двумя соседними атомами С и атомом Н;Валентные углы между этими связями равны 120°.
Скелет σ-связей представляет собой правильный шестиугольник, в котором все атомы С и все σ-связи лежат в одной плоскости.
У каждого атома С имеется негибридная р-орбиталь.
Эти орбитали располагаются перпендикулярно плоскости σ-связей и перекрываются друг с другом под и над плоскостью.
В молекуле образуется единое π-электронное облако – ароматическая π-система из шести электронов, общая для всех атомов С.
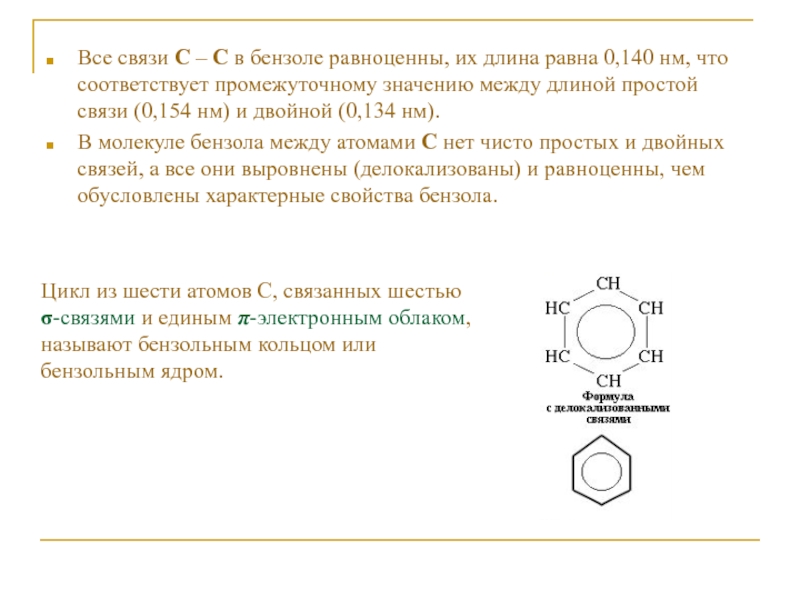
Слайд 5Все связи С – С в бензоле равноценны, их длина
равна 0,140 нм, что соответствует промежуточному значению между длиной простой
связи (0,154 нм) и двойной (0,134 нм).В молекуле бензола между атомами С нет чисто простых и двойных связей, а все они выровнены (делокализованы) и равноценны, чем обусловлены характерные свойства бензола.
Цикл из шести атомов С, связанных шестью σ-связями и единым π-электронным облаком, называют бензольным кольцом или бензольным ядром.
Слайд 6Гомологический ряд бензола
Гомологи бензола – соединения, образованные заменой одного или
нескольких атомов водорода в молекуле бензола на углеводородные радикалы (R):
Общая формула гомологического ряда бензола CnH2n-6 (n ≥ 6)
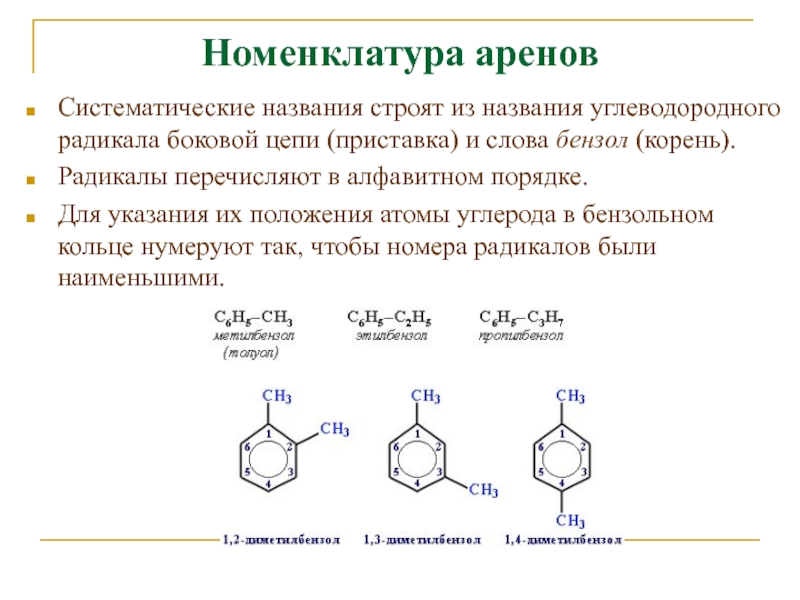
Слайд 7Номенклатура аренов
Систематические названия строят из названия углеводородного радикала боковой цепи
(приставка) и слова бензол (корень).
Радикалы перечисляют в алфавитном порядке.
Для указания
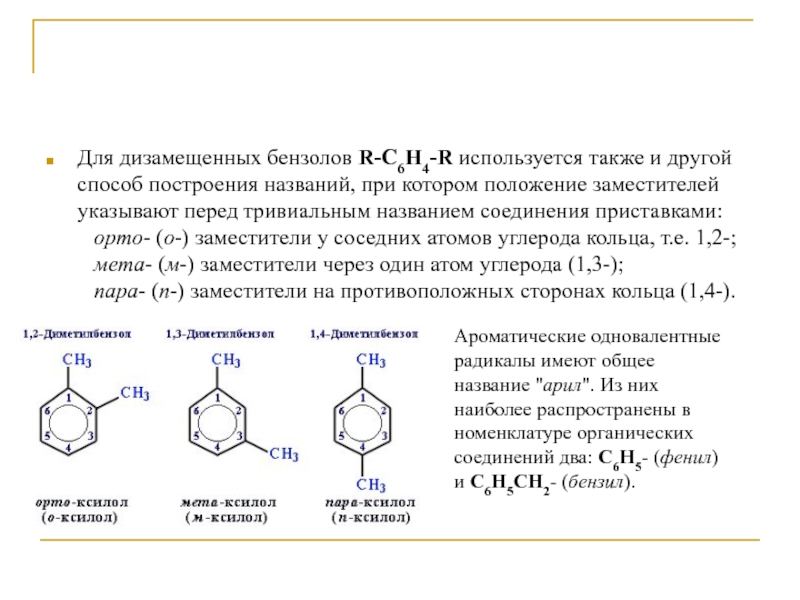
их положения атомы углерода в бензольном кольце нумеруют так, чтобы номера радикалов были наименьшими. Слайд 8Для дизамещенных бензолов R-C6H4-R используется также и другой способ построения
названий, при котором положение заместителей указывают перед тривиальным названием соединения
приставками: орто- (о-) заместители у соседних атомов углерода кольца, т.е. 1,2-; мета- (м-) заместители через один атом углерода (1,3-); пара- (п-) заместители на противоположных сторонах кольца (1,4-).Ароматические одновалентные радикалы имеют общее название "арил". Из них наиболее распространены в номенклатуре органических соединений два: C6H5- (фенил) и C6H5CH2- (бензил).
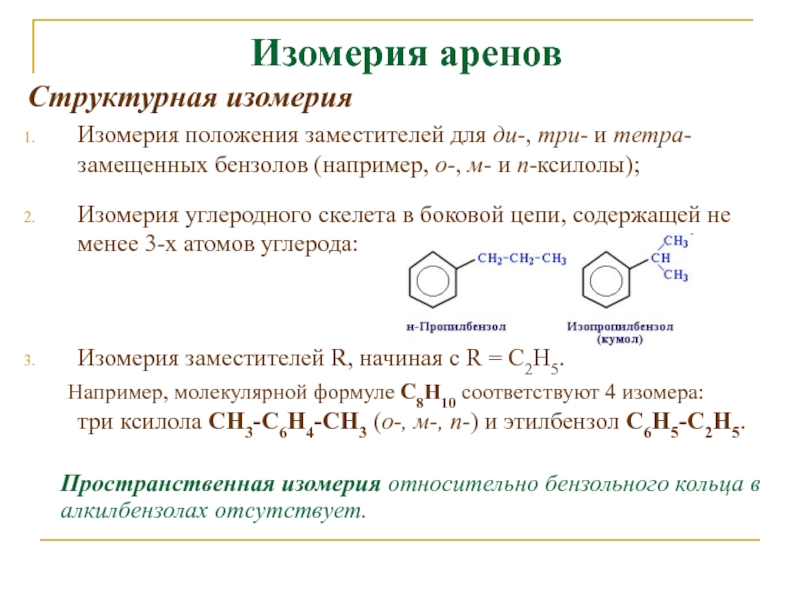
Слайд 9Изомерия аренов
Структурная изомерия
Изомерия положения заместителей для ди-, три- и
тетра-замещенных бензолов (например, о-, м- и п-ксилолы);
Изомерия углеродного скелета
в боковой цепи, содержащей не менее 3-х атомов углерода:Изомерия заместителей R, начиная с R = С2Н5.
Например, молекулярной формуле С8Н10 соответствуют 4 изомера: три ксилола CH3-C6H4-CH3 (о-, м-, п-) и этилбензол C6H5-C2H5.
Пространственная изомерия относительно бензольного кольца в алкилбензолах отсутствует.
Слайд 10Физические свойства аренов
Бензол и его ближайшие гомологи – бесцветные жидкие
вещества, нерастворимые в воде, но хорошо растворяющиеся во многих органических
жидкостях. Легче воды. Огнеопасны. Бензол токсичен (поражает почки, печень, костный мозг, кровь).Слайд 11Химические свойства аренов
По химическим свойствам арены отличаются от предельных и
непредельных углеводородов. Причина - особенность строения бензольного кольца.
Делокализация шести π-электронов
в циклической системе понижает энергию молекулы и обусловливает повышенную устойчивость (ароматичность) бензола и его гомологов.Арены не склонны вступать в реакции присоединения или окисления, которые ведут к нарушению ароматичности.
Для аренов более характерны реакции, идущие с сохранением ароматической системы - реакции замещения атомов водорода, связанных с циклом.
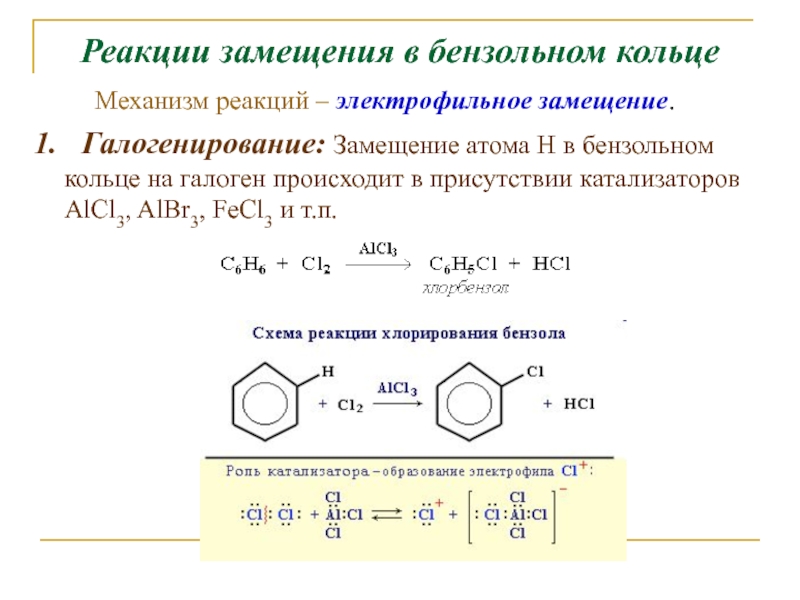
Слайд 12Реакции замещения в бензольном кольце
1. Галогенирование: Замещение атома Н в
бензольном кольце на галоген происходит в присутствии катализаторов AlCl3, AlBr3,
FeCl3 и т.п.Механизм реакций – электрофильное замещение.
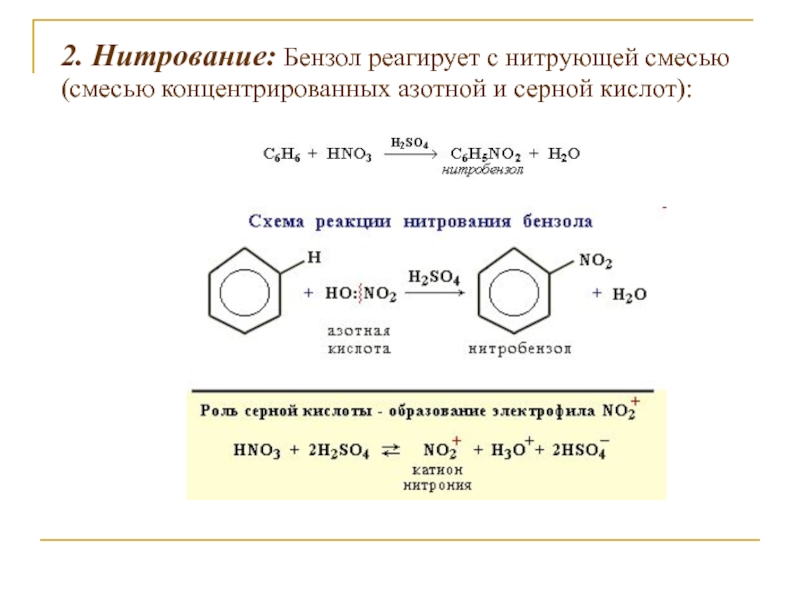
Слайд 132. Нитрование: Бензол реагирует с нитрующей смесью (смесью концентрированных азотной
и серной кислот):
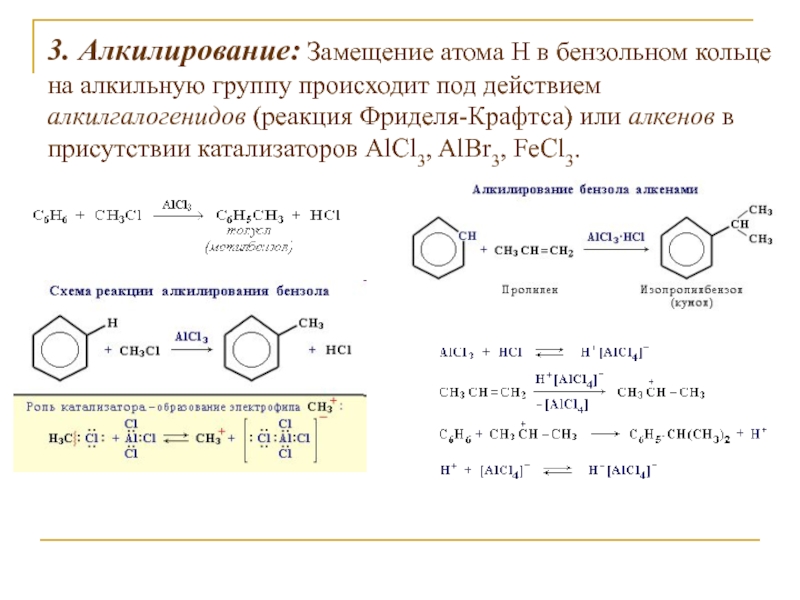
Слайд 143. Алкилирование: Замещение атома Н в бензольном кольце на алкильную
группу происходит под действием алкилгалогенидов (реакция Фриделя-Крафтса) или алкенов в
присутствии катализаторов AlCl3, AlBr3, FeCl3.Слайд 15Замещение в алкилбензолах
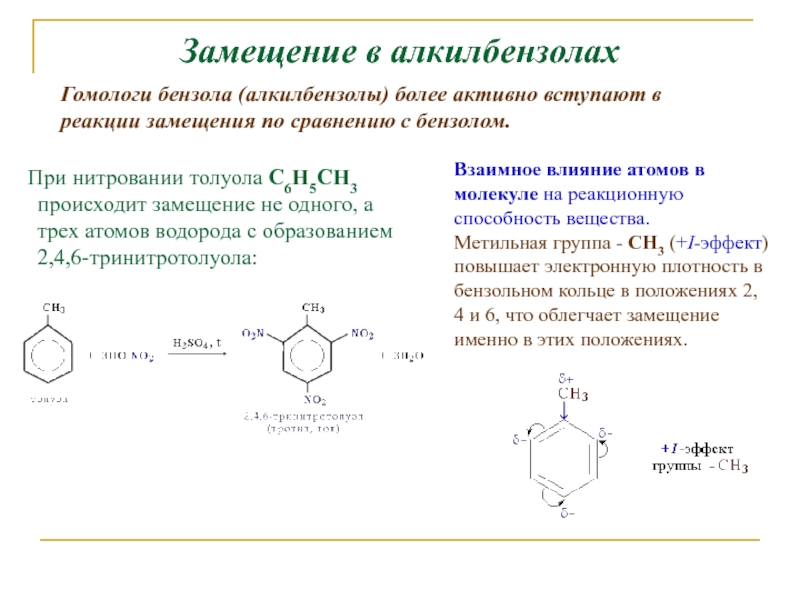
При нитровании толуола С6Н5CH3 происходит замещение не
одного, а трех атомов водорода с образованием 2,4,6-тринитротолуола:
Гомологи бензола
(алкилбензолы) более активно вступают в реакции замещения по сравнению с бензолом. Взаимное влияние атомов в молекуле на реакционную способность вещества.
Метильная группа - СH3 (+I-эффект) повышает электронную плотность в бензольном кольце в положениях 2, 4 и 6, что облегчает замещение именно в этих положениях.
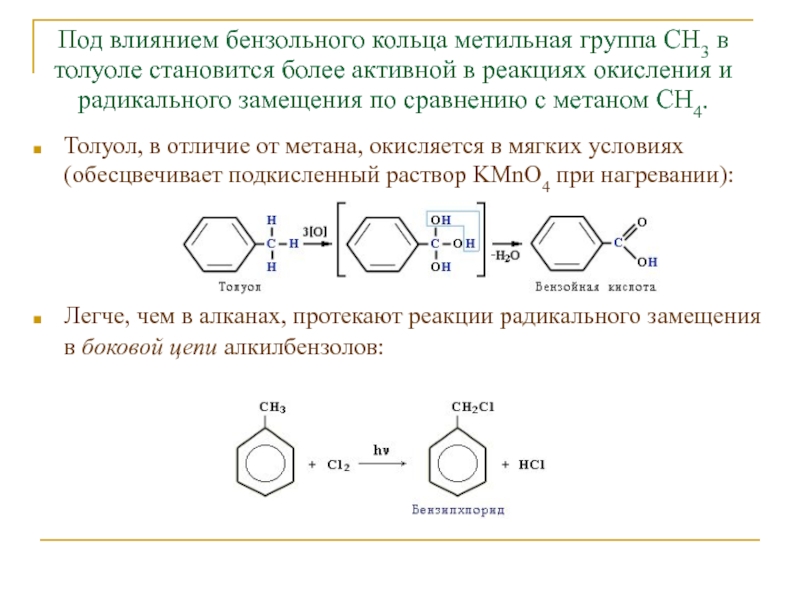
Слайд 16Под влиянием бензольного кольца метильная группа СH3 в толуоле становится
более активной в реакциях окисления и радикального замещения по сравнению
с метаном СH4.Толуол, в отличие от метана, окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO4 при нагревании):
Легче, чем в алканах, протекают реакции радикального замещения в боковой цепи алкилбензолов:
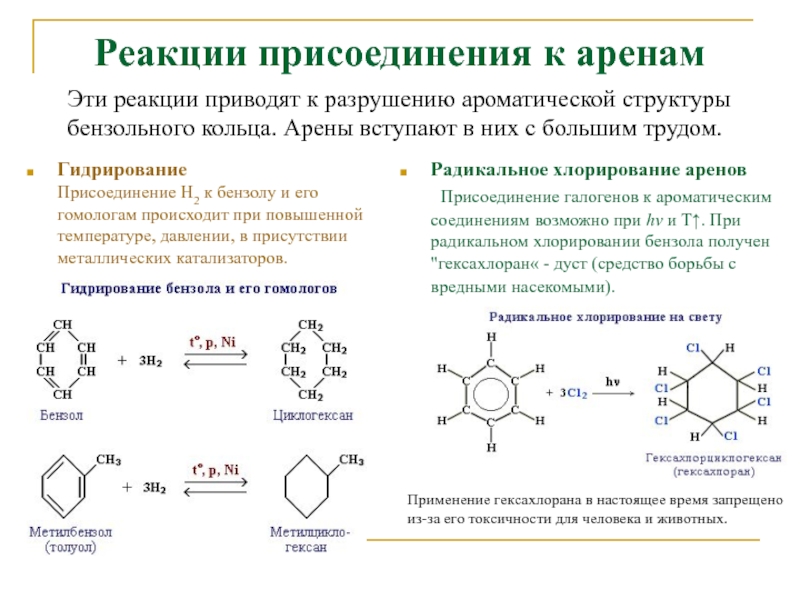
Слайд 17Реакции присоединения к аренам
Гидрирование
Присоединение Н2 к бензолу и его
гомологам происходит при повышенной температуре, давлении, в присутствии металлических катализаторов.
Радикальное хлорирование аренов
Присоединение галогенов к ароматическим соединениям возможно при hν и Т↑. При радикальном хлорировании бензола получен "гексахлоран« - дуст (средство борьбы с вредными насекомыми).
Эти реакции приводят к разрушению ароматической структуры бензольного кольца. Арены вступают в них с большим трудом.
Применение гексахлорана в настоящее время запрещено из-за его токсичности для человека и животных.
Слайд 18Реакции окисления аренов
При действии раствора KMnO4 в кислой среде и
нагревании в гомологах бензола окислению подвергаются только боковые цепи:
Окисление
других гомологов (этилбензол, пропилбензол и т.д.) также приводит к образованию бензойной кислоты. Разрыв связи при этом происходит между двумя ближайшими к кольцу атомами углерода в боковой цепи. Бензол не окисляется даже под действием сильных окислителей (KMnO4). Он часто используется как инертный растворитель при проведении реакций окисления других органических соединений.
Гомологи бензола окисляются довольно легко.
Бензол и его гомологи на воздухе горят коптящим пламенем, что обусловлено высоким содержанием углерода в их молекулах:
Бензол и его летучие гомологи образуют с воздухом и кислородом взрывоопасные смеси.
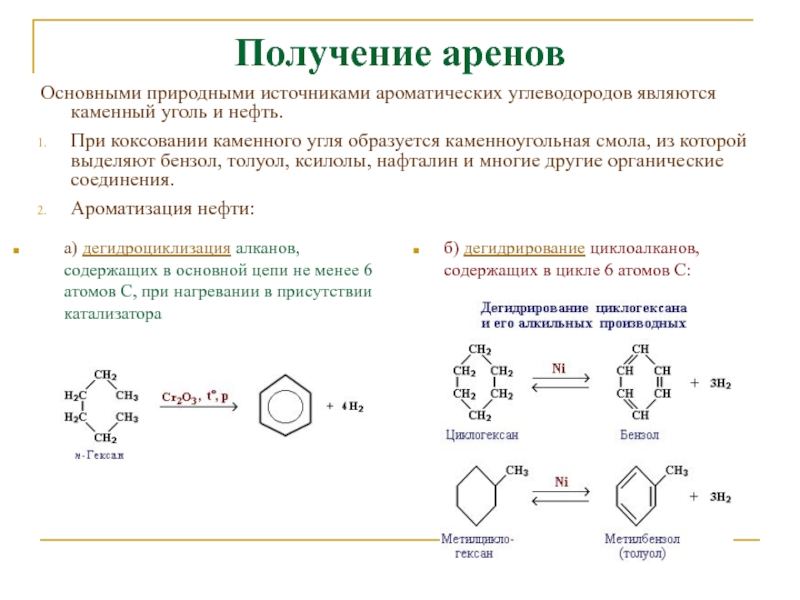
Слайд 19Получение аренов
а) дегидроциклизация алканов, содержащих в основной цепи не менее
6 атомов С, при нагревании в присутствии катализатора
б) дегидрирование
циклоалканов, содержащих в цикле 6 атомов С: Основными природными источниками ароматических углеводородов являются каменный уголь и нефть.
При коксовании каменного угля образуется каменноугольная смола, из которой выделяют бензол, толуол, ксилолы, нафталин и многие другие органические соединения.
Ароматизация нефти:
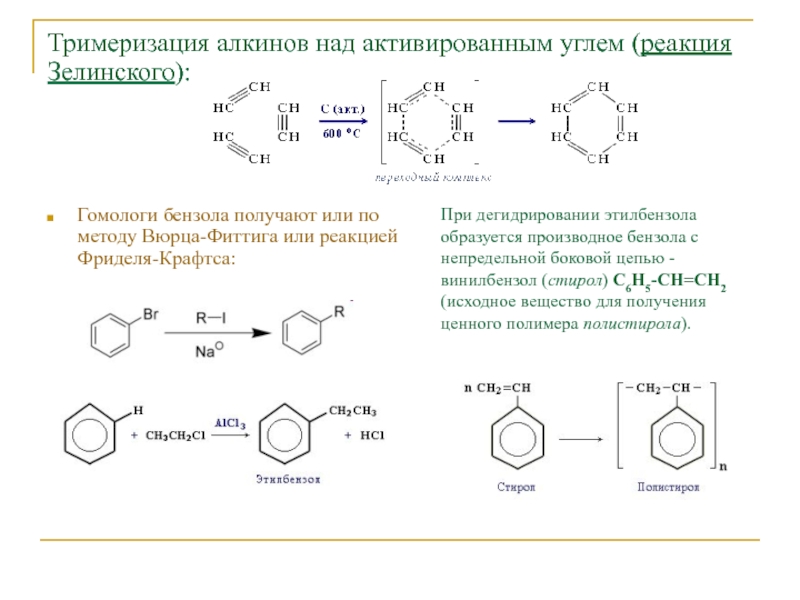
Слайд 20Тримеризация алкинов над активированным углем (реакция Зелинского):
Гомологи бензола получают или
по методу Вюрца-Фиттига или реакцией Фриделя-Крафтса:
При дегидрировании этилбензола образуется производное
бензола с непредельной боковой цепью - винилбензол (стирол) C6H5-CН=СН2 (исходное вещество для получения ценного полимера полистирола).Слайд 21Применение аренов
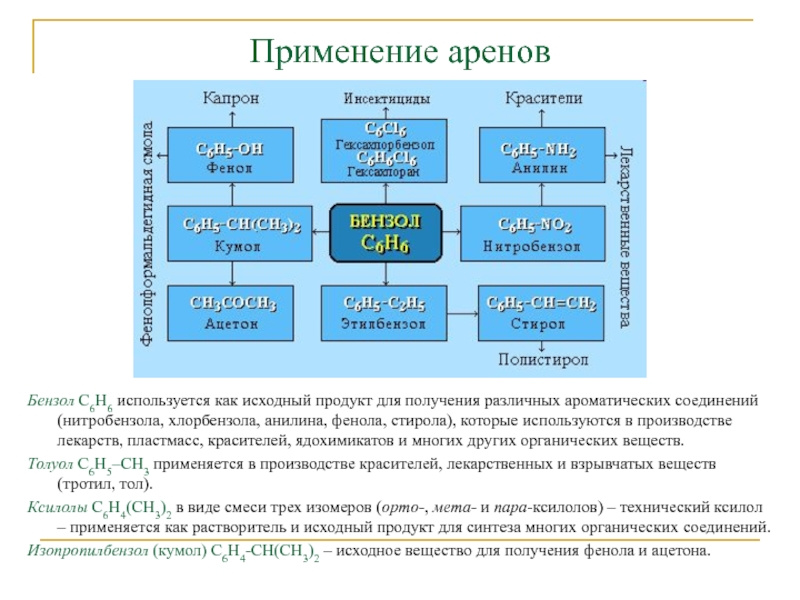
Бензол С6Н6 используется как исходный продукт для получения различных
ароматических соединений (нитробензола, хлорбензола, анилина, фенола, стирола), которые используются в
производстве лекарств, пластмасс, красителей, ядохимикатов и многих других органических веществ.Толуол С6Н5–СН3 применяется в производстве красителей, лекарственных и взрывчатых веществ (тротил, тол).
Ксилолы С6Н4(СН3)2 в виде смеси трех изомеров (орто-, мета- и пара-ксилолов) – технический ксилол – применяется как растворитель и исходный продукт для синтеза многих органических соединений.
Изопропилбензол (кумол) С6Н4-СН(СН3)2 – исходное вещество для получения фенола и ацетона.