Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
b - окисление жирных кислот и кетогенез
Содержание
- 1. b - окисление жирных кислот и кетогенез
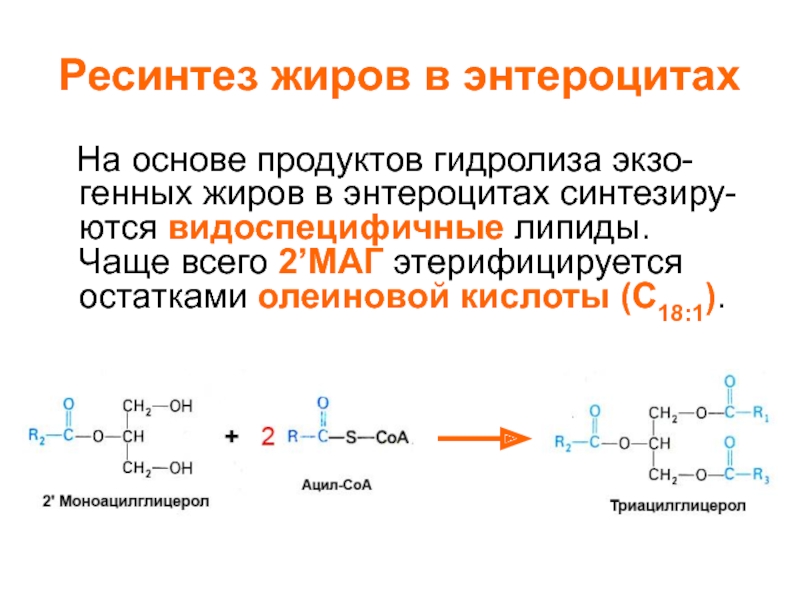
- 2. Ресинтез жиров в энтероцитах На
- 3. Фосфолипиды образуются на основе фосфатидной кислоты и
- 4. Транспортные формы экзогенных липидов * Глицерол и
- 5. ХМ – транспортная форма экзогенных липидовХМ образуются
- 6. * В кровяном русле незрелые ХМ получа-ют
- 7. Схема строения частицы ХМ
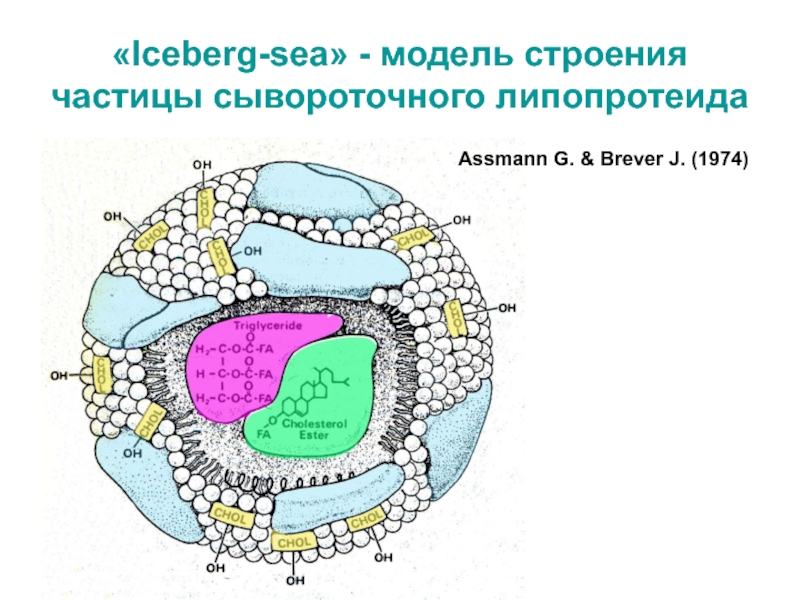
- 8. «Iceberg-sea» - модель строения частицы сывороточного липопротеидаAssmann G. & Brever J. (1974)
- 9. Функции ХМ* ХМ доставляют экзогенные липиды в
- 10. ХМ, отдав часть ТАГ в
- 11. Промежуточный обмен липидовВнутриклеточный липолиз Адипоциты или
- 12. Механизм активации гормончувствительной ТАГ-липазы адипоцитов* В постабсорбтивном
- 13. * В результате активации аденилатцик-лазы повышается концентрация
- 14. Суммарный результат гидролиза ТАГ в адипоцитахГормончувствительная ТАГ-липаза
- 15. * СЖК транспортируются по крови
- 16. Метаболизм глицерола Глицерол гидрофилен и переносится
- 17. * Глицерол является субстратом для: -
- 18. Окисление жирных кислотПуть окисления СЖК, сопряженный с
- 19. Слайд 19
- 20. Опыты Франца КнопаК w-атому углерода ЖК с
- 21. Активация и транспорт ЖК в митохондрии
- 22. 2. Проникновение активированной ЖК в матрикс митохондрий:2.1.
- 23. 2.3. Обратное превращение:
- 24. Реакции b-окисления жирных кислотПуть b-окисления – повторяющаяся
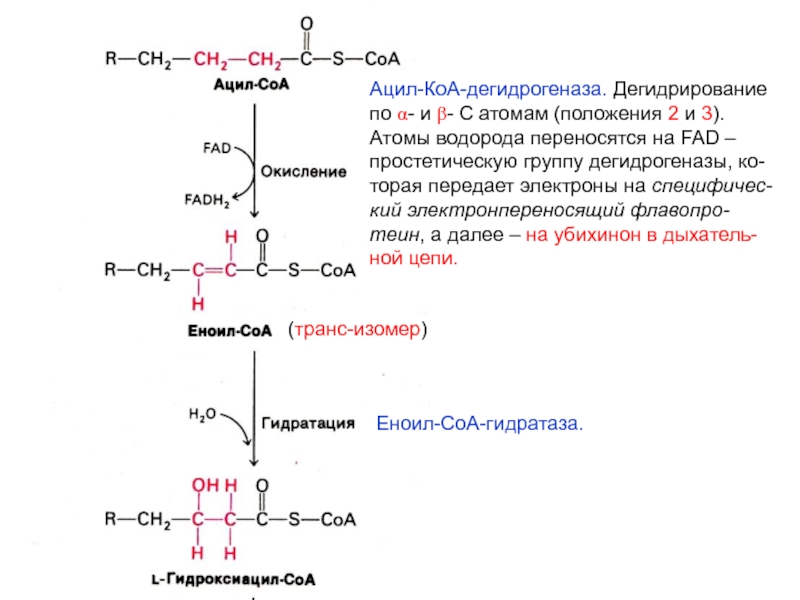
- 25. Ацил-КоА-дегидрогеназа. Дегидрированиепо a- и b- С атомам
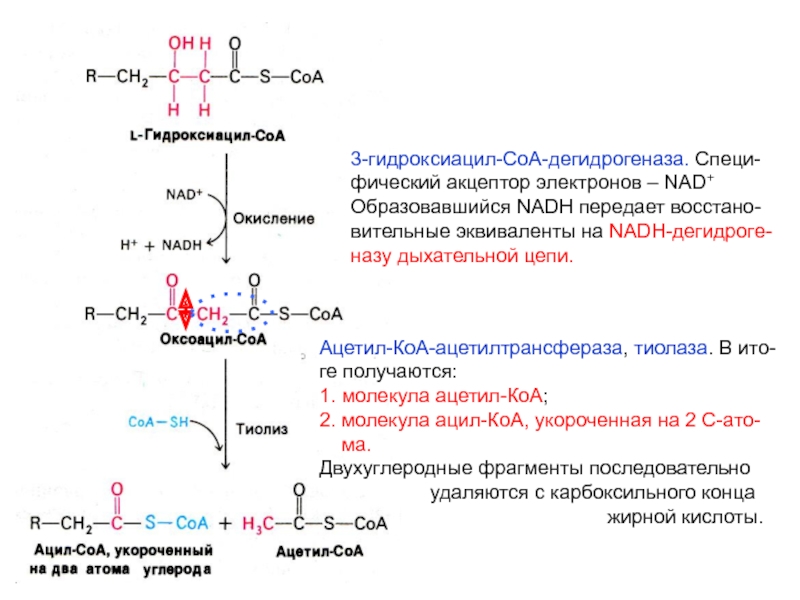
- 26. 3-гидроксиацил-СоА-дегидрогеназа. Специ-фический акцептор электронов – NAD+ Образовавшийся
- 27. Особенности b-окисления ЖК с нечетным числом С-атомов
- 28. 2. Ненасыщенные ЖК (содержат
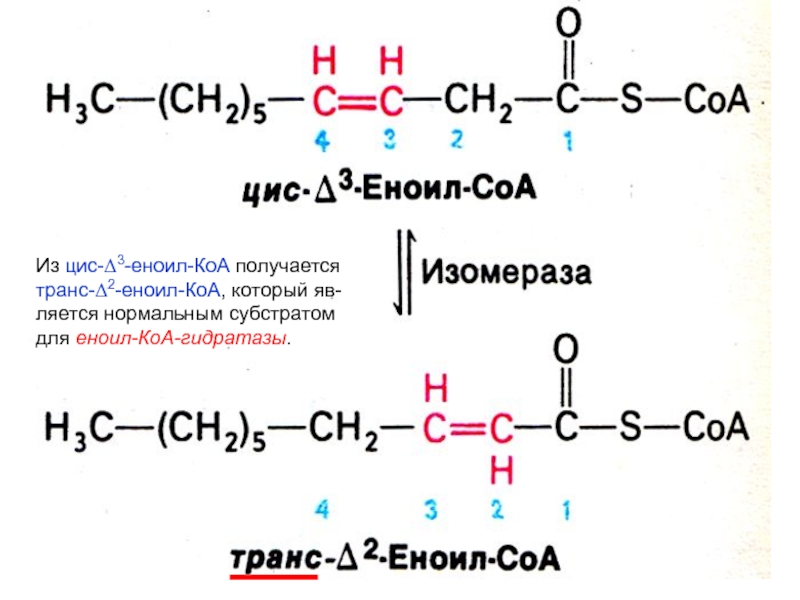
- 29. Из цис-D3-еноил-КоА получаетсятранс-D2-еноил-КоА, который яв-ляется нормальным субстратом для еноил-КоА-гидратазы.
- 30. 2. Если окисляется ЖК с двумя двойными
- 31. Эпимераза превращает D-стереоизомер в L-стереоизомер, который является субстратом для 3-гидроксиацил-СоА-дегидрогеназы.
- 32. Выход АТФ при b-окислении пальмитиновой кислотыКаждый этап
- 33. КЕТОГЕНЕЗИзбыточное образование ацетил-КоА или снижение его утилизации
- 34. Ацетил-КоА, как продукт окисления ЖК, далее окисляется
- 35. При голодании и диабете (окисление
- 36. 3-кетотиолазаГидроксиметил-глутарил-КоА-синтетазаГидроксиметил-глутарил-КоА-лиазаD-3-гидрокси-бутират-ДГСпонтанноедекарбокси-лирование(необратимо) («главное» КТ)Покидает ор-ганизм через кожу, почки и легкие
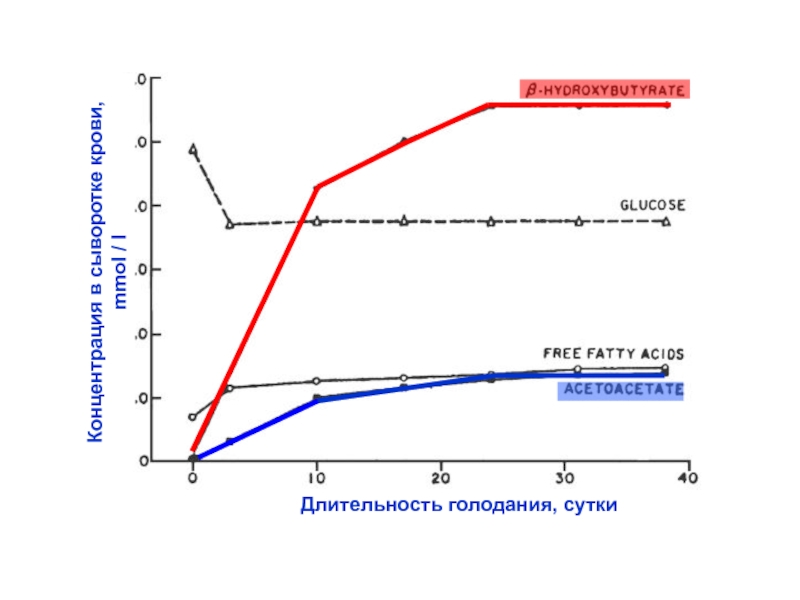
- 37. Длительность голодания, суткиКонцентрация в сыворотке крови, mmol / l
- 38. Ацетоацетат и гидроксибутират свободно диф-фундируют (по градиенту
- 39. При длительном голодании и при диабете концентрация
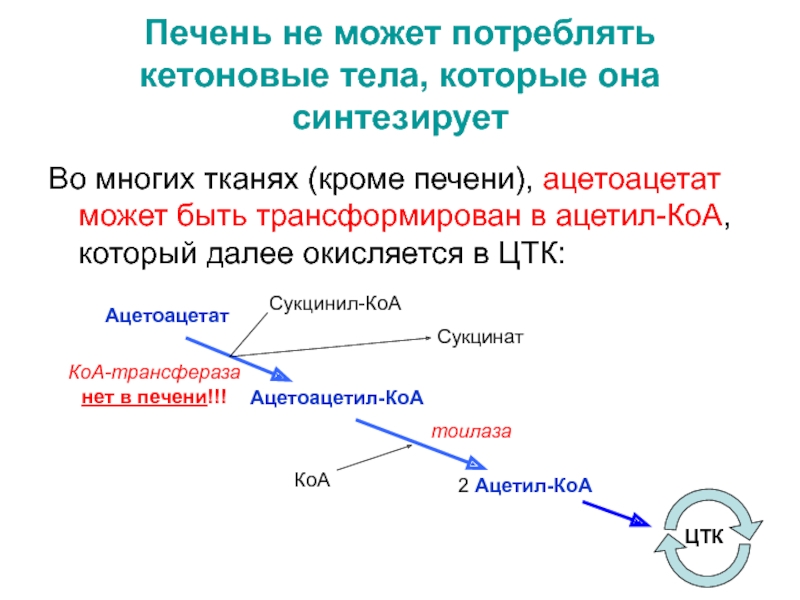
- 40. Печень не может потреблять кетоновые тела, которые
- 41. Скачать презентанцию
Ресинтез жиров в энтероцитах На основе продуктов гидролиза экзо- генных жиров в энтероцитах синтезиру- ются видоспецифичные липиды. Чаще всего 2’МАГ этерифицируется остатками олеиновой кислоты (C18:1).
Слайды и текст этой презентации
Слайд 3Фосфолипиды образуются на основе фосфатидной кислоты и активных форм холина,
серина и т.д.
OII
СН2-О-С-R1
I
R2-C-O-CH OH
II I I
O CH2-O-P-OH
II
O Фосфатидная кислота
1
2
3
Слайд 4Транспортные формы экзогенных липидов
* Глицерол и СЖК (С
из энтероцитов через портальную вену и поступают в печень.
*
СЖК (С>10) покидают энтероциты через кишечную лимфатическую систему в форме ресинтезированных ТАГ в составе хиломикронов (ХМ).от «сhylos» (греч.) – лимфа (млечный сок).
[Мунк, 1891]
Слайд 5ХМ – транспортная форма экзогенных липидов
ХМ образуются в энтероцитах:
* Незрелые
ХМ (насцентные) – 85% ТАГ, немного ФЛ и ЭХС, белок
– апопротеин В-48 (апо-В-48). Покидают энтероциты путем экзоцитоза и поступают в лимфатические сосуды грудной лимфатический проток подключичная вена.Слайд 6* В кровяном русле незрелые ХМ получа-ют от ЛПВП апо-Е,
апо-С-II (кофактор ЛПЛ) и апо-А-IV. Этим завершается превращение незрелых ХМ
в зрелые ХМ-частицы.* Состав зрелых ХМ (диаметр 100-1000 нм):
ТАГ – 84%
ФЛ – 7%
ХС – 8%
Белок – менее 2% (апо-В-48, апо-С-II,
апо-Е и апо-А-IV)
Плотность (удельный вес) ХМ <0,95 г/мл
Слайд 8«Iceberg-sea» - модель строения частицы сывороточного липопротеида
Assmann G. & Brever
J. (1974)
Слайд 9Функции ХМ
* ХМ доставляют экзогенные липиды в печень, жировую ткань,
миокард и скелетные мышцы. ТАГ в составе ХМ гидролизуются с
участием липопротеинлипазы (ЛПЛ), которая находится на поверхности эндотелиоцитов капилляров.* ЛПЛ синтезируется в печени. Активаторы: инсулин, СТГ и гепарин.
* СЖК, освобожденные в результате гидролиза ТАГ, поступают внутрь клеток.
В плазматических мембранах многих типов клеток имеются специфи-ческие белки-переносчики для СЖК (40 кДа). В скелетных мышцах имеется еще транслоказа жирных кислот (84 кДа, CD36). В ответ на повышение концентрации инсулина в крови, эта транслоказа выходит из цитоплазмы и встраивается в мембрану, обеспечивая быстрое поглощение СЖК мышечными клетками. (Подобно ГЛЮТ-4).
Слайд 10 ХМ, отдав часть ТАГ в результате их гидро-лиза
ЛПЛ, превращаются в ремнантные ХМ (р-ХМ), которые поглощаются гепатоцитами с
помощью рецепторов к р-ХМ (эти рецепторы «узнают» р-ХМ по апо-Е).ХС из р-ХМ, оказавшись в печени, по меха-низму отрицательной обратной связи ингибирует синтез ХС de novo.
Излишки ХС выводятся печенью с желчью
Слайд 11Промежуточный обмен липидов
Внутриклеточный липолиз
Адипоциты или клетки жировой ткани
(подкожный жир, малый и большой сальники брюшной полости):
* Гидролиз ТАГ
катализирует гормончувствительная ТАГ-липаза. * Процесс мобилизации жира активируется в
постабсорбтивном периоде, голодании,
при физической нагрузке.
Слайд 12Механизм активации гормончувствительной ТАГ-липазы адипоцитов
* В постабсорбтивном периоде липолиз в
ади-поцитах активируется глюкагоном;
* При физической нагрузке липолиз в адипоци-тах активируется
адреналином. * Оба гормона связываются со своими рецеп-торами на поверхности клеточной мембраны и активируют аденилатциклазу.
Адреналин в высоких концентрациях связы-вается с b-адренорецепторами адипоцитов.
Слайд 13* В результате активации аденилатцик-лазы повышается концентрация ц-АМФ, которая активирует
протеинкиназу А (ПКА).
* ПКА фосфорилирует неактивную форму ТАГ-липазы (активная форма
ТАГ-липазы фосфорилированная).* Переход активной формы ТАГ-липазы в неактивную – через дефосфорилиро-вание: инсулин активирует протеин-фосфатазу.
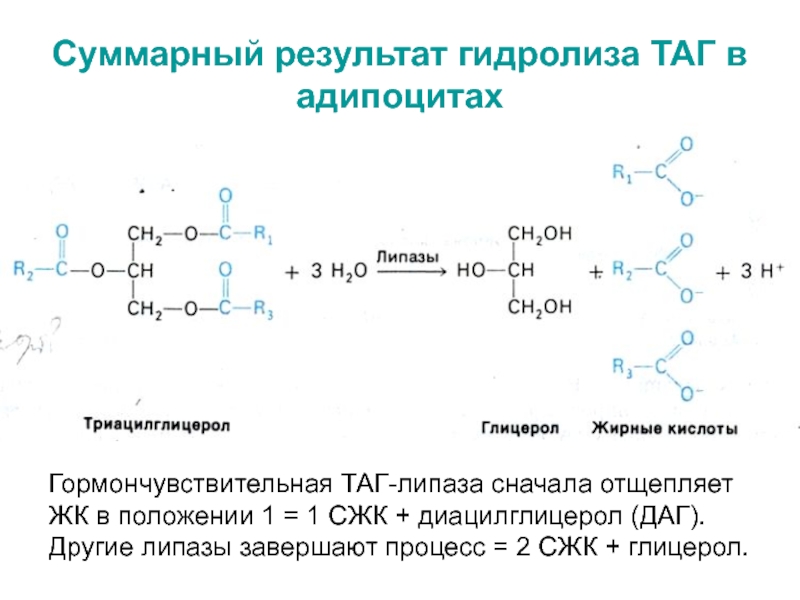
Слайд 14Суммарный результат гидролиза ТАГ в адипоцитах
Гормончувствительная ТАГ-липаза сначала отщепляет
ЖК
в положении 1 = 1 СЖК + диацилглицерол (ДАГ).
Другие
липазы завершают процесс = 2 СЖК + глицерол.Слайд 15 * СЖК транспортируются по крови в
комплексе
с альбумином – молекула
альбумина имеет 7 специфических
сайтов для связывания СЖК. * СЖК из крови проникают внутрь клетки с помощью специфического белка-переносчика цитоплазматической мем-браны (40 кДа): fatty acids binding protein (FABP). Проникнув внутрь клетки, СЖК включаются в процессы окисления и синтеза липидов (преобладание реак-ций зависит от функционального состо-яния клетки).
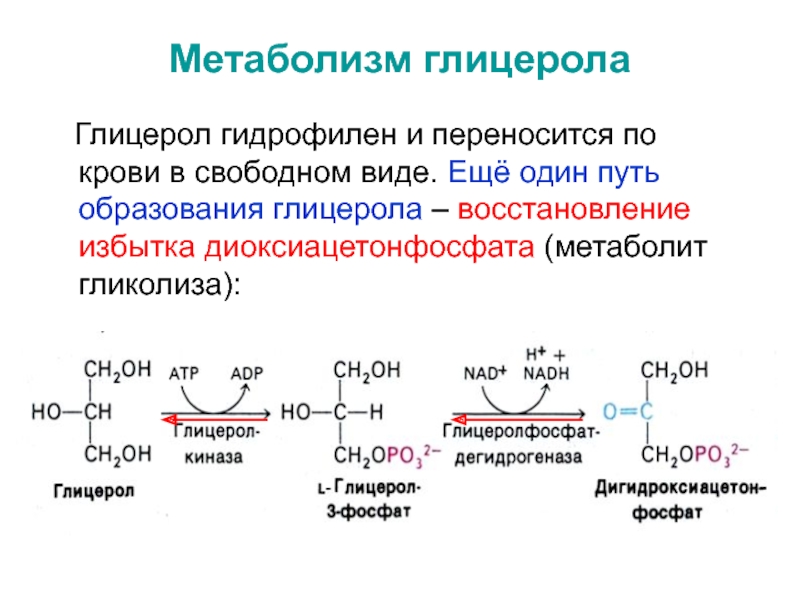
Слайд 16Метаболизм глицерола
Глицерол гидрофилен и переносится по крови в
свободном виде. Ещё один путь образования глицерола – восстановление избытка
диоксиацетонфосфата (метаболит гликолиза):Слайд 17* Глицерол является субстратом для:
- липогенеза;
-
глюконеогенеза
или может окисляется через диокси-ацетонфосфат по
гликолитическому пути. ЗАДАНИЕ: Назовите ключевые ферменты этих метаболических превращений и расчитайте энерге-тическую ценность окисления глицерина.
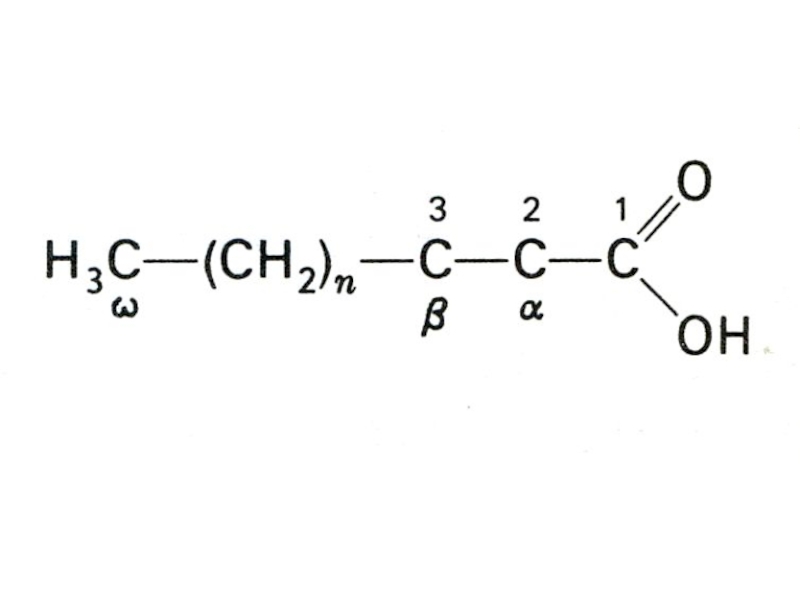
Слайд 18Окисление жирных кислот
Путь окисления СЖК, сопряженный с синте-зом АТФ, протекает
в митохондриях [Ю.Кеннеди и А.Ленинджер, 1949] и назва-ется b-окислением.
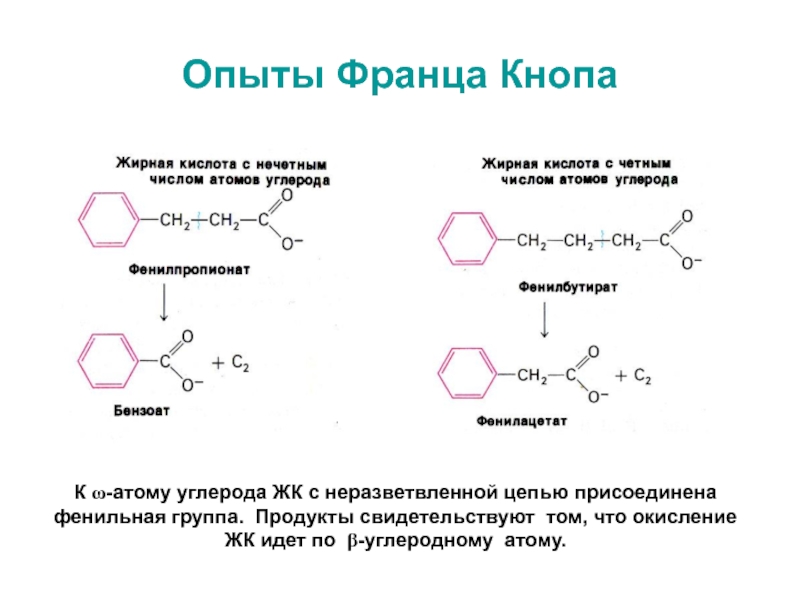
Ф. Кноп
(1904) установил, что расщепление СЖК происходит путем окисления при b-ато-ме углерода и последовательного удаления двухуглеродных фрагментов.Слайд 20Опыты Франца Кнопа
К w-атому углерода ЖК с неразветвленной цепью присоединена
фенильная группа. Продукты свидетельствуют том, что окисление
ЖК идет по
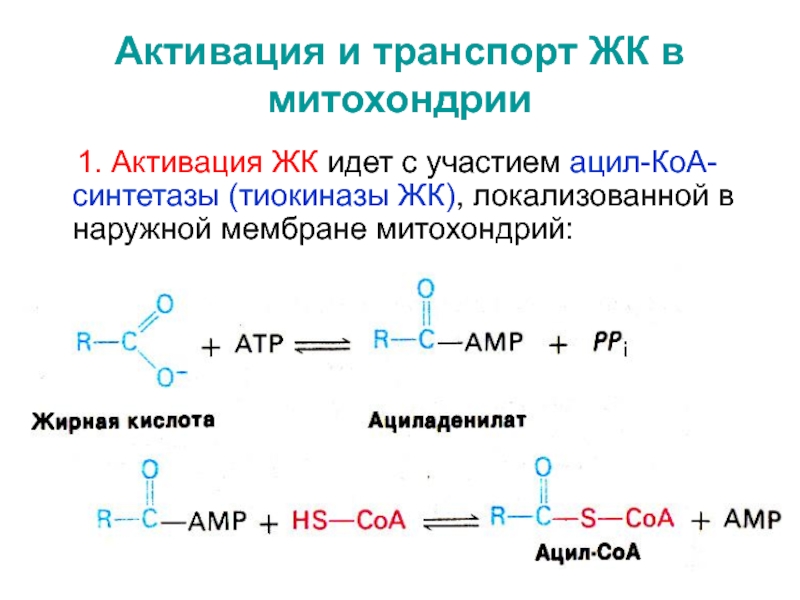
b-углеродному атому.Слайд 21Активация и транспорт ЖК в митохондрии
1. Активация ЖК
идет с участием ацил-КоА-синтетазы (тиокиназы ЖК), локализованной в наружной мембране
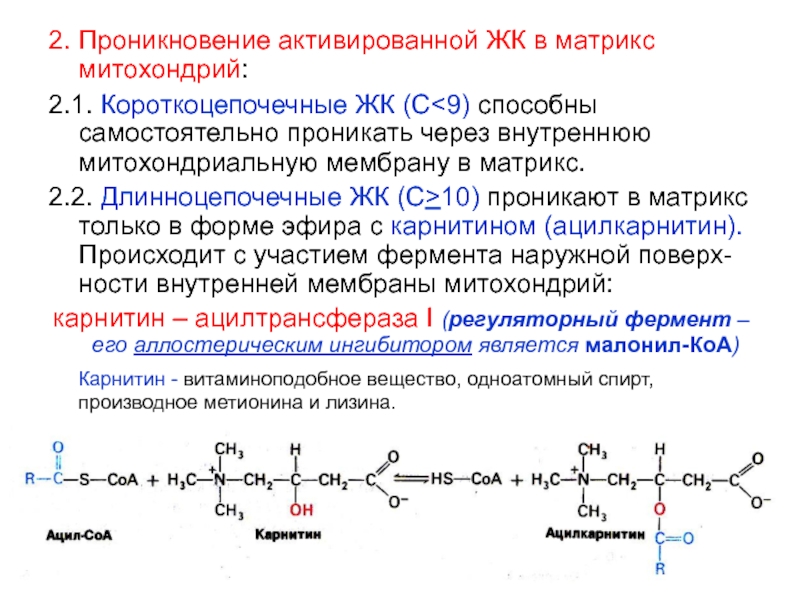
митохондрий:Слайд 222. Проникновение активированной ЖК в матрикс митохондрий:
2.1. Короткоцепочечные ЖК (С
способны самостоятельно проникать через внутреннюю митохондриальную мембрану в матрикс.
2.2. Длинноцепочечные
ЖК (С>10) проникают в матрикс только в форме эфира с карнитином (ацилкарнитин). Происходит с участием фермента наружной поверх-ности внутренней мембраны митохондрий: карнитин – ацилтрансфераза I (регуляторный фермент – его аллостерическим ингибитором является малонил-КоА)
Карнитин - витаминоподобное вещество, одноатомный спирт, производное метионина и лизина.
Слайд 232.3. Обратное превращение:
ацилкарнитин ацил-КоА
Происходит с участием фермента, локализованном на внутренней поверхности внутренней мембраны митохондрий:карнитин-ацилтрансфераза II
ацилкарнитин + КоА-SH ацил-КоА + карнитин
Трехэтапный процесс: активация ЖК (ацил-КоА) и пере-
нос активированной ЖК в матрикс (ацилкарнитин
ацил-КоА) позволяет использовать два не обмени-
вающихся между собой пула КоА. В цитоплазме и
матриксе МХ эти пулы используются для разных целей.
Слайд 24Реакции b-окисления жирных кислот
Путь b-окисления – повторяющаяся последова-
тельность четырех реакций.
На каждом этапе окисления образуется:
1 ацетил-КоА
1 FADH2
1 NADH
исходная цепь ЖК
укорачивается на 2 С-атома.Число этапов b – окисления: (n/2)-1,
где: n – число С-атомов в ЖК.
Слайд 25Ацил-КоА-дегидрогеназа. Дегидрирование
по a- и b- С атомам (положения 2 и
3). Атомы водорода переносятся на FAD – простетическую группу дегидрогеназы,
ко-торая передает электроны на специфичес-кий электронпереносящий флавопро-теин, а далее – на убихинон в дыхатель-ной цепи.
Еноил-СоА-гидратаза.
(транс-изомер)
Слайд 263-гидроксиацил-СоА-дегидрогеназа. Специ-
фический акцептор электронов – NAD+
Образовавшийся NADH передает восстано-
вительные
эквиваленты на NADH-дегидроге-
назу дыхательной цепи.
Ацетил-КоА-ацетилтрансфераза, тиолаза. В ито-
ге получаются:
1.
молекула ацетил-КоА; 2. молекула ацил-КоА, укороченная на 2 С-ато-
ма.
Двухуглеродные фрагменты последовательно
удаляются с карбоксильного конца
жирной кислоты.
Слайд 27Особенности b-окисления ЖК с нечетным числом С-атомов и ненасыщенных ЖК
1. ЖК с нечетным числом С-атомов :
На
последнем этапе окисления образуется 3-х углеродный остаток -пропионил-КоА.Пропионил-КоА карбоксилируется до сукцинил-КоА, который поступает в ЦТК.
Слайд 28 2. Ненасыщенные ЖК (содержат
двойные связи):
Требует
участия дополнительных ферментов: 1. Если ЖК имеет 1 двойную связь –
олеиновая к-та (С18:1, цис-D9):
Δ3,4–цис–Δ2,3–транс-изомераза
Фермент переносит двойную связь и меняет её конфигурацию.
Слайд 29Из цис-D3-еноил-КоА получается
транс-D2-еноил-КоА, который яв-
ляется нормальным субстратом
для еноил-КоА-гидратазы.
Слайд 302. Если окисляется ЖК с двумя двойными
связями –
линолевая к-та (С18:2, цис-
D9,D12)
I фермент: Δ3,4–цис–Δ2,3–транс-изомераза
II фермент: эпимераза
(D-стереоизомер превра-щает в L-стереоизомер).
Слайд 31Эпимераза превращает D-стереоизомер в
L-стереоизомер, который является субстратом для 3-гидроксиацил-СоА-дегидрогеназы.
Слайд 32Выход АТФ при b-окислении пальмитиновой кислоты
Каждый этап b–окисления сопровождается образованием
ФАДН2 и НАДН. Их реокисление в дыхательной цепи приводит к
синтезу 2 и 3 АТФ:2 + 3 = 5АТФ.
Число этапов b–окисления: (n/2)-1,где: n – количество С-атомов в жирной кислоте:
7 х 5АТФ = 35 АТФ.
Окисление ацетил-КоА в ЦТК в конечном итоге приводит с образованию 12 АТФ: 8 х 12АТФ = 96АТФ
1 АТФ затрачивается на активацию жирной кислоты.
Т.о. окисление пальмитиновой кислоты имеет энергетический выход: 35 + 96 - 1 = 130 АТФ.
Слайд 33КЕТОГЕНЕЗ
Избыточное образование ацетил-КоА или снижение его утилизации в ЦТК (причины!)
приводит к активации кетогенеза в митохондриях гепатоцитов (печень пере-распределяет недоокисленные
продукты на энергетичес-кие нужды других органов.Конденсация ацетильных фрагментов приводит к обра-зованию b-гидроксиметил-глутарил-КоА, а затем кетоновых тел: ацетона, гидроксибутирата и ацетоацетата.
В норме концентрация кетоновых тел в крови низкая, при голодании и диабете она увеличивается до 100 раз. При дефиците глюкозы мозг активно потребляет кетоновые тела, как дополнительный источник энергии (до 75%). Почки, миокард, скелетные мышцы также используют их как источники энергии.
Слайд 34Ацетил-КоА, как продукт окисления ЖК, далее окисляется в ЦТК («Жиры
сгорают в пламени углеводов»).
В норме, оптимальность «переработки» ацетил-КоА в
ЦТК определяется доступно-стью окаслоацетата, необходимого для образования цитрата (чтобы цикл замкнулся). В норме интенсивность окисления глюкозы и жирных кислот четко сбалансированы.Слайд 35 При голодании и диабете (окисление ЖК усиливается, а
глюкозы – подавляется):
Ацетил-КоА образуется в избытке;
Концентрация оксалоацетата снижается, поскольку
он «уходит» в глюконеогенез;В результате – избыточный поток ацетил-КоА
не может полностью расходоваться в реак-
ции конденсации с оксалоацетатом;
Избыток ацетил-КоА включается в кетогенез
с образованием кетоновых тел:
ацетоацетата, гидроксибутирата и ацетона.
Слайд 363-кетотиолаза
Гидроксиметил-
глутарил-КоА-
синтетаза
Гидроксиметил-
глутарил-КоА-
лиаза
D-3-гидрокси-
бутират-ДГ
Спонтанное
декарбокси-
лирование
(необратимо)
(«главное» КТ)
Покидает ор-
ганизм через
кожу, почки и
легкие
Слайд 38Ацетоацетат и гидроксибутират свободно диф-
фундируют (по градиенту концентрации) из
гепатоцитов в
кровь и доставляются к перифе-
рическим (по отношению к печени) органам
дляокисления до СО2 и Н2О.
Кетоновые тела более эффективные источники
энергии, чем пируват. Кетоновые тела не казы-
вают разобщающего эффекта на митохондрии,
что может быть при увеличении окисления
жирных кислот.
Слайд 39При длительном голодании и при диабете концентрация кетоновых тел в
крови может достигать чрезвычайно высоких значений. При этом ткани уже
не могут потребить все это количество кетоновых тел – формируется патологическое состояние - кетоз.Слайд 40Печень не может потреблять кетоновые тела, которые она синтезирует
Во многих
тканях (кроме печени), ацетоацетат может быть трансформирован в ацетил-КоА, который
далее окисляется в ЦТК:Ацетоацетат
Ацетоацетил-КоА
2 Ацетил-КоА
ЦТК
Сукцинил-КоА
Сукцинат
КоА
тоилаза
КоА-трансфераза
нет в печени!!!













![b - окисление жирных кислот и кетогенез Окисление жирных кислотПуть окисления СЖК, сопряженный с синте-зом АТФ, протекает в Окисление жирных кислотПуть окисления СЖК, сопряженный с синте-зом АТФ, протекает в митохондриях [Ю.Кеннеди и А.Ленинджер, 1949] и](/img/thumbs/13968b362e37a7001e851e381a58c1c8-800x.jpg)