Слайд 1Часть 2 курса
«Неорганическая химия» 1 семестра
Растворы
Лекционный материал №1
Слайд 2Растворы
Дисперсные системы – это системы, состоящие из сплошной среды (называемой
дисперсионной средой) с распределенным в ней веществом (дисперсной фазой), которое
состоит из отдельных частиц с большой удельной поверхностью.
В случае, когда распределенная фаза диспергирована до молекулярного или (и) ионного состояния, дисперсная система может являться стать истинным раствором.
Раствором называется фаза переменного (непрерывно-переменного) состава область гомогенности которой включает в себя по крайней мере один из чистых компонентов. (Отметим, что для формирования раствора необходимо взять, как минимум, двухкомпонентную систему!)
Слайд 3Переменность состава можно связать с концентрацией.
Напомним основные выражения концентраций.
1. Объемная
молярная концентрация – количество молей растворенного вещества в единице объема
раствора ([моль/л = М]. 1а. Нормальная концентрация (нормальность) – количество молей химического эквивалента растворенного вещества в единице объема раствора. [моль-экв/л].
2. Массовая доля – отношение массы растворенного компонента к общей массе раствора.
3. Мольная доля – отношение числа молей растворенного компо-нента к общему числу молей в растворе. Доли можно давать в %.
0 Г 1 0 Г1 xi xj Г2 1
H2O xC2H5OH C2H5OH H2O xC4H9OH tret-C4H9OH
Случай 1. Непрерывная взаимная Случай 2. Ограниченная растворимость
растворимость компонентов. компонентов друг в друге. Появляется
Область «Г» (отрезок [0, 1]) – это две* области гомогенности: на основе
область гомогенности (при P, T = const). каждого из компонентов.
d Г2 b
H2O xC4H9OH
tret-C4H9OH
Ограниченная растворимость. Можно ввести понятие предельной концентрации каждого из компонентов в растворе, находящемся в состоянии равновесия (с соседними фазами).
Раствор, имеющий предельные концентрации компонентов, называют насыщенным.
Ненасыщенный раствор – такой, в котором концентрация растворенного вещества меньше предельной.
Пересыщенный раствор – такой, в котором концентрация растворенного вещества больше предельной, допустимой для равновесия в данных условиях.
Спойлер. А как такое может быть и как получать такие растворы?
Слайд 5Ассоциация (от лат. associare — соединять) — объединение простых молекул
или ионов в более сложные, (почти) не вызывающее изменения химической
природы вещества.
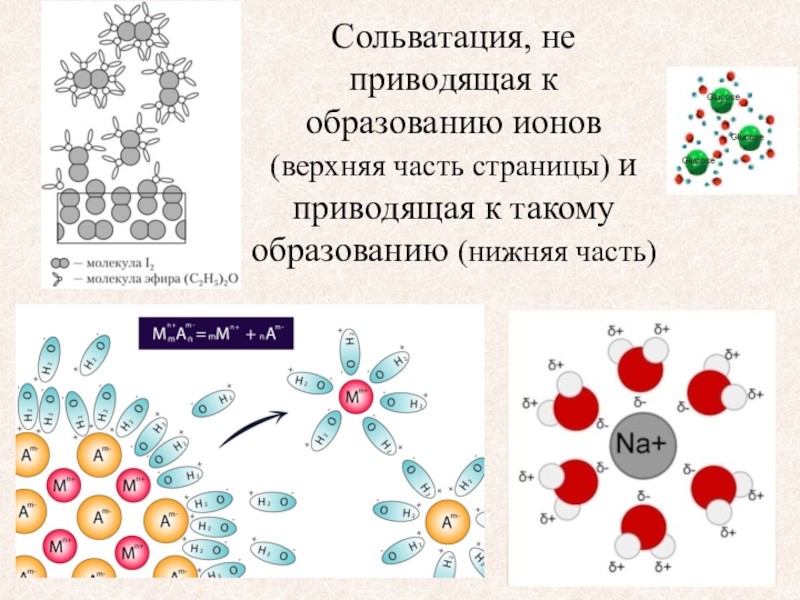
Сольвата́ция (от лат. solvo «растворяю») — электростатическое взаимодействие между частицами (ионами, молекулами) растворённого вещества и растворителя. Сольватация в водных растворах называется гидратацией. Образующиеся в результате сольватации молекулярные агрегаты называются сольва́тами (в случае воды — гидратами).
Слайд 6Сольватация, не приводящая к образованию ионов (верхняя часть страницы) и
приводящая к такому образованию (нижняя часть)
Слайд 7Электролитическая ионизация (диссоциация)
Процесс распада растворенного вещества на ионы под действием
растворителя называется электролитической ионизацией или диссоциацией (последнее - в старой
литературе).
Определение из литературы:
- Электролиты – это вещества, которые при растворении распадаются на ионы. (Задание: покритиковать на досуге)
Доказательства реальности электролитической ионизации
1. При нейтрализации водных растворов сильных кислот растворами сильных оснований всегда выделяется одинаковое количество теплоты, равное 57,1 кДж на 1 эквивалент кислоты или основания. Реакция нейтрализации фактически сводится к взаимодействию иона водорода H+ и гидроксид-иона OH – , в результате которого образуются молекулы воды:
Н+ + OH – = НОН
Слайд 8Электролитическая ионизация (диссоциация)
Доказательства реальности ионизации (продолжение)
2. Выводы из экспериментов по
изучению коллигативных свойств растворов электролитов. Коллигативные свойства – такие, которые
позволяют определить суммарную долю частиц растворенных компонентов. Так, оказывается, что при образовании разбавленного NaCl в воде количество частиц в воде удваивается по сравнению с предположением о молекулах NaCl, а для BaBr2 и Na2SO4 – утраивается.
3. Огромные скорости реакций с участием сильных электролитов при слабой зависимости их от температуры.
4. Высокая электропроводность растворов сильных электролитов даже малых напряжениях (наиболее слабое доказательство).
Важно! Ионизация происходит только при наличии взаимодействия ионов с молекулами растворителя – сольватации (для водных растворов – гидратации или акватирования).
Слайд 9Количественные характеристики электролитической ионизации (диссоциации)
1. Степень ионизации (ионизации) .
где
– количество распавшихся молекул, а – общее к-во молекулярного
вещества i, введенного в раствор.
2. Константа ионизации (диссоциации). Ее можно вводить на том основании, что ионные равновесия подчиняются закону термодинамическому закону действующих масс.
Для ионизации
AwBz = wAz+ + zBw-
Важно! Связь Кс с концентрациями Сi можно использовать только для разбавленных растворов (Ci 0,1 М).
Слайд 10Итак, ионизации AwBz = wAz+ + zBw-
Пример:
(1) (2)
Связь между степенью ионизации и константой KC:
Пусть в растворе содержится фосфат ртути (II) с изначальной (до установления равновесия) концентрацией С0. Исходя из стехиометрии реакции (1) заключаем, что СHg2+= 3C0, СPO43– = 2C0, а концентрация нераспавшихся молекул фосфата ртути будет СHg3(PO4)2 = C0(1-). Тогда
Слайд 11
Для более простых (и более часто встречающихся) равновесий вида AB
= A+ + B–
получаем
.
Это выражение можно упростить для случая не слишком разбавленного раствора слабого электролита (KC < 10 –4), используя приближение (1 – ) 1.
Тогда
. (3)
О силе электролитов. Деление очень условное, но часто электролит считают сильным при KC > 10 –1; средней силы, если 10 –4 KC 10 –1 и слабым при KC < 10 –4.
Слайд 12Из вопросов определения концентраций различных ионов выделяется своей важностью вопрос
об определении концентраций ионов водорода (СH+). Для удобства сравнения концентраций
используют логарифмическую шкалу pH:
pH = –lg(СH+)
Предположим, надо найти pH раствора уксусной кислоты (KC = 1,75410–5), который готовился как 0,12 М водный раствор.
Решение. Из стехиометрии равновесия HAc = H+ + Ac– (где Ac– = CH3COO–) имеем СH+= СAc–.
Тогда
.
Решая это квадратное уравнение получаем СH+= 1,4410-3;
pH = –lg(СH+) = 2,84.
Слайд 13В каких пределах может изменяться pH?
Для ответа на вопрос рассмотрим
самоионизацию воды.
H2O = H+ + OH– (4) ;
KC = (СH+СOH–)/СH2O (5)
Для разбавленных растворов СH2O = const.
Тогда KC СH2O = const = Kw (так обозначим).
Kw = СH+СOH–. (Kw – т.н. ионное произведение воды)
Для t = 25 С (и не слишком высоких P) Kw = 10–14.
Рассчитаем pH для чистой жидкой воды. Из стехиометрии
Равновесия (4) следует, что для чистой воды
СH+ = СOH–
!! Только если нет щелочных или кислотных примесей !!
Тогда Kw = (СH+)2 СH+ = (Kw)½ = 10 –7 pH = 7.
Вывод: pH чистой воды (и растворов инертных в кислотно-щелочном отношении веществ) = 7.
Слайд 14Как быть, если нужно рассчитать pH раствора щелочи, например, 0,1
М раствора KOH
Считаем, что KOH ионизируется почти целиком:
KOH K+
+ OH–.
Тогда из стехиометрии реакции С0(KOH) = COH– = 0,1 M.
Исходя из выражения Kw = СH+СOH– имеем СH+ = Kw /СOH–;
СH+ = 10– 14/0,1 = 10– 14/10– 1 = 10– 13; pH = 13.
Найдем теперь pH 0,1 M раствора сильной кислоты, например, HNO3. Ионизация идет практически нацело:
HNO3 H+ + NO3–; вкладом в pH ионизации воды можно пренебречь. Тогда С0(HNOз) = СH+ = 0,1 М; pH = 1.
Вывод: в случае использования простых соотношений между KC и Ci pH принимает значения от 1 до 13.
А при использовании в более сложных соотношений коридор значений pH немного расширяется: от –1 до 15.