Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электролиз расплавов и растворов электролитов
Содержание
- 1. Электролиз расплавов и растворов электролитов
- 2. Электролиз- это окислительно - восстановителный процесс, протекающий
- 3. Закон электролиза Первый закон электролиза ФарадеяМасса вещества,
- 4. Электролиз в расплавахНа
- 5. Электролиз расплава NаCl К(-)
- 6. Слайд 6
- 7. Электролитическое рафинирование (очистка) меди. Неочищенная медь, которая
- 8. Изменение восстановительной активности анионовАнионы по их способности
- 9. Электролиз раствора поваренной соли
- 10. Применение электролизаЭлектрометаллургия: а) получение активных металлов (K,
- 11. Применение электролиза
- 12. получение щелочей, хлора, водорода
- 13. Гальваностегия
- 14. Скачать презентанцию
Электролиз- это окислительно - восстановителный процесс, протекающий на электродах в растворах или расплавах электролитов при про пускании электрического тока.
Слайды и текст этой презентации
Слайд 1Электролиз расплавов и растворов электролитов
Ф.И.О. Студента: Басова Анна Сергеевна
|Ф.И.О Преподавателя: Кривенко Алина Александровна | Учебное заведение «КЭМТ»
Слайд 2Электролиз- это окислительно - восстановителный процесс, протекающий на электродах в
растворах или расплавах электролитов при про пускании электрического тока.
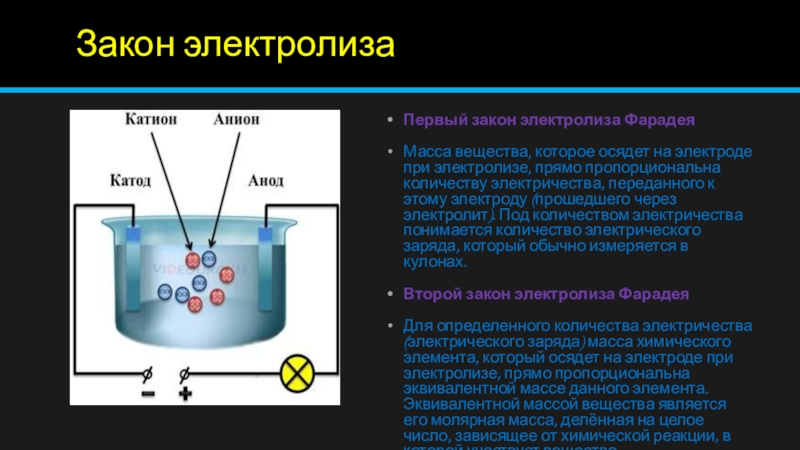
Слайд 3Закон электролиза
Первый закон электролиза Фарадея
Масса вещества, которое осядет на
электроде при электролизе, прямо пропорциональна количеству электричества, переданного к этому
электроду (прошедшего через электролит). Под количеством электричества понимается количество электрического заряда, который обычно измеряется в кулонах.Второй закон электролиза Фарадея
Для определенного количества электричества (электрического заряда) масса химического элемента, который осядет на электроде при электролизе, прямо пропорциональна эквивалентной массе данного элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество
Слайд 4 Электролиз в расплавах
На катоде происходит процесс
восстановления
Мn+ +
nē = М0На аноде происходит процесс окисления В расплавах анионы бескислородных кислот (кроме фторидов) окисляются до соответствующего простого вещества, например: 2Cl– – 2ē = Cl20
Кислородсодержащие анионы выделяют кислород и превращаются в один из оксидов:
SO42– – 2ē = SO20 + O20.
Слайд 5Электролиз расплава NаCl
К(-)
NaCl А(+)
↓
← Na+ + Cl- → Na+ + 1ē = Na0 2Cl- - 2ē = Cl2
электролиз
2NaCl 2Na + Cl2
Слайд 6
Процесс на аноде
В растворах
процесс на аноде зависит от материала анода и
от природы аниона. Аноды могут быть двух видов – растворимые (железо, медь, цинк, серебро и все металлы, которые окисляются в процессе электролиза) и нерастворимые, или инертные (уголь, графит, платина, золото)а) Если анод растворимый, то независимо от природы аниона всегда идет окисление металла анода, например:
Cu0 – 2ē = Cu2+
б) Если анод инертный, то в случае бескислородных анионов (кроме фторидов) идет окисление анионов:
2Cl– – 2ē = Cl20
Слайд 7Электролитическое рафинирование (очистка) меди.
Неочищенная медь, которая является анодом, растворяется,
т. е. переходит в раствор соли меди в виде ионов.
Энергия электрического тока расходуется на перенос этих ионов к катоду, их восстановление и осаждение чистой меди (степень чистоты – 99,95%). Примеси (Ag, Au и другие благородные металлы), которые имеют больший стандартный электродный потенциал, не окисляются, а выпадают в осадок на дне ванны, тем самым окупая расходы на проведение рафинирования меди. Данный процесс – одно их старейших электрохимических производств. Впервые этот метод был применен в России в 1847 г.Слайд 8Изменение восстановительной активности анионов
Анионы по их способности окисляться располагаются в
следующем порядке:
I-, Br-, S2-, Cl-, OH-, SO42-, NO3-, F-
Восстановительная активность уменьшается
Слайд 10Применение электролиза
Электрометаллургия: а) получение активных металлов (K, Na, Ca, Mg,
Al и др.) электролизом расплавов природных соединений;
б) получение металлов средней активности (Zn, Cd, Co) электролизом растворов их солей.В химической промышленности – получение газов: F2, Cl2, H2, O2; щелочей: NaOH, KOH; пероксида водородаH2O2, тяжелой воды D2O и др.
Электролитическое рафинирование – очистка металлов (Cu, Pb, Sn и др.) от примесей электролизом с применением активных (растворимых) анодов.
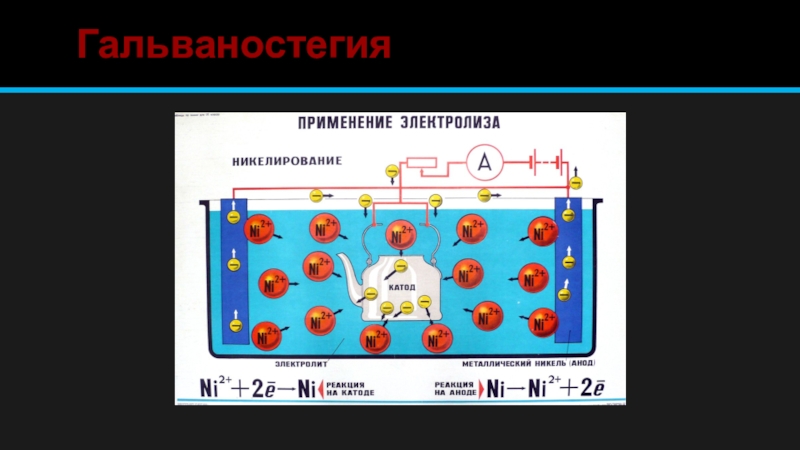
Гальваностегия – нанесение металлических покрытий на поверхность металлического изделия для защиты от коррозии или придания декоративного вида. Например, оцинковка, хромирование, никелирование и пр.
Гальванопластика – получение металлических копий с различных матриц, а также покрытие неметаллических предметов слоем металлов. Последний процесс (золочение деревянных статуй и ваз) был известен еще в Древнем Египте, но научные основы гальванопластики были заложены русским ученым Б. Якоби в 1838 г.