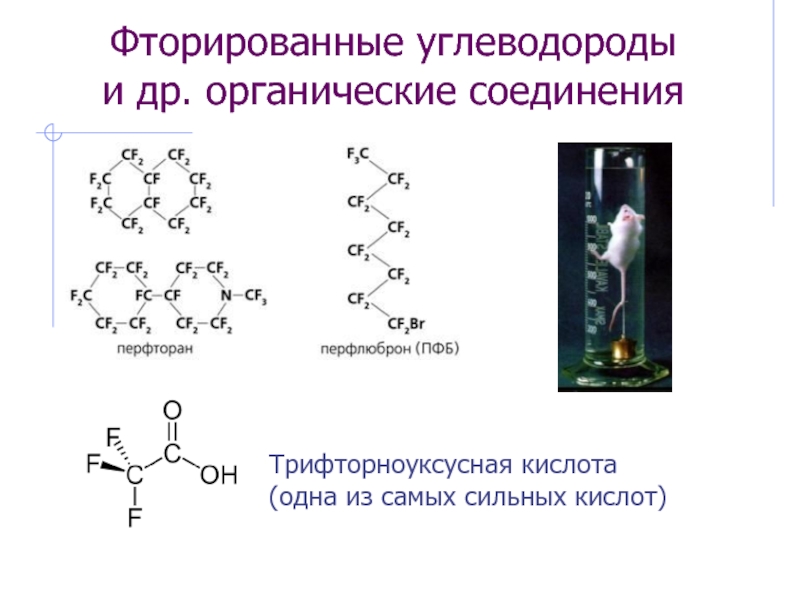
ns 2 (n–1)d 10np 5
Ковалентность:
F: I, II(д/а мех.), (III-IV –
д/а, редко)Cl, Br, I, At: I, III, V, VII (II-IV – д/а, ред.)
Hal стремятся образовать анион Hal–
Степени окисления:
F: –1, 0
Cl, Br, I, At: –1, 0, +1, +3, +5, +7 (+4 ред.)
![Презентация на тему Элементы VIIА-группы (галогены) Группа самых электроотрицательных элементов Общая Элементы VIIА-группы (галогены) Группа самых электроотрицательных элементов Общая электронная формула: […] ns 2 (n–1)d 10np 5Ковалентность:F: I,](/img/thumbs/ddd84e67daf43ac11022df31ed4c4ac8-800x.jpg)
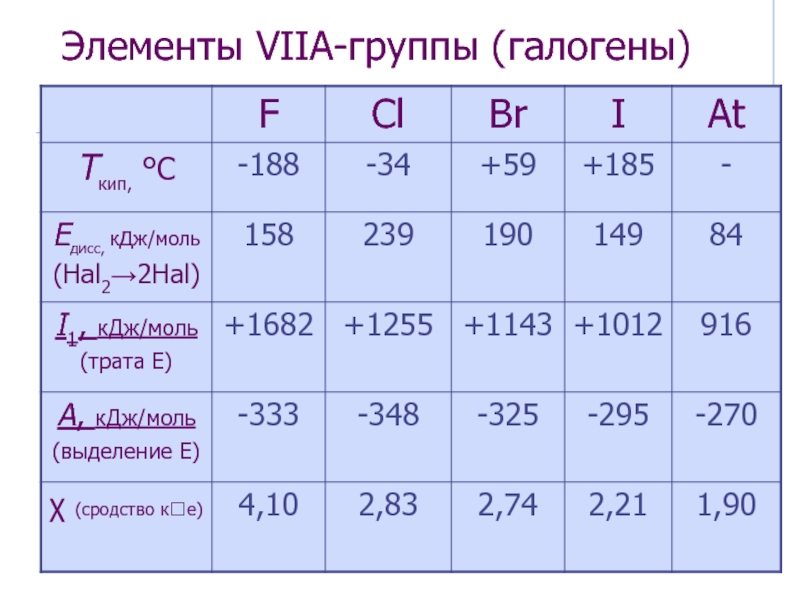

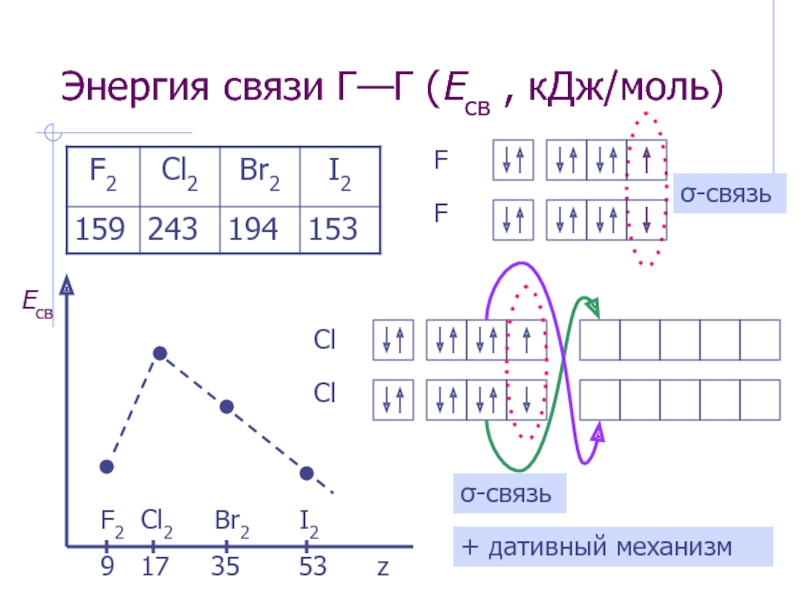
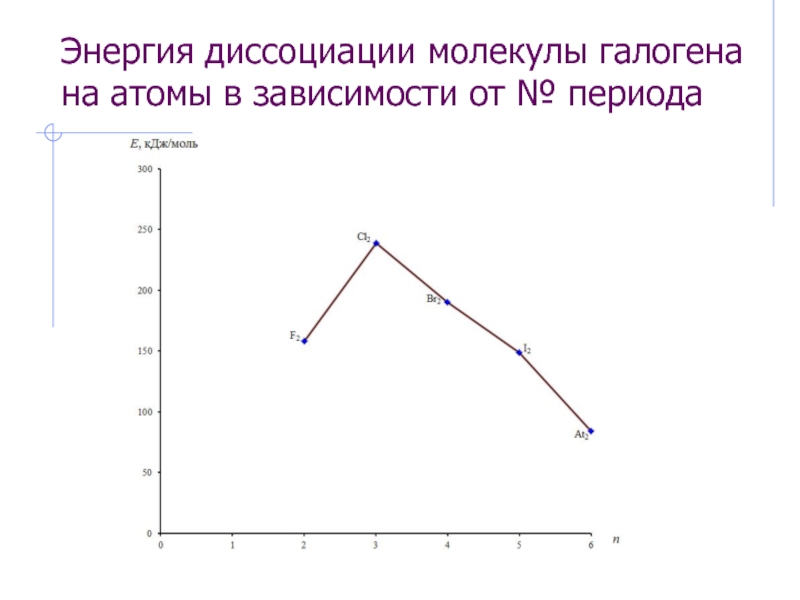






![Элементы VII А-группы (галогены) Группа самых электроотрицательных элементов Фтороводородная (плавиковая) кислота[H3O]+F-[H3O]+[HF2]-[H3O]+[H3F4]-Специфическая ионизация р-ровHF и специфический гидролизводных р-ров фторидов:F- + HOH HF2- + OH- Фтороводородная (плавиковая) кислота[H3O]+F-[H3O]+[HF2]-[H3O]+[H3F4]-Специфическая ионизация р-ровHF и специфический гидролизводных р-ров фторидов:F- + HOH HF2- + OH-](/img/thumbs/11880b08646816f5e88a5ea501641647-800x.jpg)