Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ХАРАКТЕРИСТИКА ХИМИЧЕСКОГО ЭЛЕМЕНТА НА ОСНОВАНИИ ЕГО ПОЛОЖЕНИЯ В ПЕРИОДИЧЕСКОЙ
Содержание
- 1. ХАРАКТЕРИСТИКА ХИМИЧЕСКОГО ЭЛЕМЕНТА НА ОСНОВАНИИ ЕГО ПОЛОЖЕНИЯ В ПЕРИОДИЧЕСКОЙ
- 2. ОСНОВНЫЕ ОПРЕДЕЛЕНИЯ Основания – это сложные вещества, состоящие
- 3. ПЛАН ХАРАКТЕРИСТИКИ ХИМИЧЕСКОГО ЭЛЕМЕНТА Положение элемента в Периодической
- 4. ИЗМЕНЕНИЕ СВОЙСТВ АТОМОВ, ПРОСТЫХ ВЕЩЕСТВ И СОЕДИНЕНИЙ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ Д.И. МЕНДЕЛЕЕВА.
- 5. ХАРАКТЕРИСТИКА МЕТАЛЛА. МАГНИЙ. II группа (главная), 3 период
- 6. ХАРАКТЕРИСТИКА НЕМЕТАЛЛА. СЕРА. IV группа (главная), 3 период
- 7. Классная работа:§ 1, упр. 1,7,10.
- 8. Домашнее задание: учебник за 8 класс §
- 9. Скачать презентанцию
ОСНОВНЫЕ ОПРЕДЕЛЕНИЯ Основания – это сложные вещества, состоящие из ионов металлов и связанных с ним гидроксид-ионов. Для них характерны взаимодействия с кислотами, оксидами неметаллов, солями. Кислоты – сложные вещества, молекулы которых состоят
Слайды и текст этой презентации
Слайд 1ХАРАКТЕРИСТИКА ХИМИЧЕСКОГО ЭЛЕМЕНТА НА ОСНОВАНИИ ЕГО ПОЛОЖЕНИЯ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ
Д.И. МЕНДЕЛЕЕВА.
Слайд 2
ОСНОВНЫЕ ОПРЕДЕЛЕНИЯ
Основания – это сложные вещества, состоящие из ионов металлов
и связанных с ним гидроксид-ионов. Для них характерны взаимодействия с
кислотами, оксидами неметаллов, солями.Кислоты – сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка. Для них характерны реакции с основаниями, оксидами металлов, металлами, солями.
Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков. Для них характерны реакции с кислотами, щелочами, солями, металлами.
Оксиды – соединения металлов или неметаллов с кислородом. (Если с металлом, то оксид основный, если с неметаллом – кислотный).
Слайд 3
ПЛАН ХАРАКТЕРИСТИКИ ХИМИЧЕСКОГО ЭЛЕМЕНТА
Положение элемента в Периодической системе Д.И. Менделеева
и строение его атомов (номер группы (главная/побочная), номер периода (большой/малый),
количество протонов (p+), нейтронов (n0), электронов (e-), атомная масса (А), строение электронной оболочки).Характер простого вещества (металл/неметалл).
Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами.
Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по периоду элементами.
Состав высшего оксида, его характер (основный, кислотный, амфотерный).
Состав высшего гидроксида, его характер (кислородсодержащая кислота, основание, амфотерный гидроксид).
Состав летучего водородного соединения (для неметаллов).
Слайд 4
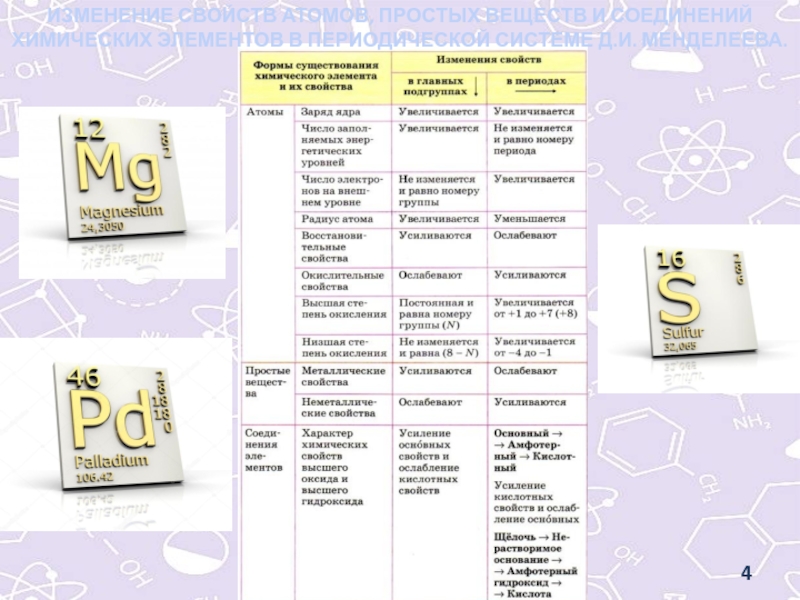
ИЗМЕНЕНИЕ СВОЙСТВ АТОМОВ, ПРОСТЫХ ВЕЩЕСТВ И СОЕДИНЕНИЙ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ В
ПЕРИОДИЧЕСКОЙ СИСТЕМЕ Д.И. МЕНДЕЛЕЕВА.
Слайд 5
ХАРАКТЕРИСТИКА МЕТАЛЛА. МАГНИЙ.
II группа (главная), 3 период (малый), p+ =
12, n0 = 12, e- = 12, Ar(Mg) = 24,
электронная конфигурация 1s22s22p63s2Для магния – простого вещества – характерна металлическая кристаллическая решетка и металлическая химическая связь, металлический блеск, высокая теплопроводность, высокая электропроводность, высокие температуры кипения и плавления.
Металлические свойства у магния выражены сильнее, чем у бериллия, но слабее, чем у кальция.
Металлические свойства у магния выражены слабее, чем у натрия, но сильнее чем у алюминия.
Оксид магния MgO является основным оксидом и проявляет типичные свойства основных оксидов.
В качестве гидроксида магнию соответствует основание Mg(OH)2, которое проявляет все характерные свойства оснований.
Летучего водородного соединения магний не образует.
Слайд 6
ХАРАКТЕРИСТИКА НЕМЕТАЛЛА. СЕРА.
IV группа (главная), 3 период (малый), p+ =
16, n0 = 16, e- = 16, Ar(S) = 32,
электронная конфигурация 1s22s22p63s23р4Для серы – простого вещества неметалла – характерна явление аллотропии (разные простые вещества, образованные одним элементом, имеют различные свойства). Для серы характерна молекулярная кристаллическая решетка.
Неметаллические свойства у серы выражены слабее, чем у кислорода, но сильнее, чем у селена.
Неметаллические свойства у серы выражены сильнее, чем у фосфора, но слабее чем у хлора.
Высший оксид серы имеет формулу SO3. Это кислотный оксид. Он проявляет все типичные свойства кислотных оксидов.
Высший гидроксид серы – серная кислота H2SO4, раствор которой проявляет все типичные свойства кислот.
Сера образует летучее водородное соединение – сероводород H2S.
Слайд 8Домашнее задание:
учебник за 8 класс § 39, 40, 41,
42.
учебник за 9 класс § 1, упр. 2, 3,
4, 6, 8.Принести тетради для лабораторных и проверочных работ (12 листов) в клетку.
Подготовиться к тесту.