Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кремний( Si ) и Углерод( C )
Содержание
- 1. Кремний( Si ) и Углерод( C )
- 2. Сравнительная характеристика элементов IV группы главной
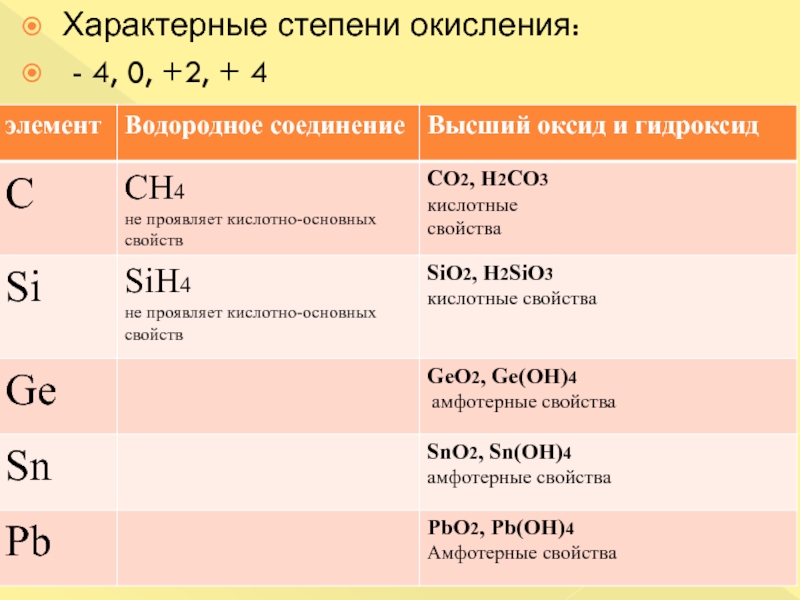
- 3. Характерные степени окисления: - 4, 0, +2, + 4
- 4. Изотопы элементов 4 группыПри выяснениии механизма реакций
- 5. Происхождение названия углерода Международное название происходит от
- 6. Углерод в природе
- 7. Углерод в природеУглерод — биогенный элемент; его
- 8. Разновидности углерода
- 9. Алмазкристаллическое вещество, прозрачное, сильно преломляет лучи света,
- 10. Название «графит», происходящее от греческого слова, означающего
- 11. Применение графитаГрафитовый порошок – изготовление минеральных красок.
- 12. Карбинмелкокристаллический порошок чёрного цвета, полупроводник. По твердости
- 13. Фуллеренискусственно полученная модификация углерода, состоящая из молекул.
- 14. Алмаз, графит, фуллерен, карбин…..Вопрос: Как называется явление существования нескольких простых веществ, образованных одним химическим элементом?
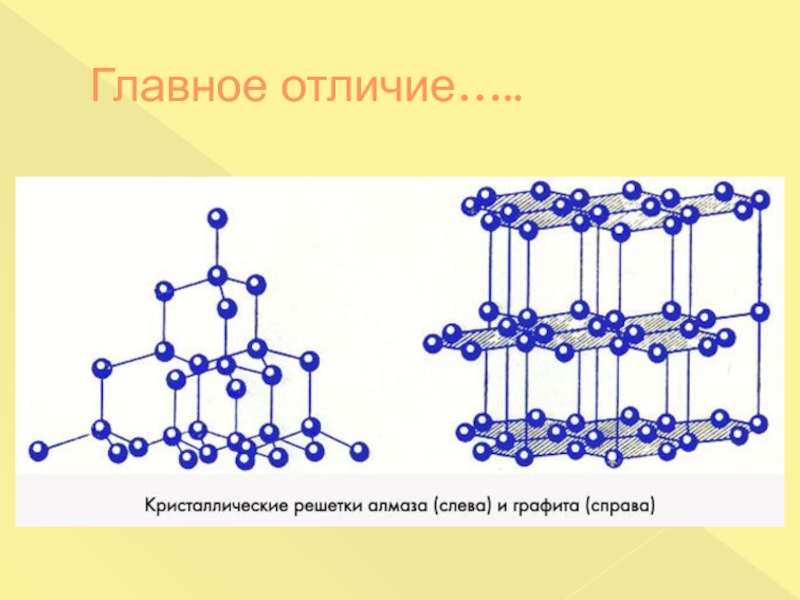
- 15. Почему? Почему алмаз твёрдый, а графит –
- 16. Главное отличие…..
- 17. Литературная загадка… В сказке Владимира Федоровича Одоевского
- 18. Древесный уголь Адсорбция Образуется при разложении
- 19. Угольные фильтры В бытовых фильтрах, в промышленном
- 20. Сажа Сажа - черный дисперсный продукт
- 21. коксПредставляет собой твердое пористое вещество серого цвета,
- 22. Химические свойства углеродаС неметаллами С
- 23. С металлами С+ Ca
- 24. Со сложными веществами: C+ H2O CO
- 25. Уравнять реакции с помощью электронного баланса С
- 26. Обобщение определите, в каких реакциях углерод
- 27. С помощью учебника и схемы-конспекта подготовить отчет
- 28. Оксиды углерода
- 29. Оксиды углерода
- 30. Оксиды углерода
- 31. Экологические акценты Изменение климата планеты вследствие концентрации
- 32. Литературная загадка…В произведении В. Короткевича «Черный замок
- 33. Химия и литератураВ произведении В.Д. Одоевского «Мороз
- 34. Угольная кислотаПри растворении углекислого газа в воде
- 35. Химия и литератураВ романе Г.Р. Хаггарда «Клеопатра»
- 36. Карбонаты 1) Карбонаты металлов (кроме щелочных) при
- 37. Кремний Природные соединения
- 38. Физические свойства SiВещество темно-серого цвета с металлическим
- 39. Химические свойства Si
- 40. СилицидыСилициды – соединения кремния с металлами и
- 41. Силан SiH4По физическим свойствам силаны сходны с
- 42. Химические свойстваSiH4 + 2O2 = SiO2 +
- 43. получениеОбразуются при действии на силицид магния соляной кислотой:Mg2Si + 4HCl = 2MgCl2 + SiH4.
- 44. Оксид Кремния IV– кислотный оксид В природе
- 45. Слайд 45
- 46. Слайд 46
- 47. Кремниевая кислота Получение: только косвенным путём, из
- 48. СиликатыБольшинство нерастворимо в воде, кроме силикатов натрия
- 49. Слайд 49
- 50. Запомни тривиальные названия веществ:Na2CO3— кальцинированная содаNaHCO3 (гидрокарбонат
- 51. Вопрос 1Число электронов на внешнем энергетическом уровне атома углерода равно:6234
- 52. Заряд ядра атома кремния равен:+6+4+14+28
- 53. В ряду C — Si — Ge — Sn неметаллические свойства элементов:уменьшаютсяувеличиваютсяне изменяютсясначала уменьшаются, затем увеличиваются
- 54. Наиболее устойчивой аллотропной модификацией углерода является:карбинграфиталмазполикумулен
- 55. Какие реакции осуществимы:CaCO3 CaCO3 + 2HCl →CaCO3 + 2NaCl →CaCO3 + 2NaNO3 →
- 56. Сокращенному ионному уравнению 2H+ + CO32- =
- 57. Кремниевую кислоту можно получить из:CaSiO3 и CO2SiO2 и H2ONa2SiO3 и HCl CaSiO3 и H2O
- 58. Силан образуется при взаимодействии:кремния и водородаоксида кремния
- 59. В лаборатории углекислый газ получают в аппарате
- 60. Наличие углекислого газа можно доказать c помощью:NaClCa(OH)2H2SO4Na2CO3
- 61. Метан выделяется при разложении водой следующего карбида:CaC2BaC2Al4C3Ag2C2
- 62. Ядовитый газ фосген имеет следующий элементарный состав
- 63. Через раствор, содержащий 16,8 г гидроксида калия,
- 64. Объем углекислого газа (н. у.), полученного при
- 65. К растворе массой 150г, в котором массовые
- 66. 1. Число электронов на внешнем уровне атома
- 67. 4. Углерод является окислителем в реакции.1) Са
- 68. 1. Число электронов на внешнем уровне атома
- 69. 4. Углерод является окислителем в реакции.1) 2Н2
- 70. Программа А1. Выберите правильный ответ.Оксиды металлов могут бытьа)
- 71. 4Выберите правильный ответСокращенное ионное уравнение реакции оксидов
- 72. Допишите уравнения химических реакций, определите окислитель и восстановитель:PbO+CO→;Fe2O3 + CO →CO+ O2 →
- 73. Слайд 73
- 74. Скачать презентанцию
Сравнительная характеристика элементов IV группы главной подгруппыНа внешнем слое 4 валентных электрона, электронная конфигурация ns2np2
Слайды и текст этой презентации
Слайд 2Сравнительная характеристика
элементов IV группы главной подгруппы
На внешнем слое 4
валентных электрона, электронная конфигурация ns2np2
Слайд 4Изотопы элементов 4 группы
При выяснениии механизма реакций иногда используют изотоп
углерода 13С
(метод меченных атомов).
Поэтому полезно знать, что распространённость изотопов
углерода: 12С - 98.89 % и 13С - 1.11 %.
у кремния таких изотопа 3,
у германия - 5, у олова - 10,
у свинца 4 стабильных изотопа.
Слайд 5Происхождение названия углерода
Международное название происходит от латинского carbo — уголь, связанного
с древним корнем kar — огонь. Этот же корень в латинском
cremare — гореть, а возможно, и в русском «гарь», «жар», «угореть» (в древнерусском «угорати» — обжигать, опалять). Отсюда — и «уголь».Слайд 7Углерод в природе
Углерод — биогенный элемент; его соединения играют особую
роль в жизнедеятельности растительных и животных организмов (среднее содержание углерода
— 18%).Углерод широко распространён в космосе; на Солнце он занимает 4-е место после водорода, гелия и кислорода.
Слайд 9Алмаз
кристаллическое вещество, прозрачное, сильно преломляет лучи света, очень твёрдое, не
проводит электрический ток, плохо проводит тепло. В вакууме или в
инертном газе при повышенных температурах постепенно переходит в графитПрименение:
Изготовление бриллиантов – огранённые алмазы сильно преломляют свет.
Для резки стекла, металлов, наконечники свёрл («алмазные жала»), буров и резцов – благодаря твёрдости.
Алмазный порошок – для полировки и огранки драгоценных камней (рубинов) – твёрдость.
Слайд 10Название «графит», происходящее от греческого слова, означающего «писать», предложено А.Вернером
в 1789
Распространенный в природе минерал. Встречается обычно в виде
отдельных чешуек, пластинок и скоплений, разных по величине и содержанию .Графит – мягкое вещество черного или серого цвета со слабым металлическим блеском, жирное на ощупь, проводит электрический ток..Самая устойчивая аллотропная модификация углерода.
Искусственно получают: нагреванием смеси кокса или каменного угля с пеком;
Слайд 11Применение графита
Графитовый порошок – изготовление минеральных красок.
Смазочный материал (в
смеси с маслом) – между отдельными слоями графита взаимодействие настолько
слабо, что возникает скольжение.Графитовые стержни – электроды – электропроводность.
Изготовление простых карандашей.
Слайд 12Карбин
мелкокристаллический порошок чёрного цвета, полупроводник. По твердости карбин превосходит графит,
но значительно уступает алмазу.
Состоит из цепей, образованных участками: -С
С-С С- (карбин) или =С=С=С=С= (поликумулен). Получен искусственным путем.Слайд 13Фуллерен
искусственно полученная модификация углерода, состоящая из молекул. Это черные вещества
с металлическим блеском, обладающие свойствами полупроводников.
Назван по имени американского инженера
и архитектора Р.Б. ФуллераВиды молекул фуллеренов: чётное число атомов углерода в молекуле С60, С70, С72, С74, С76, С108, С960 и т.д. Поверхность «мяча» образована пяти- и шестиугольниками с общими рёбрами. Форма близка к сфере.
Применение:
Запоминающие устройства
Сверхпроводники
Лекарства с противоопухолевой активностью
Слайд 14Алмаз, графит, фуллерен, карбин…..
Вопрос: Как называется явление существования нескольких простых
веществ, образованных одним химическим элементом?
Слайд 15Почему?
Почему алмаз твёрдый, а графит – мягкий?
Почему графит оставляет
следы на бумаге, а алмаз может резать стекло?
Почему из графита
делают электроды, а из алмазов – ювелирные изделия?Как вы думаете, можно ли получить из графита алмаз, а из алмаза – графит? Почему?
Будет ли гореть графит? А алмаз? Почему?
Что общего у алмаза и графита?
Слайд 17Литературная загадка…
В сказке Владимира Федоровича Одоевского «Мороз Иванович» есть
отрывок: «между тем Рукодельница воротится, воду процедит, в кувшин нальет,
да еще какая затейница: коли вода не чиста, так свернет лист бумаги, наложит в нее угольков да песку крупного насыплет, вставит ту бумагу в кувшин, да нальет в нее воды, а вода-то, знай, проходит сквозь песок да сквозь уголья и капает в кувшин чистая, словно хрустальная…»Вопрос: Какие методы очистки воды использует рукодельница?
Слайд 18Древесный уголь
Адсорбция
Образуется при разложении древесины без доступа воздуха.
Обладает способностью к адсорбции – способностью поглощать различные вещества. Это
явление используется для очистки сахара, спирта, в фильтре противогаза. Активированный уголь прокаливают на перегретом пару, число пор при этом увеличивается, что улучшает адсорбцию.Н.Д.Зелинский в годы первой мировой войны изобрёл противогаз
Слайд 19Угольные фильтры
В бытовых фильтрах, в промышленном производстве, на очистных
сооружениях – уголь поглощает вредные вещества из воды
Слайд 20Сажа
Сажа - черный дисперсный продукт неполного сгорания или термического
разложения углеродистых веществ. В технике получают из углеводородов (отсюда другое
название сажи - технический углерод). Используют в производстве резины, пластмасс, пигмент для лакокрасочных материалов и др.Слайд 21кокс
Представляет собой твердое пористое вещество серого цвета, получаемое коксованием каменного
угля. Физико-химические свойства каменноугольного кокса по общим характеристикам они близки
к свойствам графита.Область применения: Каменноугольный кокс применяют главным образом в доменном процессе для выплавки чугуна (доменный кокс). Кокс здесь служит одновременно топливом и восстановителем железной руды.
в химической промышленности,
цветной металлургии и др.
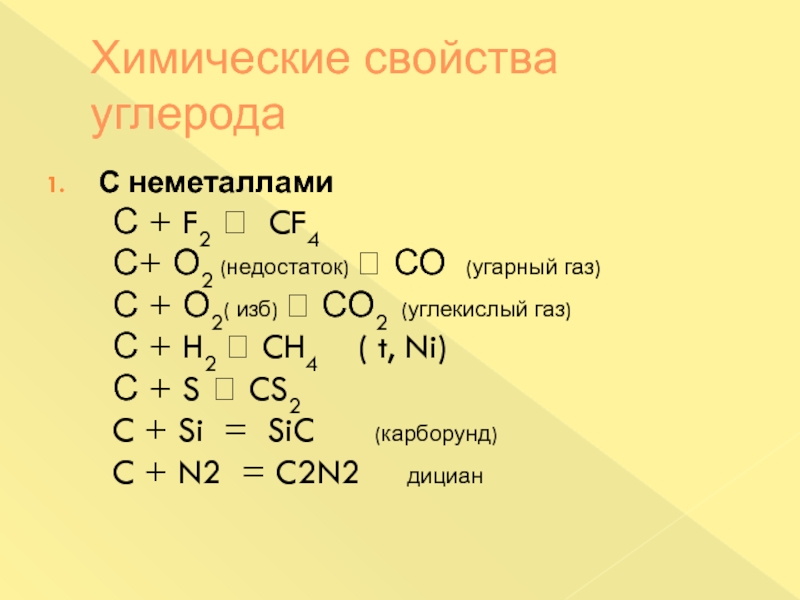
Слайд 22Химические свойства углерода
С неметаллами
С + F2
CF4
С+ О2 (недостаток) СО (угарный газ)
С + О2( изб) СО2 (углекислый газ)С + H2 CH4 ( t, Ni)
С + S CS2
C + Si = SiC (карборунд)
C + N2 = C2N2 дициан
Слайд 23С металлами
С+ Ca CaC2
карбид
С+ Al Al4С3
С + Na Na2C2Карбиды- это соединения углерода с металлами
Карбиды, при гидролизе которых образуется метан – «метаниды»: Al4C3, Be2C
Al4С3+12HCl =4AlCl3+ 3CH4
Карбиды, при гидролизе которых получается ацетилен – «ацетилениды»:
Na2C2, Ag2C2, CaC2
СаС2+2Н2O=Са(OH)2+С2Н2
Ag2C2 + 2HCl = 2AgCl + C2H2
Слайд 24Со сложными веществами:
C+ H2O CO + H2 (синтез
газ) с парами воды при t
С оксидами тяжелых металлов -
пирометаллургияC+ ZnO Zn + CO ( t)
С+Fe3O4 Fe + 4CO ( t)
2C+BaSO4=BaS+2CO2
C+ CaO = CaC2 + CO
C + SiO2 = CO +Si
С + CO2 = CO эндотермическая р-ция
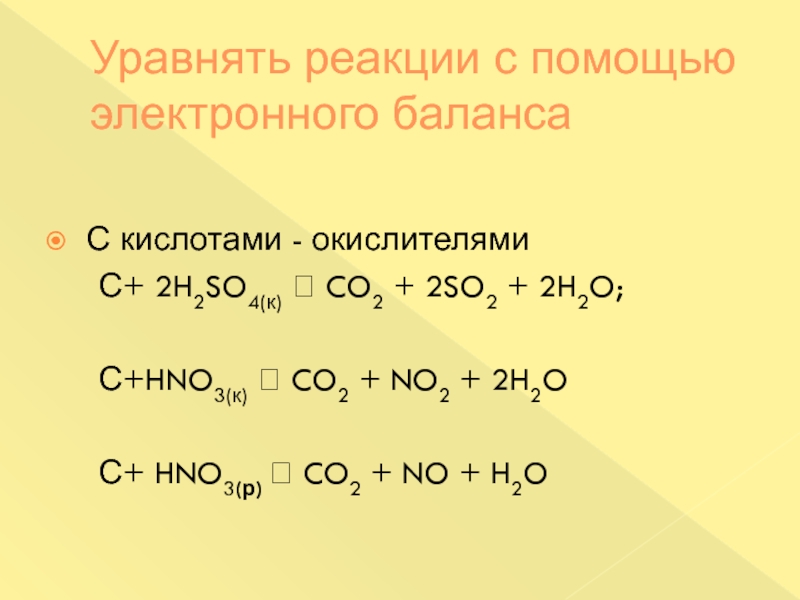
Слайд 25Уравнять реакции с помощью электронного баланса
С кислотами - окислителями
С+ 2H2SO4(к) CO2 + 2SO2 + 2H2O;
С+HNO3(к) CO2 + NO2 + 2H2OС+ HNO3(р) CO2 + NO + H2O
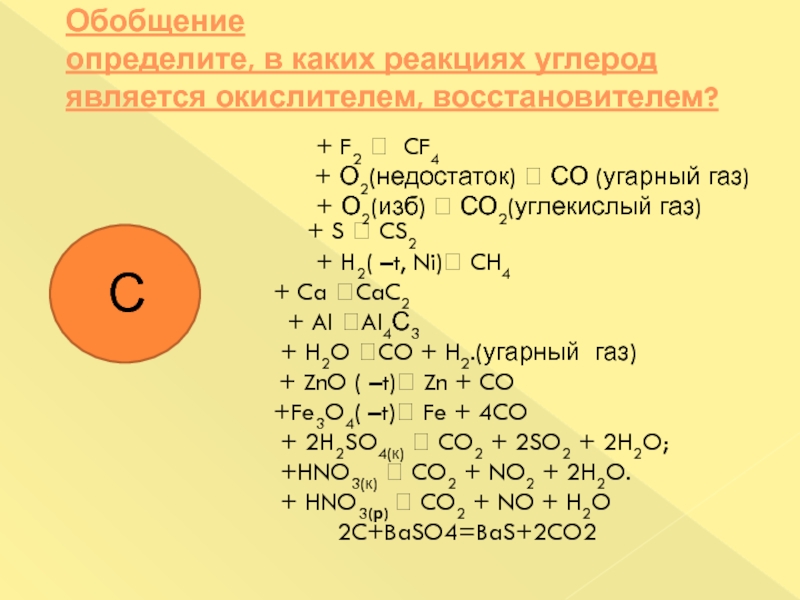
Слайд 26Обобщение
определите, в каких реакциях углерод является окислителем, восстановителем?
+ F2 CF4
+ О2(недостаток) СО (угарный газ)
+ О2(изб) СО2(углекислый газ) + S CS2
+ H2( –t, Ni) CH4
+ Ca CaC2
+ Al Al4С3
+ H2O CO + H2.(угарный газ)
+ ZnO ( –t) Zn + CO
+Fe3O4( –t) Fe + 4CO
+ 2H2SO4(к) CO2 + 2SO2 + 2H2O;
+HNO3(к) CO2 + NO2 + 2H2O.
+ HNO3(р) CO2 + NO + H2O
2C+BaSO4=BaS+2CO2
С
Слайд 27С помощью учебника и схемы-конспекта подготовить отчет группы по плану:
Формула оксида, степени окисления элемента в нем.
Название по номенклатуре и
тривиальное.Нахождение в природе.
Тип химической связи в молекуле.
Тип кристаллической решетки.
Физические свойства.
Химические свойства.
Применение.
Слайд 31Экологические акценты
Изменение климата планеты вследствие концентрации парниковых газов в атмосфере
является на сегодняшний день одной из основных глобальных экологических проблем.
Примерно 80% парникового эффекта приходится на углекислый газ, около 15% - на метан, остальные газы составляют менее 5 %. В настоящее время уровень углерода выше на 30%, чем был 250 лет назад, и при этом, увеличение произошло в основном во второй половине 20-го столетия вследствие антропогенной деятельности. Необходимо учитывать, что из всех наземных природных экосистем, охваченных хозяйственной деятельностью, леса вносят наибольший вклад в формирование углеродного баланса планеты. Снизить содержание углерода в атмосфере и способствовать предотвращению дальнейшего изменения климата может лесной сектор, который обладает значительным потенциалом снижения эмиссии парниковых газов. Суть парникового эффекта состоит в том, что углекислый газ поглощает инфракрасные лучи и мешает отведению тепла от поверхности земли.Слайд 32Литературная загадка…
В произведении В. Короткевича «Черный замок Ольшанский. Дикая охота
короля Стаха» мы читаем: «…- Вы слышали об эффекте «собачьей
пещеры» в Италии?.. Есть там такая пещера – яма. Человек войдет и ходит, а собака или кролик погибают через несколько минут.- Почему?
- Из вулканической трещины выделяется углекислый газ… А поскольку он…»
Задание: Закончите фразу. Объясните «загадочную гибель животных».
Слайд 33Химия и литература
В произведении В.Д. Одоевского «Мороз Иванович» пишется: «…
а я затем в окошки стучусь, - отвечал Мороз Иванович,
- а не то, ведь я знаю, есть такие неряхи, что печку истопить истопят, а трубу закрыть не закроют, да не вовремя, когда еще не все угольки прогорели, а оттого в горнице угарно бывает, голова у людей болит, в глазах зелено, даже и совсем от угара умереть можно»Вопрос: Угарный газ – сильный яд! Чем это объясняется? Какова первая помощь при отравлении угарным газом?
Слайд 34Угольная кислота
При растворении углекислого газа в воде образуется очень слабая
угольная кислота Н2СО3, которую в свободном состоянии из водных растворов
выделить нельзя, т.к. она распадается на СО2 и Н2О.Слайд 35Химия и литература
В романе Г.Р. Хаггарда «Клеопатра» читаем: « …
она вынула из уха одну из тех огромных жемчужин… и…
опустила жемчужину в уксус. Наступило молчание, потрясенные гости, замерев, наблюдали, как несравненная жемчужина медленно растворяется в крепком уксусе. Вот от нее не осталось и следа, и тогда Клеопатра подняла кубок, покрутила его, взбалтывая уксус, и выпила весь до последней капли»Вопрос: объясните растворение жемчужины, запишите уравнение реакции, если формула уксусной кислоты СН3СООН
Слайд 36
Карбонаты
1) Карбонаты металлов (кроме щелочных) при нагревании разлагаются:
CuCO3 –t CuO + CO2
2) При пропускании углекислого
газа из карбонатов образуются гидрокарбонаты: СаСО3 + СО2 + Н2О = Са(НСО3)2.3) Гидрокарбонаты разлагаются до карбонатов:
2NaHCO3 –t Na2CO3 + H2O + CO2.
4) Карбонаты и гидрокарбонаты вступают в обменные реакции:
а) с сильными кислотами (качественная реакция на карбонаты):
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑;
б) с растворимыми солями и основаниями, если образуется осадок:
Na2CO3 + Ва(ОН)2 = ВаСО3 ↓+ 2NaOH
Na2CO3 + СаСl2 = СаСО3 ↓+ 2NaCl
5) Гидрокарбонаты реагируют со щелочами, образуя средние соли:
КНСО3 + КОН = К2СО3 + Н2О
Кремний – типичный неметалл, может быть окислителем и восстановителем
Слайд 38Физические свойства Si
Вещество темно-серого цвета с металлическим блеском, довольно хрупок
. Второй по распространенности элемент на Земле после кислорода. Встречается
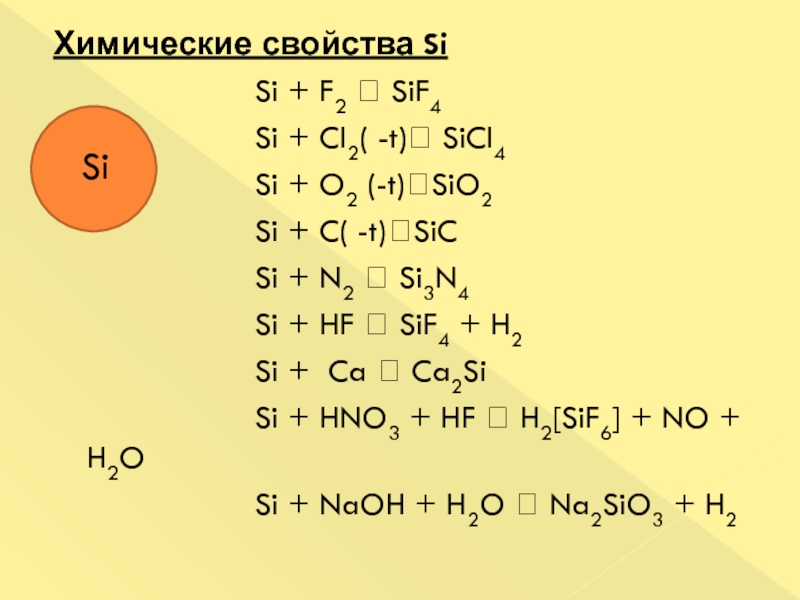
только в виде соединений. Оксид кремния образует большое количество природных веществ – горный хрусталь, кварц, кремнезем. Применение кремния и его соединений. Кремний используется в электронике для изготовления полупроводниковых приборов. Диоксид кремния применяется для производства стекла, керамики, бетонных изделий и кирпича. Чистый кварц используется в приборостроении.Слайд 39Химические свойства Si
Si + F2 SiF4
Si + Cl2( -t) SiCl4Si + O2 (-t)SiO2
Si + C( -t)SiC
Si + N2 Si3N4
Si + HF SiF4 + H2
Si + Ca Ca2Si
Si + HNO3 + HF H2[SiF6] + NO + H2O
Si + NaOH + H2O Na2SiO3 + H2
Si
Слайд 40Силициды
Силициды – соединения кремния с металлами и неметаллами, в которых
кремний имеет степень окисления -4.
Ca2Si + 2H2SO4 = 2CaSO4
+ SiH4.(силан). Среди таких силицидов наибольшее значение имеет карбид кремния – карборунд SiC, имеющий структуру алмаза.
Получение:
2Mg + Si = Mg2Si,
2MgO + SiO2 + 4C = Mg2Si + 4CO
Слайд 41Силан SiH4
По физическим свойствам силаны сходны с углеводородами. Моносилан SiH4
и дисилан Si2Н6 являются бесцветными газами с неприятным запахом,
трисилан
Si3Н8 — бесцветная, ядовитая, летучая жидкость. Высшие члены гомологического ряда — твёрдые вещества. Силаны воспламеняются на воздухе, Si2Н6 взрывается при контакте с воздухом.
Наиболее термически устойчивым является моносилан
Силаны чрезвычайно легко окисляются.
Моносилан в присутствии кислорода окисляется со вспышкой даже при температуре жидкого воздуха. В зависимости от условий реакции, продуктом окисления является либо SiO2, либо промежуточные вещества:
Слайд 42Химические свойства
SiH4 + 2O2 = SiO2 + 2Н2O
(самовоспламенение на
воздухе)
Активно взаимодействует со щелочами:
SiH4 + 2NaOH + H2O =
Na2SiO3 + 4H2.При наревании разлагается:
SiH4 = Si + 2H2.
Слайд 43получение
Образуются при действии на силицид магния соляной кислотой:
Mg2Si + 4HCl
= 2MgCl2 + SiH4.
Слайд 44Оксид Кремния IV– кислотный оксид
В природе – речной песок, кварц.
1)
Не реагирует с водой – т.к. кремниевая кислота нерастворима.
2) При
сплавлении реагирует со щелочами: SiO2 + 2KOH = K2SiO3 + H2O3) Реагирует с основными оксидами: SiO2 + MgО = MgSiO3
С карбонатами, фосфатами и сульфитами щелочных металлов: при сплавлении обр. газы:
SiO2 + K2CO3 = K2SiO3 + CO2
SiO2+Са3(РО4)2 = Р2О5+СаSiO3
SiO2+ CaSO3 = SO2+ СаSiO3
4) Из кислот растворяется только в плавиковой:
SiO2 + 6HF = H2[SiF6] + 2H2O
5) При температуре выше 1000 °С реагирует с активными металлами, при этом образуется кремний: SiO2 + 2Mg = Si + 2MgO
или при избытке восстановителя – силициды:
SiO2 + 4Mg = Mg2Si + 2MgO.
6) Взаимодействие с неметаллами.
Реагирует с водородом: SiO2 + 2Н2 = Si + 2Н2O,
Взаимодействует с углеродом: SiO2 + 3С = SiС + 2СO
Слайд 47Кремниевая кислота
Получение: только косвенным путём, из солей:
Na2SiO3 +
2HCl = H2SiO3↓ + 2NaCl
Na2SiO3 + 2Н2O + 2CO2 =
2NaHCO3 +H2SiO3↓,Свойства:
1)Растворяются в концентрированных щелочах: H2SiO3 +4KOH = K2SiO3 + + 4H2O
2)Разлагаются при нагревании:
H2SiO3 = SiO2 + H2O
Слайд 48Силикаты
Большинство нерастворимо в воде, кроме силикатов натрия и калия, их
называют «жидким стеклом».
Получение:
1) растворение кремния, кремниевой кислоты или оксида
в щелочи:H2SiO3 + 4KOH K2SiO3 + 4H2O
Si + 2NaOH + H2O = Na2SiO3 + H2
SiO2 + 2KOH K2SiO3 + H2O сплавление
2) Сплавление оксидов:
СаО + SiO2 CaSiO3
3) Взаимодействие солей:
K2SiO3 + CaCl2 = CaSiO3 + 2KCl
Стекло – тоже силикат.
Слайд 50Запомни тривиальные названия веществ:
Na2CO3— кальцинированная сода
NaHCO3 (гидрокарбонат натрия) — пищевая
сода, натрий двууглекислый (устар.), бикарбонат натрия
Na2CO3·10H2O - стиральная сода
NaOH -
Сода каустическая, Натр едкийK2CO3 - углекислый калий, пота́ш
CaCO3 - Карбонат кальция (углекислый кальций), мел, мрамор, известняк
(CuOH)2CO3 – Малахит
CaSO4•2H2O - гипс
Слайд 53В ряду C — Si — Ge — Sn неметаллические
свойства элементов:
уменьшаются
увеличиваются
не изменяются
сначала уменьшаются, затем увеличиваются
Слайд 56Сокращенному ионному уравнению 2H+ + CO32- = H2O + CO2
соответствует взаимодействие между:
HCl и Na2CO3(раствор)
CaCO3т и HCl(раствор)
Na2CO3 и H2SiO3
BaCO3
и HNO3Слайд 58Силан образуется при взаимодействии:
кремния и водорода
оксида кремния и водорода
силицида магния
и соляной кислоты
силицида магния и воды
Слайд 59В лаборатории углекислый газ получают в аппарате Киппа взаимодействием раствора
соляной кислоты с карбонатом кальция. Почему его нельзя заменить карбонатом
натрия?карбонат натрия не реагирует с водой
карбонат натрия растворяется в воде
карбонат натрия бурно реагирует с соляной кислотой
карбонат натрия нерастворим в воде
Слайд 62Ядовитый газ фосген имеет следующий элементарный состав в массовых долях:
С — 12,1%, О — 16,2%, Cl — 71,7%. Его
формула:C2O2Cl
COCl
COCl2
CO2Cl
Слайд 63Через раствор, содержащий 16,8 г гидроксида калия, пропустили углекислый газ
объемом 6,72 л (н. у.). В результате образовалась соль, массой:
60
г30 г
15 г
3 г
Слайд 64Объем углекислого газа (н. у.), полученного при прокаливании 10,92 г
гидрокарбоната натрия и практическом выходе 92%, равен:
13.4 л
1.34 л
2.68 л
1.58
лСлайд 65К растворе массой 150г, в котором массовые доли NaOH и
Na2CO3 соответсвенно равны 1,87% и 2,83%, добавили некоторое количество NaHCO3,
при этом массовая доля NaOH снизилась до 1,05%. Найдите массовые доли остальных веществ в растворе (включая воду)Слайд 661. Число электронов на внешнем уровне атома углерода.
1) 6; 2)
2; 3) 3; 4) 4; 5) 12.
2. Кристаллическая решетка у
алмаза…1) молекулярная; 2) ионная; 3) атомная; 4) металлическая.
3. Углерод проявляет восстановительные свойства в реакции.
1) Са + 2С = СаС2;
2) С+ 2FeO = Fe + CO;
3) CO2 + Li2O = Li2CO3;
4) 4Al + 3C = Al4C3.
Слайд 674. Углерод является окислителем в реакции.
1) Са + 2С =
СаС2; 2) СО2+ ВаO = ВаCO3;
3) CO2 + Li2O
= Li2CO3; 4) Н2О + С = СО + Н2.
5. Применяется в качестве термостойкого смазочного материала и для изготовления грифелей карандашей.
1) алмаз; 2) графит;
3) карбин; 4) уголь;
Слайд 681. Число электронов на внешнем уровне атома кремния:
1) 6; 2)
2; 3) 3; 4) 4; 5) 12.
2. Кристаллическая решетка у
графита…1) молекулярная; 2) ионная; 3) атомная; 4) металлическая.
3. Углерод проявляет восстановительные свойства в реакции.
1) Ti + С = TiС;
2) С+ ZnO = Zn + CO;
3) CO2 + Na2O = Na2CO3; 4) CO2 + 2KOH = K2CO3 + H2O
Слайд 694. Углерод является окислителем в реакции.
1) 2Н2 + С =
СН4; 2) СО2+ ВаO = ВаCO3;
3) 3С+ 2Fe2O3 =
4Fe + 3CO2; 4) С + О2 = СО25. Применяется для резки стекла и шлифования драгоценных камней:
1) графит; 2) алмаз; 3) карбин; 4) уголь;
Слайд 70Программа А
1. Выберите правильный ответ.
Оксиды металлов могут быть
а) кислотными и основными
б)
основными и несолеобразующими
в) кислотными и несолеобразующими
2. Установите
соответствия.Характер свойств оксида Вещество
1. Кислотный 1.Оксид углерода (II)
2. Основной 2. Оксид углерода (IV)
3. Несолеобразующий 3. Оксид кремния (IV)
4. Амфотерный
3.Выберите правильные ответы.
Кислотные оксиды реагируют с
а) кислотами
б) щелочами
в) солями
г) основными оксидами
д) водой
е) кислотными оксидами
Программа В
Слайд 714Выберите правильный ответ
Сокращенное ионное уравнение реакции оксидов кремния (IV) или
углерода (IV) с раствором щелочи имеет вид
а) RO2 + 2OH-
= RO32- + H2OБ) RO2 + 2 Na+ + 2OH- =Na 2RO3 + H2O
в) RO2 + 2OH- = RO32-+ 2Н+
Программа С
5Выберите правильный ответ
Вокислительно-восстановительных реакциях оксид углерода (IV) может проявлять свойства
а) окислителя
б) восстановителя
в) окислителя и восстановителя
6Выберите правильный ответ
Вокислительно-восстановительных реакциях оксид углерода (II) может проявлять свойства
а) окислителя
б) восстановителя
в) окислителя и восстановителя