Слайд 1Лекция 2.
Молекулярный уровень живой материи.
Химический состав живых организмов. Биологическая
роль воды.
Строение, классификация и свойства аминокислот.
Пептидная связь. Белки. Ферменты. Катализ
и энергия активации.
Кофакторы (коферменты). Скорость ферментативных реакций. Классификация ферментов.
Слайд 21. Химический состав живых организмов. Биологическая роль воды.
Все живые системы
содержат в различных соотношениях химические элементы и построенные из них
химические органические и неорганические соединения.
Слайд 3Макроэлементы
Макроэлементы составляют до 99 % массы клетки, из которых до
98 % приходится на 4 элемента: О, N, Н и
С. Эти элементы способны образовывать ковалентные связи.
О, Н и N образуют и одинарные, и двойные связи, благодаря чему получаются самые разнообразные химические соединения.
Поскольку атомы углерода легко вступают в ковалентные связи с кислородом, азотом и серой, органические молекулы достигают исключительной сложности и разнообразия.
Слайд 4Макроэлементы
В меньших количествах клетки содержат К, Na, Mg, Ca, S,
P, Fe. Каждый из них выполняет важную функцию в клетке.
Например, ионы Na+, K+ и Cl- обеспечивают проницаемость клеточных мембран и проведение импульса по нервному волокну.
Са и Р участвуют в формировании костной ткани.
Са является также одним из факторов, влияющих на процесс свертывания крови.
Fe входит в состав гемоглобина.
Mg в клетках зеленых растений является компонентом хлорофилла, а в клетках животных он находится в составе ряда ферментов.
Слайд 5Микроэлементы
Микроэлементы – преимущественно ионы металлов (Co, Zn, Cu и др.)
и галогенов (I, Br и др.).
Они содержатся в количествах
от 0,001 % до 0,000001 %.
Микроэлементы встречаются главным образом в специализированных клетках, где участвуют в образовании биологически активных веществ.
Например, Zn входит в молекулу гормона поджелудочной железы инсулина, I – компонент гормона щитовидной железы тироксина и т. д.
Слайд 6Ультрамикроэлементы.
Их концентрация ниже 0,000001 %. Такие количества называют следовыми.
К
микроэлементам относят Au, Hg, Se и др.
Слайд 7Биологическая роль воды:
1. Вода – растворитель для органических и неорганических
веществ. Большинство реакций в клетке проходит между растворенными в воде
веществами. В форме растворов также вещества проникают в клетку и выводятся из нее.
2. Вода обеспечивает осмос – это односторонняя диффузия молекул воды в направлении раствора большей концентрации. Давление, с которым вода проникает через мембрану называется осмотическим. Два раствора с одинаковым осмотическим давлением независимо от химического состава растворенных веществ называются изотоническими, более концентрированные растворы – это гипертонические, менее концентрированные – гипотонические.
Слайд 83. На явлении осмоса основаны движение воды по проводящей системе
растений от корней к листьям и напряжение стенок растительных клеток
– тургор. Создавая в клетках повышенне давление, вода придает упругость (тургор) листьям, цветкам, стеблям травянистых растений.
4. Химическая функция воды: при участии ферментов вода вступает в реакции гидролиза, расщепляя крупномолекулярные соединения до низкомолекулярных.
5. Вода обладает хорошей теплопроводностью и большой теплоемкостью, поэтому температура внутри клетки (и организма) более устойчива, чем в окружающей среде.
Слайд 92. Строение, классификация и свойства аминокислот.
Слайд 10Строение аминокислот
Аминогруппа H2N- обладает свойствами основания; карбоксильная группа -СООН –
кислотная, характерная для всех органических кислот.
Следовательно, аминокислоты – амфотерные,
совмещающие свойства кислот и оснований.
Общая формула
всех аминокислот
В простейшей
аминокислоте
– глицине –
роль R играет
атом водорода.
Слайд 11Растения синтезируют все необходимые им аминокислоты из более простых веществ.
В отличие от них животные не могут синтезировать все аминокислоты,
в которых они нуждаются, часть из них они должны получать в готовом виде, т. е. с пищей. Эти аминокислоты принято называть незаменимыми (лейцин, изолейцин, метионин, фенилаланин, треонин, валин).
Слайд 12Классификация аминокислот
По вариациям в строении радикала выделяют следующие группы аминокислот:
-
основные аминокислоты – с более чем одной аминогруппой (аланин, гистидин,
лизин);
- кислые аминокислоты – с более чем одной карбоксильной группой (аспарагиновая и глутаминовая кислоты);
- содержащие серу аминокислоты (цистеин, метионин). Цистеин способен к образованию дополнительных связей – дисульфидных мостиков;
- содержащие амидогруппу СО – NН2 (аспарагин, глутамин);
- содержащие ароматическую группировку (фенилаланин, триптофан, тирозин).
Слайд 13Свойства аминокислот
Аминокислоты – бесцветные кристаллические твердые вещества, растворимые в воде
и нерастворимые в органических растворителях.
В нейтральных водных растворах аминокислоты существуют
в виде биполярных ионов и ведут себя как амфотерные соединения. Это обеспечивает способность аминокислот в растворах действовать как буферы, т е препятствовать изменениям рН.
Для каждой аминокислоты свойственно определенное значение рН. Если при этом значении рН поместить аминокислоту в электрическое поле, она не будет перемещаться ни к катоду, ни к аноду. Значение рН, соответствующее этому электрически нейтральному состоянию, называется изоэлектрической точкой данной аминокислоты.
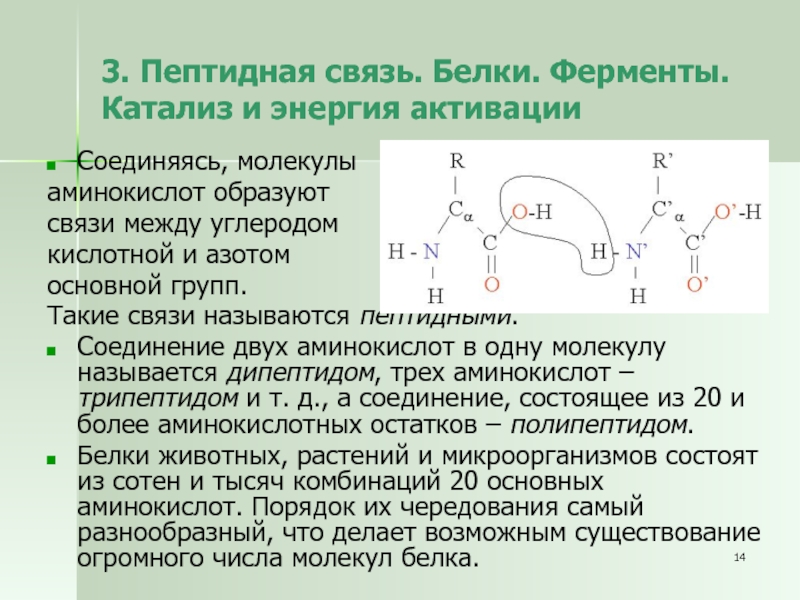
Слайд 143. Пептидная связь. Белки. Ферменты. Катализ и энергия активации
Соединяясь, молекулы
аминокислот образуют
связи между углеродом
кислотной и азотом
основной групп.
Такие
связи называются пептидными.
Соединение двух аминокислот в одну молекулу называется дипептидом, трех аминокислот – трипептидом и т. д., а соединение, состоящее из 20 и более аминокислотных остатков – полипептидом.
Белки животных, растений и микроорганизмов состоят из сотен и тысяч комбинаций 20 основных аминокислот. Порядок их чередования самый разнообразный, что делает возможным существование огромного числа молекул белка.
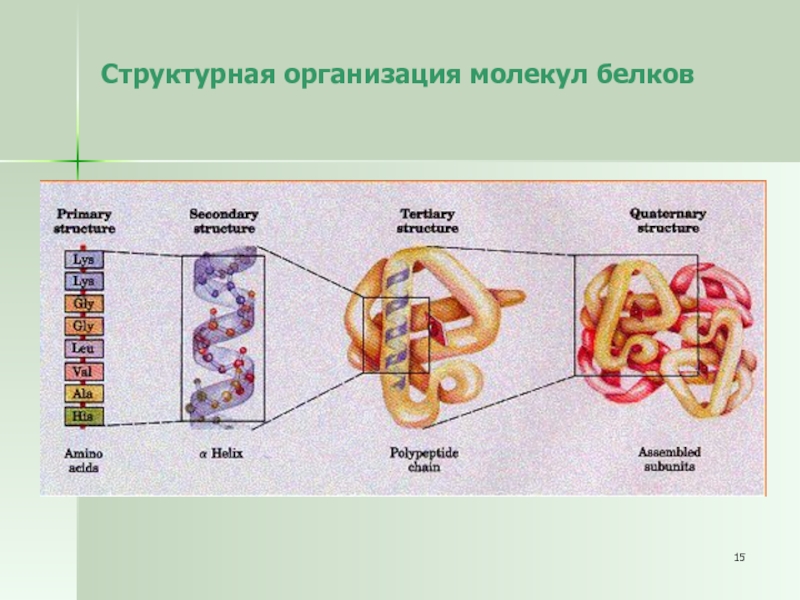
Слайд 15Структурная организация молекул белков
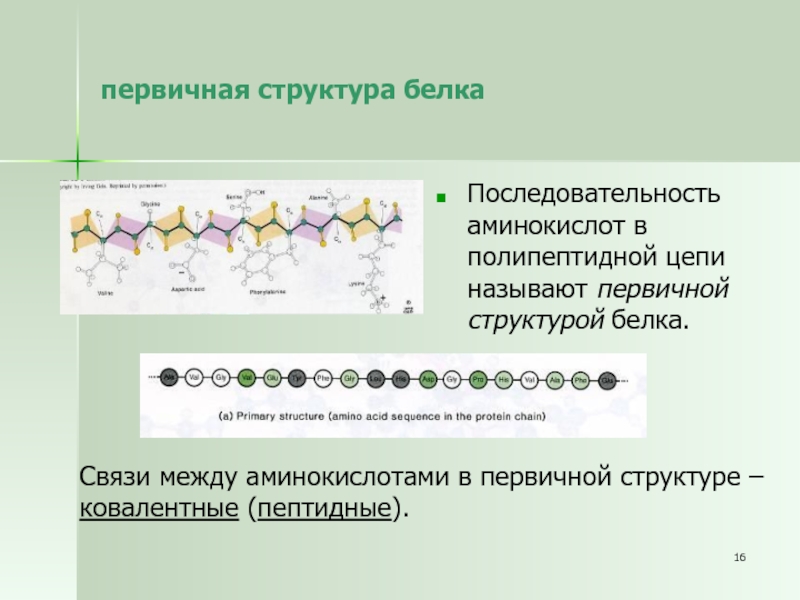
Слайд 16первичная структура белка
Последовательность аминокислот в полипептидной цепи называют первичной структурой
белка.
Связи между аминокислотами в первичной структуре –
ковалентные (пептидные).
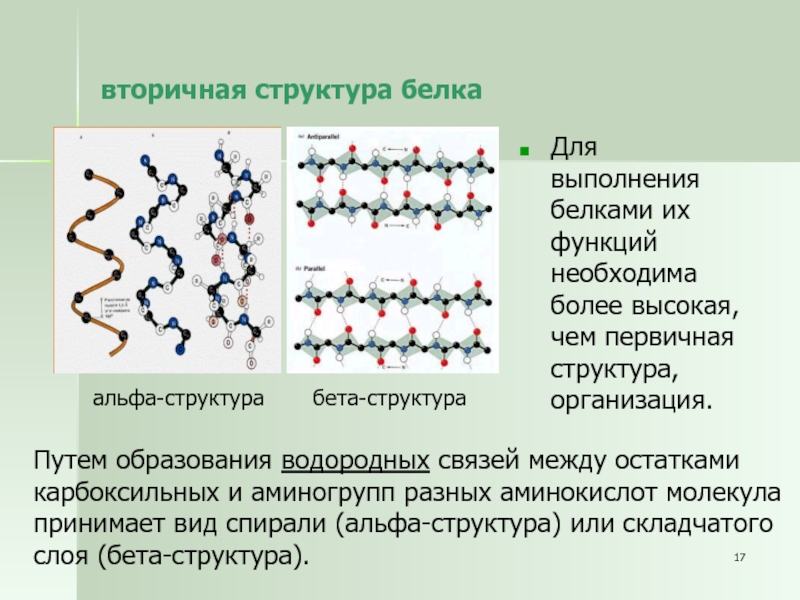
Слайд 17вторичная структура белка
Для выполнения белками их функций необходима более высокая,
чем первичная структура, организация.
Путем образования водородных связей между остатками
карбоксильных и
аминогрупп разных аминокислот молекула
принимает вид спирали (альфа-структура) или складчатого
слоя (бета-структура).
альфа-структура
бета-структура
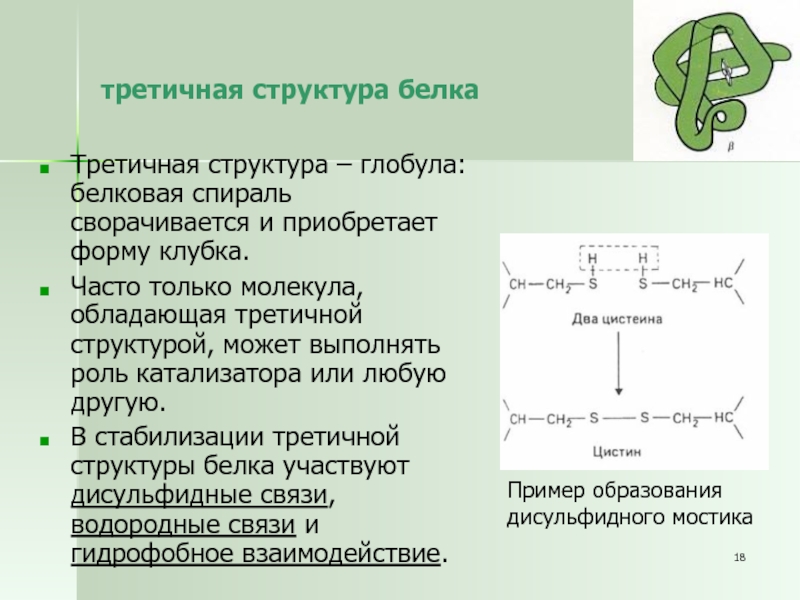
Слайд 18третичная структура белка
Третичная структура – глобула: белковая спираль сворачивается и
приобретает форму клубка.
Часто только молекула, обладающая третичной структурой, может выполнять
роль катализатора или любую другую.
В стабилизации третичной структуры белка участвуют дисульфидные связи, водородные связи и гидрофобное взаимодействие.
Пример образования
дисульфидного мостика
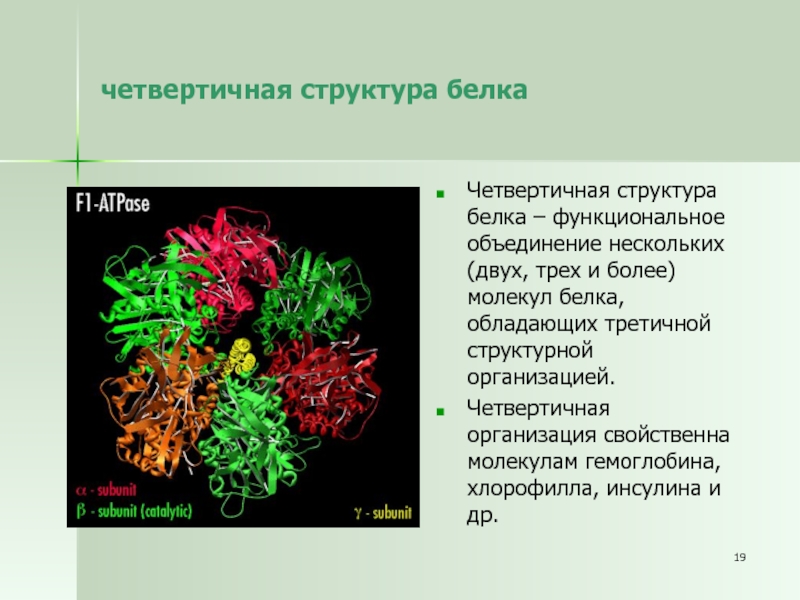
Слайд 19четвертичная структура белка
Четвертичная структура белка – функциональное объединение нескольких (двух,
трех и более) молекул белка, обладающих третичной структурной организацией.
Четвертичная организация
свойственна молекулам гемоглобина, хлорофилла, инсулина и др.
Слайд 20Свойства белков
Белки – преимущественно водорастворимые молекулы и могут проявлять свою
функциональную активность только в растворах.
Белковые молекулы несут большой поверхностный заряд.
Это определяет целый ряд электрохимических эффектов, например, изменение проницаемости мембран.
Белки термолабильны, т. е. проявляют свою активность в узких температурных пределах.
При изменении условий структурная организация белков разрушается (в первую очередь четвертичная, в последнюю – первичная структуры). Это – денатурация. Если первичная структура остается ненарушенной, возможен обратный процесс – ренатурация – свойство белков полностью восстанавливать утраченную структуру.
Слайд 21Функции белков
Белковые молекулы благодаря особенностям своей структуры и разнообразию организации
способны выполнять самые разнообразные функции. Это самые главные рабочие молекулы
в любом живом организме.
Ферментативная
Структурная
Двигательная
Транспортная
Защитная
Регуляторная
Энергетическая
Слайд 22Ферментативная функция: ферменты - это белки, ответственные за проведение всех
биохимических реакций в любом организме. Обычно каждой реакции соответствует отдельный
фермент. Ферменты выполняют роль катализаторов.
Катализ – «развязывание, освобождение». Вещества, относимые к катализаторам, ускоряют химические превращение, причем состав самих катализаторов после реакции остается таким же, каким он был до реакции.
Слайд 23
Химическая реакция с термодинамической точки зрения возможна только при затрате
некоторого количества энергии, необходимого для ее запуска. Это энергия активации
процесса (Еа). Чем больше Еа, тем ниже скорость реакции при данной температуре. Ферменты, действуя как катализаторы, понижают энергию активации реакции. Они повышают общую скорость реакции, практически не изменяя при этом температуры, при которой эта реакция протекает.
Сущность катализа: исходные вещества образуют с катализатором промежуточные соединения, которые быстро превращаются в конечные продукты, а катализатор восстанавливается в первоначальном виде.
Слайд 24Ферменты высокоспецифичны: каждый катализирует только те реакции, в которых участвуют
молекулы только какого-нибудь одного или нескольких видов.
У фермента есть активный
центр. Форма и строение его таковы, что с ним могут связываться только определенные субстраты
Ф – фермент, С – субстрат, П - продукт
Слайд 25Структурная функция: белки входят в состав абсолютно всех клеточных органелл
и мембран. Из белковых молекул могут состоять целые части организма
Двигательная
функция: благодаря белкам сокращаются все мышцы и работают двигательные органоиды клеток
Слайд 26Транспортная функция: транспорт веществ из клетки и внутрь ее.
Защитная
функция: особые белки - антитела -ответственны за то, что клетки
иммунной системы распознают и уничтожают чужеродные структуры во внутренней среде организма.
Регуляторная функция: некоторые гормоны (например, инсулин) имеют белковую природу.
Энергетическая функция: молекулы белков содержат связи, богатые энергией, поэтому в крайних случаях (при остром недостатке углеводов и липидов) белки и аминокислоты могут расщепляться с высвобождением энергии (17,6 кДж на 1 г белка).
Слайд 274. Кофакторы (коферменты). Скорость ферментативных реакций. Классификация ферментов
Многим ферментам для
эффективной работы требуются те или иные небелковые компоненты – кофакторы
(или коферменты). Их роль могут играть различные вещества: неорганические ионы (напр. Cl в амилазе слюны), простетические группы (напр. гем гемоглобина), витамины.
Витамины требуются обычно в очень малых количествах,
потому что коферменты, подобно самим ферментам,
в реакции не разрушаются и могут использоваться многократно
Молекула гемоглобина
Слайд 28Скорость ферментативных реакций
Мерой скорости ферментативной реакции служит количество субстрата, подвергшееся
превращению в единицу времени, или количество образовавшегося продукта реакции.
На скорость
ферментативной реакции влияют следующие факторы:
концентрация фермента,
концентрация субстрата,
температура,
рН.
Слайд 291 – концентрация фермента
При высокой концентрации субстрата и при постоянстве
других факторов скорость ферментативной реакции пропорциональна концентрации фермента.
Концентрация фермента
V ферм.
реакции
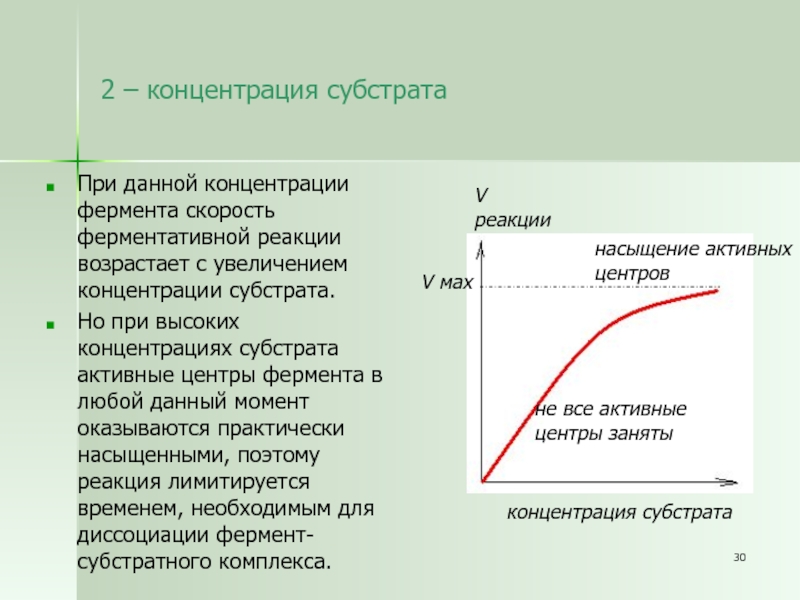
Слайд 302 – концентрация субстрата
При данной концентрации фермента скорость ферментативной реакции
возрастает с увеличением концентрации субстрата.
Но при высоких концентрациях субстрата
активные центры фермента в любой данный момент оказываются практически насыщенными, поэтому реакция лимитируется временем, необходимым для диссоциации фермент-субстратного комплекса.
концентрация субстрата
V
реакции
насыщение активных
центров
не все активные
центры заняты
V мах
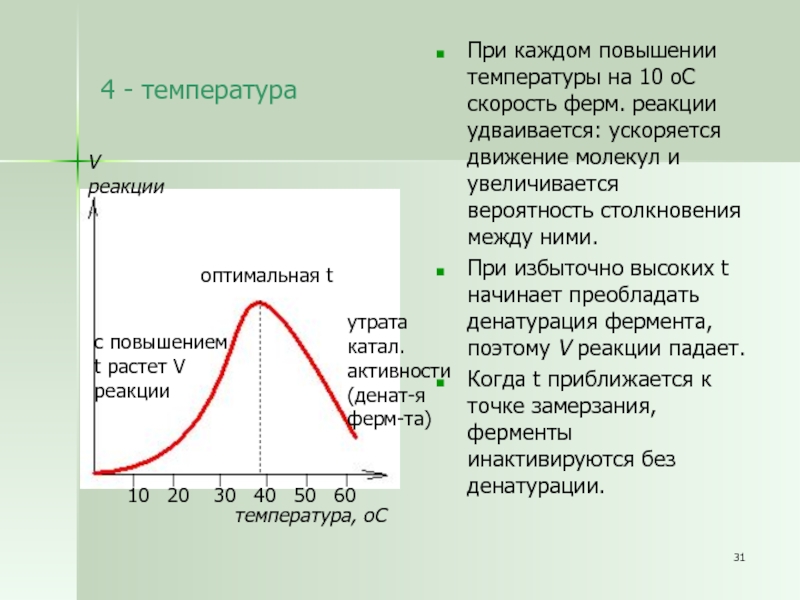
Слайд 314 - температура
При каждом повышении температуры на 10 оС скорость
ферм. реакции удваивается: ускоряется движение молекул и увеличивается вероятность столкновения
между ними.
При избыточно высоких t начинает преобладать денатурация фермента, поэтому V реакции падает.
Когда t приближается к точке замерзания, ферменты инактивируются без денатурации.
V
реакции
температура, оС
10
20
30
40
50
60
с повышением
t растет V
реакции
оптимальная t
утрата
катал.
активности
(денат-я
ферм-та)
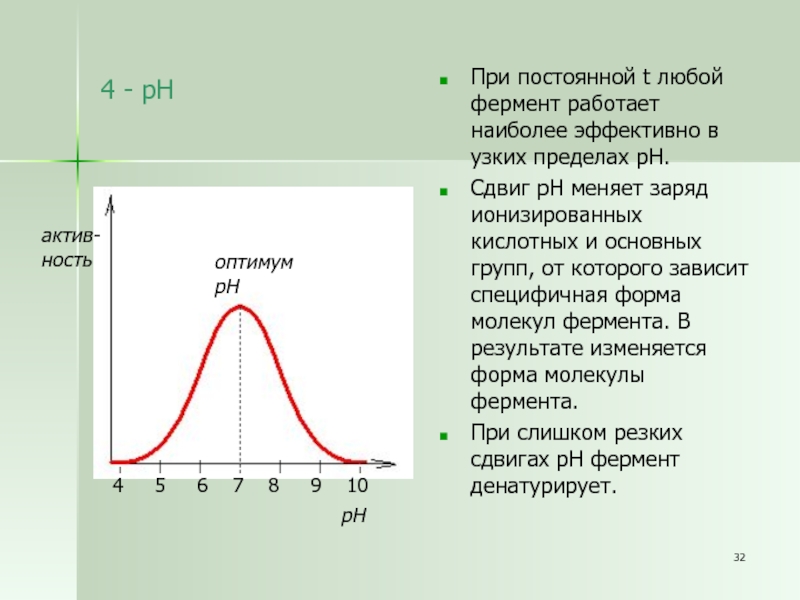
Слайд 324 - рН
При постоянной t любой фермент работает наиболее эффективно
в узких пределах рН.
Сдвиг рН меняет заряд ионизированных кислотных и
основных групп, от которого зависит специфичная форма молекул фермента. В результате изменяется форма молекулы фермента.
При слишком резких сдвигах рН фермент денатурирует.
рН
актив-
ность
оптимум
рН
4 5 6 7 8 9 10
Слайд 33Классификация ферментов
В 1961 г. специальной комиссией Международного биохимического союза была
предложена систематическая номенклатура ферментов.
Ферменты были подразделены на шесть групп в
соответствии с общим типом реакции, которую они катализируют.
Рабочее название состоит из названия субстрата, на который действует данный фермент, указания на тип катализируемой реакции и окончания «-аза».
Слайд 34Оксидоредуктазы: перенос атомов Н и О или электронов от одного
вещества к другому.
Трансферазы: перенос определенной группы атомов (метильной, фосфатной или
аминогруппы) от одного вещества к другому.
Гидролазы: реакции гидролиза, при которых из субстрата образуются два продукта.
Лиазы: негидролитическое присоединение к субстрату или отщепление от него группы атомов. Происходят разрывы связей С-С, C-N, C-O, C-S.
Изомеразы: внутримолекулярная перестройка.
Лигазы: соединение двух молекул в результате образования новых связей С-О, C-S, C-N или С-С и с затратой энергии АТФ.