Слайд 1Лекция № 5
Тема: «Алкадиены. Циклоалканы»
План:
1.Общая характеристика алкадиенов.
2.Особенность химических свойств диеновых
углеводородов.
3.Синтетический и натуральный каучуки.
Синтез каучука по методу Лебедева.
Современные методы синтеза каучука.
4.Циклоалканы.
Слайд 2
1.Общая характеристика алкадиенов.
Алкадиены, как следует из их названия, представляют собой
ненасыщенные углеводороды, содержащие в своем углеродном скелете две двойные связи.
Их также называют диеновыми углеводородами.
Общая формула гомологического ряда алкадиенов — СnН2n-2. Следует иметь в виду, что такая же формула соответствует и другим гомологическим рядам — например, алкинов или циклоалкенов.
Слайд 3 Возможны три разных способа взаиморасположения двойных связей в диеновом углеводороде
относительно друг друга:
1). Двойные связи расположены вплотную одна к другой.
Такие углеводороды называются кумулированными:
СН2=С=СН-СН2-СН3
Слайд 42). Двойные связи разделены более чем одной одинарной связью (σ
–связями):
СН2=СН-СН2-СН=СН2
Такие алкадиены носят название изолированных. Их химические свойства ничем не
отличаются от свойств обычных алкенов (разумеется, с учетом того, что в реакцию могут вступать две никак не зависящие друг от друга двойные связи).
Слайд 53). Если двойные связи разделены в цепи только одной σ-связью,
то их называют сопряженными. В этом случае в молекуле двойные
и одинарные связи чередуются,
как, например, в бутадиене-1,3, который является простейшим сопряженным алкадиеном:
СН2=СН—СН=СН2
Соединения с чередующимся расположением двойных связей отличаются по свойствам как от алкенов, так и от других типов алкадиенов. Особенности химического поведения этих соединений объясняются наличием сопряжения.
Сопряжение — образование единого электронного облака в результате взаимодействия негибридизо-
ванных р-орбиталей в молекуле с чередующимися двойными и одинарными связями.
Слайд 6Строение молекулы алкадиенов:
Слайд 7Номенклатура
О наличии двойных связей в молекуле
алкадиена говорит суффикс –
диен. Для
указания положения двойной связи главную
углеродную цепь номеруют
так, чтобы в неё
входили обе двойные связи, и нумерацию
начинают с того конца, где ближе связи.
Названия дают аналогично алканам, только
Окончание -ан меняют на окончание –адиен.
Цифрой в конце названия указывают номера
атомов углерода с двойными связями.
Слайд 92.Особенность химических свойств диеновых углеводородов.
а). Реакция электрофильного присоединения более характерна
для алкадиенов. Главная особенность
химии сопряженных диенов в том, что
на первой ступени образуется не только обычный продукт 1,2- присоединения, но и продукт 1,4-присоединения
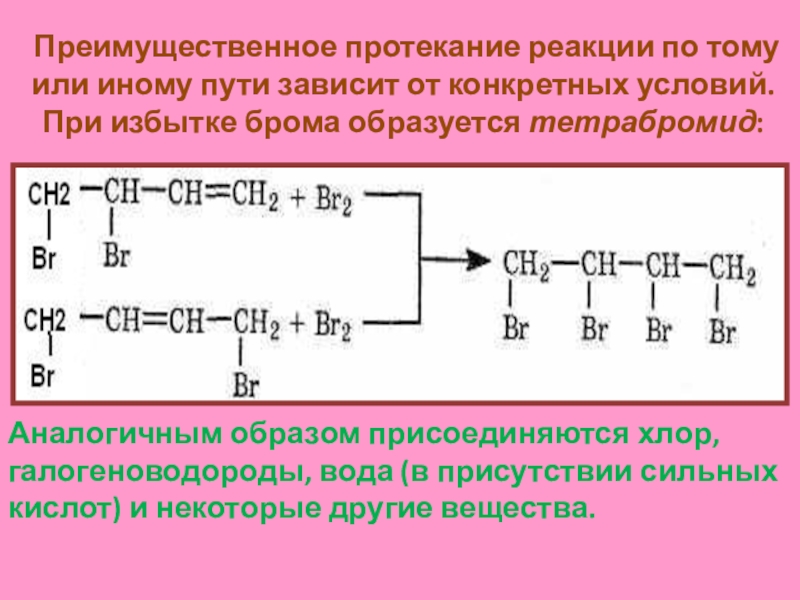
Слайд 10Преимущественное протекание реакции по тому или иному пути зависит от
конкретных условий. При избытке брома образуется тетрабромид:
Аналогичным образом присоединяются хлор,
галогеноводороды, вода (в присутствии сильных кислот) и некоторые другие вещества.
Слайд 11б). Реакция полимеризация диеновых углеводородов
Реакция полимеризации лежит в
основе синтеза каучуков:
nСН2 = СН – СН = СН2 →
(- СН2 = СН – СН = СН2-)n
полибутадиен
Слайд 12
3.Синтетический и натуральный каучуки.
Синтез каучука по методу С.В.Лебедева
Получение синтетического каучука
— основная
область применения диеновых углеводородов
(главным образом бутадиена и
изопрена).
Синтетический каучук в промышленном масштабе
впервые был получен в 1932 г. в нашей стране по
способу С. В. Лебедева:
Слайд 13Каучук имеет громадное значение в народном хозяйстве. Синтез проходит в
две стадии.
1. Получение бутадиена из этилового спирта в присутствии катализатора
(Аl2О3, ZnO):
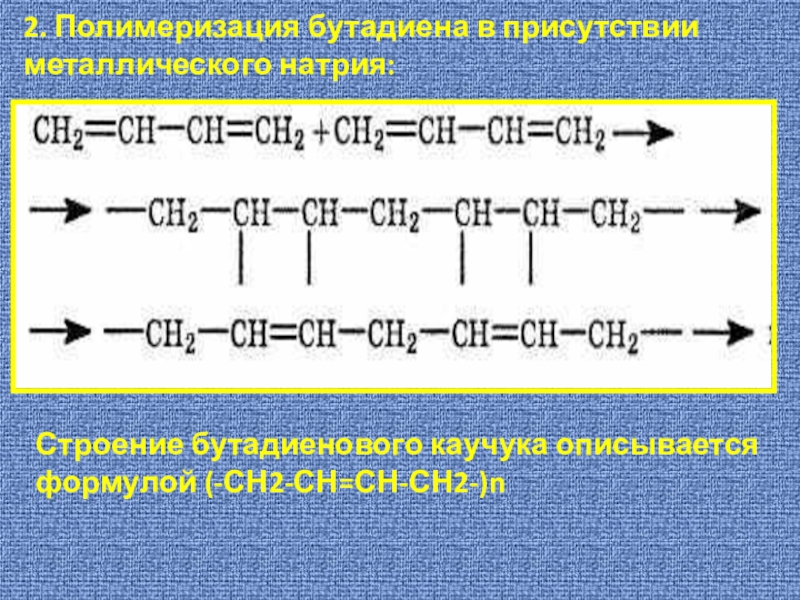
Слайд 142. Полимеризация бутадиена в присутствии металлического натрия:
Строение бутадиенового каучука описывается
формулой (-СН2-СН=СН-СН2-)n
Слайд 15Натуральный каучук — полимер изопрена: n=1000-3000
Слайд 16Натуральный и синтетический каучуки. Резина. Эбонит
Каучуками называют продукты полимеризации диеновых
углеводородов и их производных. Природный (натуральный) каучук получают из млечного
сока (латекса) каучуконосных растений, например бразильской гевеи. Латекс содержит примерно 30% полимерного вещества, крохотные частицы которого находятся в жидкости во взвешенном состоянии (эмульсия). Млечный сок гевеи туземцы назвали каучук, что в переводе означает «слёзы дерева». На воздухе сок постепенно темнеет, превращаясь в резиноподобную смолу. Уже в XV в. индейцы использовали каучук для обработки лодок, корзин, одежды и обуви для придания им водонепроницаемых свойств. В XVIII в. каучук был завезён в Европу, где из него стали изготавливать водоотталкивающие ткани, мячи, обувь.
Слайд 17Каучуки
Первым синтетическим каучуком, прошедшим испытание практикой, стал бутадиеновый каучук (СКВ),
полученный в СССР по методу С. В. Лебедева. Сырьём для
его производства служил этиловый спирт, из которого на первой стадии синтезировали бутадиен-1,3 и далее, на второй стадии — полимерный продукт:
Слайд 18Каучуки в медицине
Резиновые перчатки, резиновые фартуки в операционных и перевязочных
хирургических отделений.
Слайд 19Производство катетеров, зондов,
трубочек фонендоскопов.
Каучуки в медицине
Слайд 20Современные методы синтеза каучука.
Сырьём для синтетического каучука чаще всего
служат предельные
углеводороды, которые содер-
жатся в нефтяных газах и продуктах переработки
нефти.
Процесс проходит ступенчато:
Дегидрирование
tº, Кt
С4Н10 → СН2 = СН – СН = СН2 + 2Н2
2. Полимеризация
nСН2 = СН – СН = СН2 → (- СН2 - СН = СН - СН2 ) n
Синтетические каучуки, также как и натуральныеподвер-
гаються вулканизации (нагр. с серой) – получается
резина.
Слайд 21
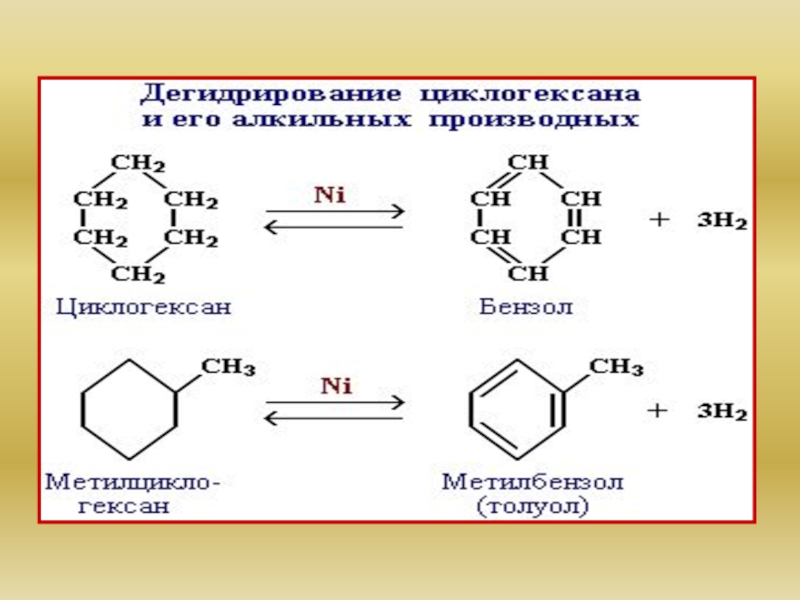
4.Циклоалканы.
Циклоалканы (циклопарафины, полиметилены, цикланы), насыщенные (предельные) моноциклические углеводороды, состоящие из
метиле-
нывых групп (-СН2-), соединённых в замкнутые
циклы ординарными связями. Циклоалканы и их производные относятся к алициклическим соединениям.
По числу атомов углерода в цикле циклоалканы делят на малые (3 или 4 атома), обычные (5-7), средние (8-12) и большие (13 и более).
Названия циклоалканов образуют, прибавляя префикс "цикло" к названию ациклического неразветвленного алкана с тем же числом атомов углерода, например циклогексан. Нумерацию в цикле производят таким обра-
зом, чтобы заместители получили наименьшие номера.
Низшие циклоалканы - циклопропан и циклобутан - газы, остальные циклоалканы - жидкости или твердые вещества , плохо растворимы в воде, легко - в органических растворителях.
Слайд 22
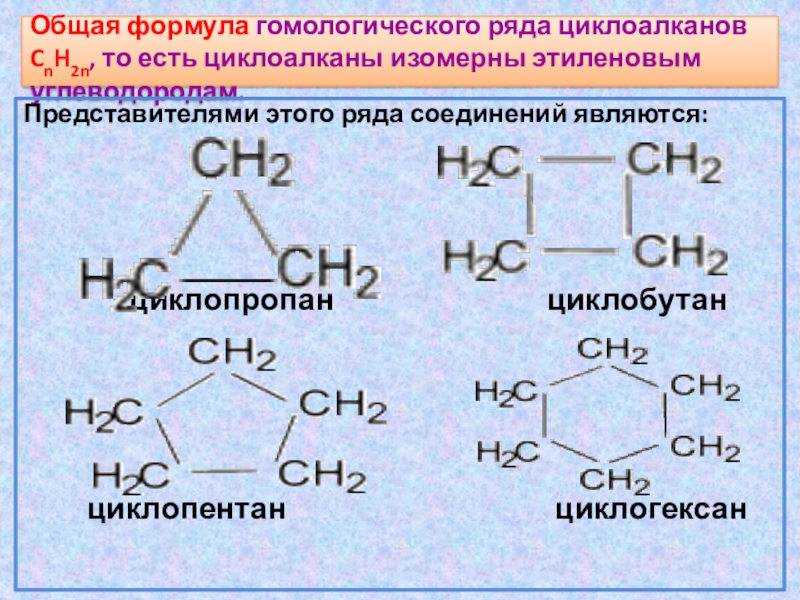
Общая формула гомологического ряда циклоалканов CnH2n, то есть циклоалканы изомерны
этиленовым углеводородам.
Представителями этого ряда соединений являются:
циклопропан циклобутан
циклопентан циклогексан
Слайд 23Изомерия циклоалканов
Очень часто в органической химии структурные
формулы перечисленных циклоалканов
изображают
без символов C и H простыми геометрическими фигу-
рами :
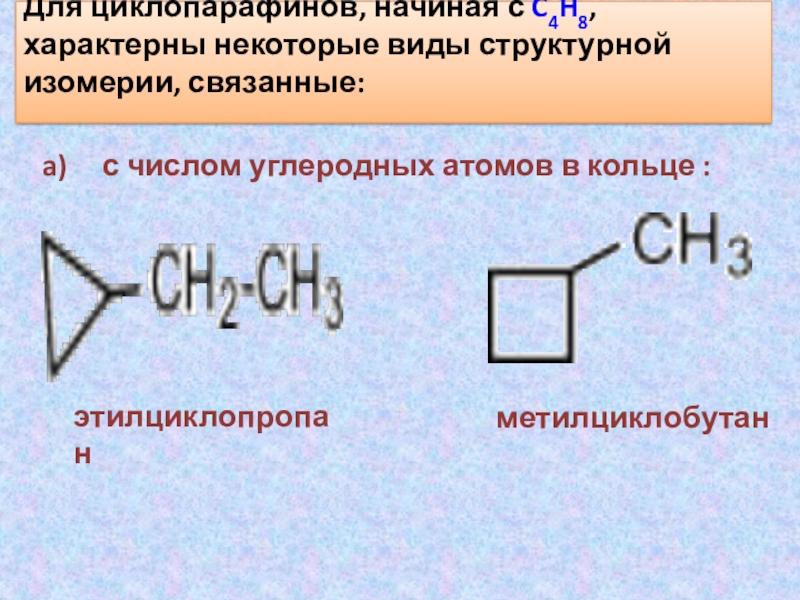
Слайд 24Для циклопарафинов, начиная с C4H8, характерны некоторые виды структурной изомерии,
связанные:
a) с числом углеродных атомов в кольце :
этилциклопропан
метилциклобутан
Слайд 25б) с числом углеродных атомов в заместителях :
1-метил-2-пропилциклопентан
1,2-диэтилциклопентан
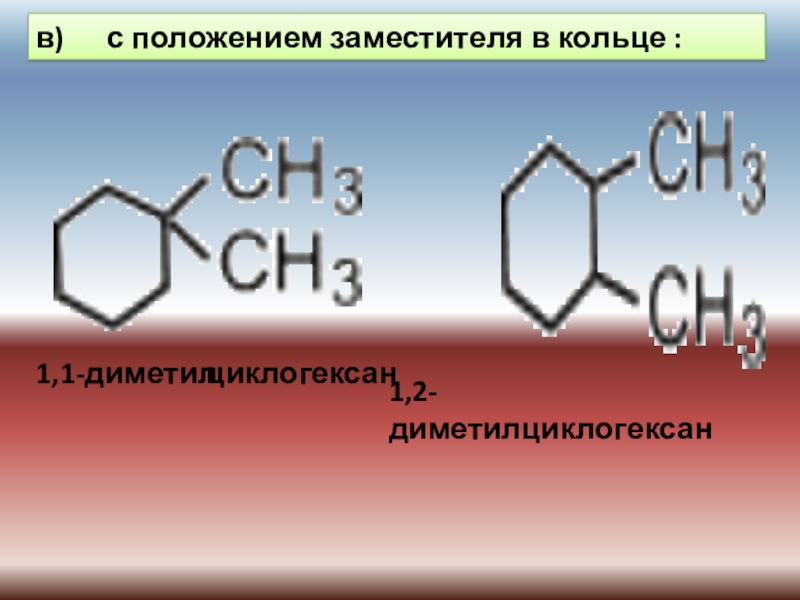
Слайд 26в) с положением заместителя в кольце :
1,1-диметил
1,2-диметилциклогексан
циклогексан
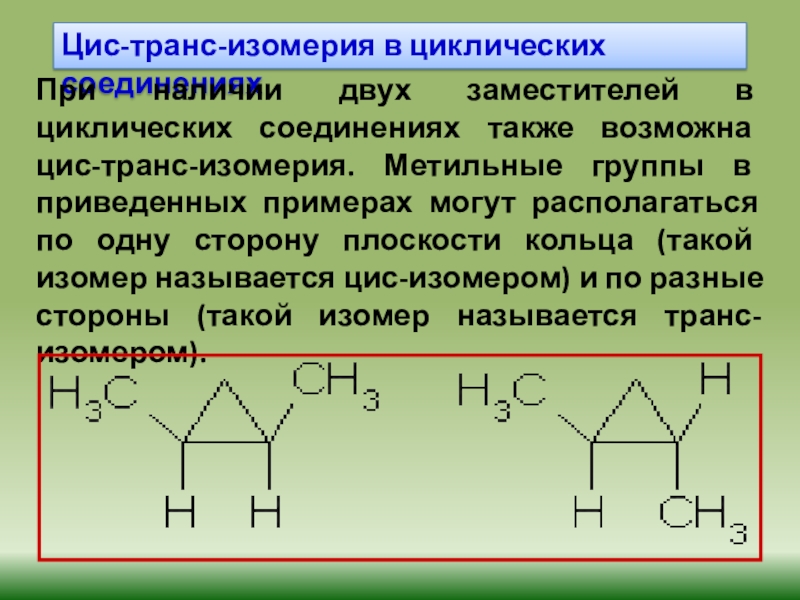
Слайд 27Цис-транс-изомерия в циклических соединениях
При наличии двух заместителей в циклических соединениях
также возможна цис-транс-изомерия. Метильные группы в приведенных примерах могут располагаться
по одну сторону плоскости кольца (такой изомер называется цис-изомером) и по разные стороны (такой изомер называется транс-изомером).
Слайд 28Цис-транс-изомерия, обусловленная различным взаимным расположением в пространстве заместителей относительно плоскости
цикла. В цис-изомерах заместители находятся по одну сторону от плоскости
кольца, в транс-изомерах – по разные, поэтому она называется пространственной:
Слайд 29Синтез циклоалканов
1. При переработке нефти выделяют главным образом циклоалканы С5
- С7.
2. Действие активных металлов на дигалогензамещенные алканы (реакция Вюрца)
приводит к образованию различных циклоалканов:
Вместо металлического натрия используется также порошкообразный цинк.
Слайд 31Физические свойства циклоалканов закономерно изменяются с ростом их молекулярной массы.
Пpи ноpмальных условиях циклопpопан и циклобутан – газы, циклоалканы С5
– С16 – жидкости, начиная с С17, – твердые вещества. Температуры кипения циклоалканов выше, чем у соответвующих алканов. Это связано с более плотной упаковкой и более сильными межмолекулярными взаимодействиями циклических структур.
Слайд 32Химические свойства циклоалканов сильно зависят от размера цикла, определяющего его
устойчивость. Трех- и четырехчленные циклы (малые циклы), являясь насыщенными, тем
не менее, резко отличаются от всех остальных предельных углеводородов. Валентные углы в циклопропане и циклобутане значительно меньше нормального тетраэдрического угла 109°28’, свойственного sp3-гибридизованному атому углерода.
Слайд 33Это приводит к большой напряженности таких циклов и их стремлению
к раскрытию под действием реагентов. Поэтому циклопропан, циклобутан и их
производные вступают в реакции присоединения, проявляя характер ненасыщенных соединений. Легкость реакций присоединения уменьшается с уменьшением напряженности цикла в ряду: циклопропан > циклобутан >> циклопентан.
Наиболее устойчивыми являются 6-членные циклы, в которых отсутствуют угловое и другие виды напряжения.
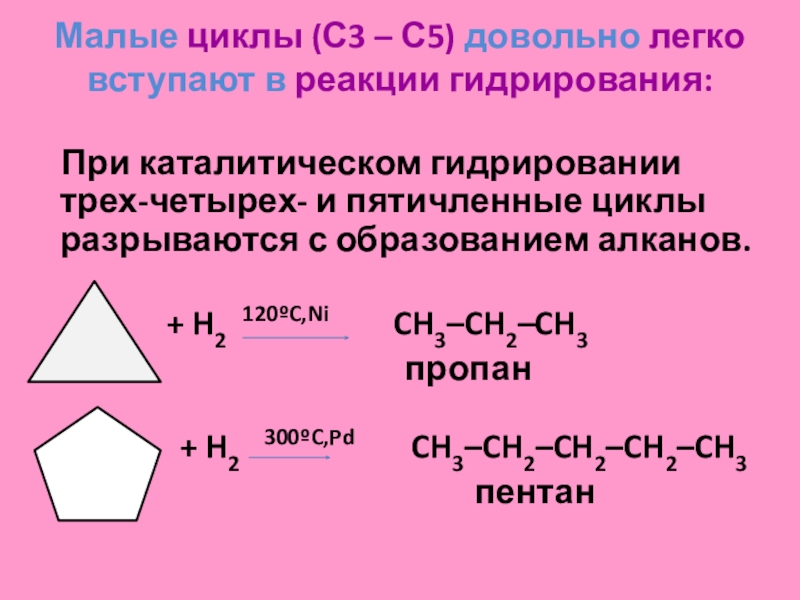
Малые циклы (С3 – С4) довольно легко вступают в реакции гидрирования:
Слайд 34
Малые циклы (С3 – С5) довольно легко вступают в реакции
гидрирования:
При каталитическом гидрировании трех-четырех- и пятичленные циклы разрываются
с образованием алканов.
+ H2 120ºC,Ni CH3–CH2–CH3
пропан
+ H2 300ºC,Pd CH3–CH2–CH2–CH2–CH3
пентан
Слайд 35
Реакции присоединения
Галогенирование , гидрогалогенирование
(происходит по правилу Марковникова) – циклопропан
склонен к реакциям присоединения:
Слайд 36Реакции замещения
Для циклоалканов (С5 и выше) вследствие
их устойчивости характерны
реакции, в
которых сохраняется циклическая структура,
т.е. реакции замещения:
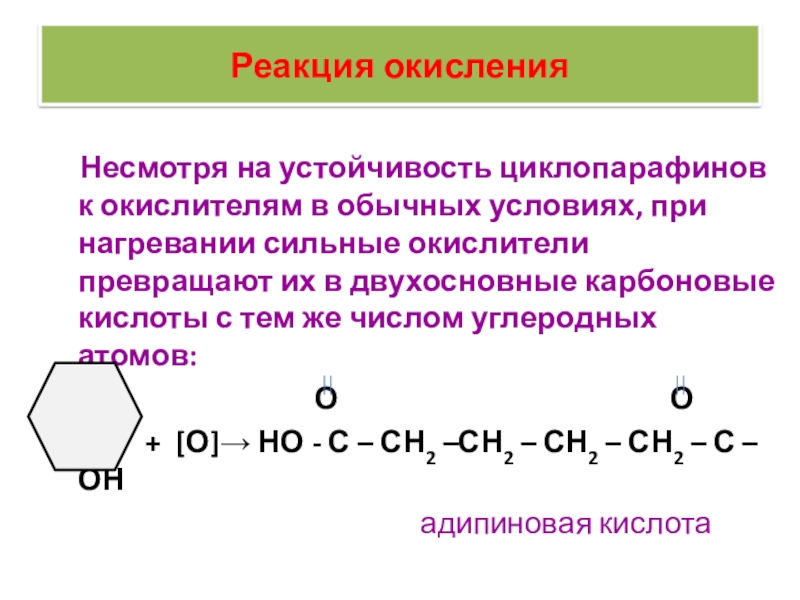
Слайд 39Реакция окисления
Несмотря на устойчивость циклопарафинов к окислителям в
обычных условиях, при нагревании сильные окислители превращают их в двухосновные
карбоновые кислоты с тем же числом углеродных атомов:
О О
+ [О]→ НО - С – СН2 –СН2 – СН2 – СН2 – С –ОН
адипиновая кислота
Слайд 40Применение, значение для человека
Циклоалканы широко распространены в природе, они входят
в состав нефти. В нефтехимической промышленности нафтены являются источником получения
ароматических углеводородов путем каталитического крекинга. Так же смолы деревьев построены на циклоалканах, циклоалканы входят в состав восточных благовоний, мускус, камфора, амбра, мятные и лимонные масла, и т.д. Они находят применение в разных областях народного хозяйства. Так, циклопентан используется в разных синтезах и как добавка к моторному топливу для повышения качества. Циклогексан используется для синтеза полупродуктов при производстве синтетических волокон найлона и капрона. Так же они содержаться в сильнейших растительных ядах, которые опасны для человека, зафиксировано примерно 100 тыс. смертей.
Слайд 41Так же интересно то, что холестерин родоначальник ациклических веществ, он
содержит циклопентановый блок. Цикло алканы не обошли стороной витамины, например
витамины группы «Д», а он в свою очередь является ключевым фактором, определяющим всасывание кальция. Циклоалканы присутствуют в незаменимых гормонах, без которых человеку не выжить, в желчных кислотах, и в половых гормонах - тестостерон, — основной мужской половой гормон, без которого невозможно размножение. Вообщем роль циклоалканов в жизни человека огромна, она может быть полезна и может быть опасна, и можно еще очень долго перечислять, где и для чего он используется.