Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция №2. Химическая кинетика. Химическое равновесие. Учение о растворах
Содержание
- 1. Лекция №2. Химическая кинетика. Химическое равновесие. Учение о растворах
- 2. План лекции1. Химическая кинетика. Скорость реакции. Закон
- 3. Химическая кинетика – это учение
- 4. Скорость химической реакции показывает изменение концентрации веществ
- 5. Истинная-характеризует изменение концентрации веществ к бесконечно малому
- 6. k – константа скорости реакции показывает какая
- 7. Механизмы реакцийпараллельные (разветвленные)
- 8. последовательно-параллельные А
- 9. - циклические
- 10. цепные реакции (превращение химических веществ идет с
- 11. Молекулярность- количество молекул, участвующих в элементарном акте
- 12. Факторы, влияющие на скорость реакции1) КонцентрацияЗакон Гульдберга
- 13. Кинетические уравненияС0-исходная концентрация вещества;С- оставшаяся концентрация вещества
- 14. Период полупревращения (полураспада) t½ -промежуток времени в
- 15. 2. ТемператураЗакон Вант-Гоффа:«При повышении температуры на 100
- 16. Уравнение Аррениуса в дифференциальной форме (уравнение изобары):(d
- 17. Свойства ферментовВысокая биологическая активностьВысокая специфичностьЗависимость активности от условий среды
- 18. Зависимость скорости реакции (V) от концентрации субстрата S.
- 19. Vmax - максимальная скорость реакции при данной
- 20. Химическое равновесиеКлассификация химических реакций по обратимостиНеобратимые -
- 21. Обратимые – одновременно протекают как в прямом,
- 22. Слайд 22
- 23. Для реакции I2 + H2↔ 2HI
- 24. Термодинамика химического равновесия∆G = ∆G0 + RT
- 25. Уравнения изобары и изохоры химических процессовУравнение
- 26. Стационарное состояние биологических систем. Гомеостаз.Состояние системы, при
- 27. Аутостабилизация – восстановление и поддержание стационарного состояния (свойство стационарности открытых систем)
- 28. ОсмосОсмос –одностороннее проникновение молекул растворителя через полупроницаемую
- 29. Давление, которое нужно приложить, чтобы прекратить осмос,
- 30. Слайд 30
- 31. Осмотическое давлениеВеличину осмотического давления определяют теоретически по
- 32. Осмотическое давление биологических жидкостейОсмотическое давление крови
- 33. Осмотические явления
- 34. В гипертоническом растворе наблюдается плазмолиз клеток (сморщивание);В гипотоническом - цитолиз (эритроциты -гемолиз);В изотоническом – изоосмия.
- 35. Слайд 35
- 36. Теория водных растворов сильных электролитовСильные электролиты α%>30%Теория
- 37. Ионы, находящиеся в растворе
- 38. Ионная сила раствора(J) - величина,
- 39. Коэффициенты активности ионов в водных растворах
- 40. Биологическая роль теории сильных электролитовСильные электролиты: влияют
- 41. Скачать презентанцию
План лекции1. Химическая кинетика. Скорость реакции. Закон действующих масс. Молекулярность и порядок реакции. Зависимость скорости от концентрации и температуры. Уравнение Аррениуса. Гомо- и гетерогенный катализ. Понятие о ферментах как биологических катализаторах.
Слайды и текст этой презентации
Слайд 1Лекция №2.
Химическая кинетика. Химическое равновесие. Учение о растворах.
Кафедра
медицинской и биологической химии ХМГМА
Слайд 2План лекции
1. Химическая кинетика. Скорость реакции. Закон действующих масс. Молекулярность
и порядок реакции. Зависимость скорости от концентрации и температуры. Уравнение
Аррениуса. Гомо- и гетерогенный катализ. Понятие о ферментах как биологических катализаторах.2. Обратимые и необратимые реакции. Константа химического равновесия. Прогнозирование смещения химического равновесия. Понятие о гомеостазе и стационарном состоянии живого организма.
Осмос и осмотическое давление: уравнение Вант-Гоффа. Понятие о изоосмии. Роль осмоса в биологических системах. Плазмолиз.
Элементы теории электролитов. Сильные и слабые электролиты. Теория сильных электролитов Дебая-Хюккеля. Ионная сила раствора. Активность, коэффициент активности. Электролиты в организме.
Слайд 3 Химическая кинетика – это учение о скорости химических
реакций, их механизме и закономерностях протекания во времени.
Слайд 4Скорость химической реакции показывает изменение концентрации веществ во времени.
Скорость реакции:
Средняя-характеризует изменение концентрации веществ за некоторый промежуток времени.
Для гомогенных систем υср. = ± n/ V t, или υср. = ± С/t, моль/лс моль/лс (мин., час)
Для гетерогенных систем υср. = ± n/ S t, моль/м2с (мин., час)
Слайд 5Истинная-характеризует изменение концентрации веществ к бесконечно малому промежутку времени
υист. = ± dC/dt, моль/лс
υ=kC
Дифференциальное(кинетическое уравнение): dC/dt = kC, где
k – константа скорости реакции
Слайд 6k – константа скорости реакции показывает какая доля из общего
числа молекул в расчете на один моль вещества приводит к
химическому взаимодействию.Значение k зависит от природы реагирующих веществ, температуры
Слайд 7Механизмы реакций
параллельные (разветвленные)
А В
С
Пример: гликолиз
глюкоза глюкозо-6-фосфат гликогеногенез
пентозо-фосфатный путь (ПФП)
Слайд 8последовательно-параллельные
А В С
D
E
Пример: синтез нуклеотидов
сопряженные
А + В С С + E D
Пример: АТФ + Н2О АДФ + Н3РО4
Н3РО4+ глюкоза глюкозо-6-фосфат + Н2О
Н3РО4 – индуктор; глюкоза-акцептор
Слайд 9- циклические
А В
Е С
Пример: Цикл Кребса, Орнитиновый цикл
- спиральные
А
В
Е СD
Пример: -окисление жирных кислот
Слайд 10цепные реакции (превращение химических веществ идет с участием активных частиц
с не насыщенными валентностями-свободными радикалами)
Пример: пероксидное окисление липидов (ПОЛ)
фотохимические реакции(энергия,
необходимая для их инициирования подводится в форме электромагнитных излучений)Пример: акт зрения
Слайд 11Молекулярность- количество молекул, участвующих в элементарном акте взаимодействия.
Реакции:
-мономолекулярные (разложение, изомеризация)
Н2СО3↔Н2О + СО2
υ = k1C(Н2СО3)
-бимолекулярные
υ = k2C(Н2О) C(СО2)
-тримолекулярные
2NO + H2 N2O + H2O
υ = kC(NO)2 C(H2)
Слайд 12Факторы, влияющие на скорость реакции
1) Концентрация
Закон Гульдберга и Вааге:
«При постоянной температуре скорость реакции пропорциональна произведению концентраций реагирующих
веществ, взятых в степенях, равных их стехиометрическим коэффициентам»Для реакции: aA + bB↔cC + dD
υ = k1C(A)a C(B)b
Закон справедлив для простых реакций, для сложных реакций определяют порядок реакции, являющийся суммой стехиометрических коэффициентов a + b
Для сложных реакций: υ = k1C(A)νA C(B) νB , где
νA ,νB – порядки реакций для веществ А и В
Слайд 13Кинетические уравнения
С0-исходная концентрация вещества;
С- оставшаяся концентрация вещества после реакции
для реакций
:
0-проядка υ = k; С0-С=k0t;
k0=С0-С/t (моль/лс)I- порядка υ = kIС; С = С0 e kIt; lgС = lg С0 - kIt/2,3;
kI= 1/t lnС0/С (с-1); kI= 2,3/t lg С0/С (с-1)
II- порядка υ = kIIС2; С = С0/1+ kIIС0 t;
kII= 1/t (С0-С/ С0 С) (л/мольс)
Слайд 14Период полупревращения (полураспада) t½ -промежуток времени в течение которого реагирует
половина взятого количества вещества
для реакций :
0-проядка t½ = С0
/2 k0 I- порядка t½ = 0,693/ kI
II- порядка t½ = 1/ kIIС0
Слайд 152. Температура
Закон Вант-Гоффа:
«При повышении температуры на 100 С скорость гомогенной
реакции возрастает в 2-4 раза»
υТ2/ υТ1 = γ Т2 -Т1/10;
γ
- температурный коэффициент реакции, показывающий во сколько раз возрастает скорость реакции при увеличении температуры на 100 С.Уравнение Аррениуса:
k = Ае –Еа/RT, где
А – предэкспоненциальный множитель, учитывающий вероятность и число активных столкновений;
Еа – энергия активации, показывающая тот необходимый избыток энергии, которым должны обладать молекулы в момент столкновения, чтобы реакция была возможной
Слайд 16Уравнение Аррениуса в дифференциальной форме (уравнение изобары):
(d lnk/dT)p= Ea/R
T2
(d lnk/dT)p= H/R T2
lg (kT2/ kT1)
= Ea(T2-T1)/ 2,3 R T2 T1Ea= lg (kT2/ kT1) (2,3 R T2 T1/ (T2-T1) )
Слайд 17Свойства ферментов
Высокая биологическая активность
Высокая специфичность
Зависимость активности от условий среды
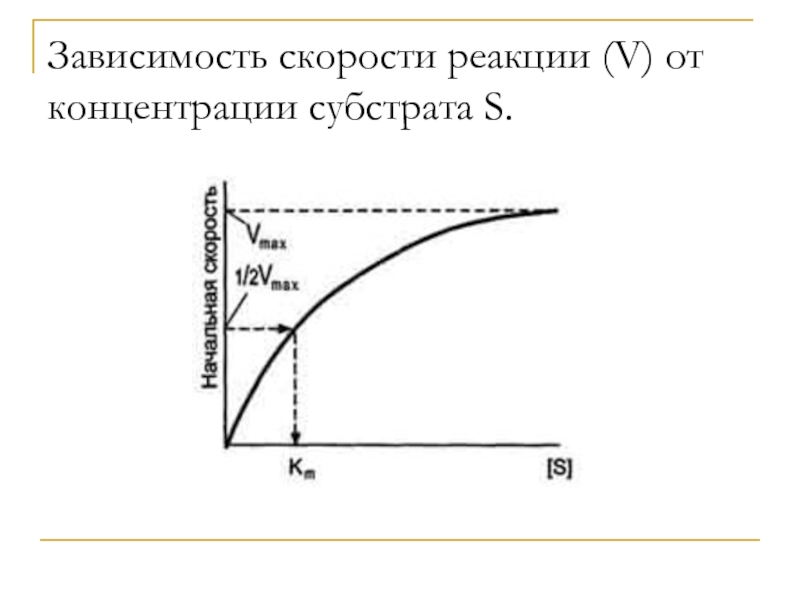
Слайд 19Vmax - максимальная скорость реакции при данной концентрации фермента в
оптимальных условиях проведения реакции.
Кm - константа Михаэлиса. Численно равна
концентрации субстрата, при которой достигается ½ максимальной скорости. Характеризует сродство фермента к субстрату. Чем меньше значение, тем больше сродство.Уравнение Михаэлиса-Ментен:
V = Vmax[S] / Кm
Слайд 20Химическое равновесие
Классификация химических реакций по обратимости
Необратимые - протекают в одном
направлении практически до конца.
Практически необратимыми являются реакции значения
G0298 которых больше 30 кДж/моль или меньше -30 кДж/моль.
Признаками таких реакций является образование газообразных продуктов, трудно растворимого соединения, слабого электролита.
Пример:
2KMnO4 K2MnO4 + MnO2 + O2
BaCl2 + H2SO4 BaSO4 + 2HCl
NaOH + HCl NaCl + H2O
Слайд 21Обратимые – одновременно протекают как в прямом, так и в
обратном направлении.
Значения G0298 находятся в пределах от
-30 кДж/моль до 30 кДж/моль.Пример:
I2 + H2↔ 2HI
CH3COOH + C2H5OH ↔ CH3COOC2H5 + H2O
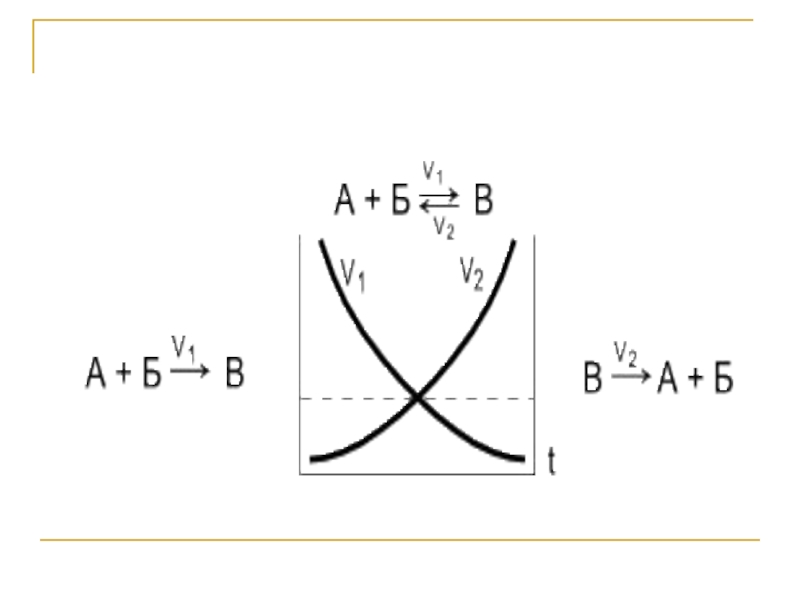
Условия химического равновесия
Химическим равновесием называется такое состояние обратимого процесса, при котором скорости прямой и обратной реакции равны.
Vпр. = V обр.
Слайд 23Для реакции I2 + H2↔ 2HI
υпр.
= k1 C(I2)C(H2)υобр. = k2 C(HI)2
υпр. = υобр.
k1 C(I2)C(H2) = k2 C(HI)2
k1/ k2 = C(HI)2/ C(I2)C(H2) = Пс, где
C(HI), C(I2), C(H2) – исходные концентрации веществ, моль/л
Пс – стехиометрическое соотношение концентраций веществ.
В условиях химического равновесия:
[HI]2/ [I2][H2] = Kс, где
[HI], [I2], [H2] – равновесные концентрации веществ,
Kс – константа равновесия реакции
Слайд 24Термодинамика химического равновесия
∆G = ∆G0 + RT Пс
В условиях химического
равновесия:
∆G = 0; ∆G0 = - RTlnКс,
гдеКс- константа равновесия реакции
Кс =[C]c [D]d / [A]a [B]b,
для газообразных веществ:
Кр = рc(C) рd(D) / рa(A) рb(B)
[C] = С(исх.) – С(прореаг.)
∆G = - RTlnКс + RTlnПс
∆G = - RTln(Кс/Пс) = RTln(Пс/Кс) -уравнение изотермы химической реакции
Слайд 25Уравнения изобары и изохоры
химических процессов
Уравнение изобары
(dlnKp/dT)p = ∆H/RT2
ln(K(T2)/K(T1)) = ∆H(T2 –
T1) / RT2 T1lg(K(T2)/K(T1)) = ∆H(T2 – T1) /2,3RT2 T1
Уравнение изохоры
(dlnKp/dT)v = ∆E/RT2
ln(K(T2)/K(T1)) = ∆E(T2 – T1) / RT2 T1
lg(K(T2)/K(T1)) = ∆E(T2 – T1) /2,3RT2 T1
Слайд 26Стационарное состояние биологических систем. Гомеостаз.
Состояние системы, при котором ее параметры
со временем не меняются, но происходит обмен веществом и энергией
с окружающей средой называется стационарным.Для живых организмов характерно постоянство параметров стационарного состояния во времени, которое называется – гомеостаз.
Сходство химического равновесия со стационарным состоянием заключается в неизменности во времени (сохраняет свои параметры).
Отличие заключается в двух признаках:
- для стационарного состояния ∆G ≠ 0 ,
∆G / ∆t = ∆Gi / ∆t + ∆Ge / ∆t (величина постоянная).
для химического равновесия ∆G = 0
- Энтропия при стационарных состояниях минимальна, а при химическом равновесии – максимальна.
Слайд 27Аутостабилизация – восстановление и поддержание стационарного состояния (свойство стационарности открытых
систем)
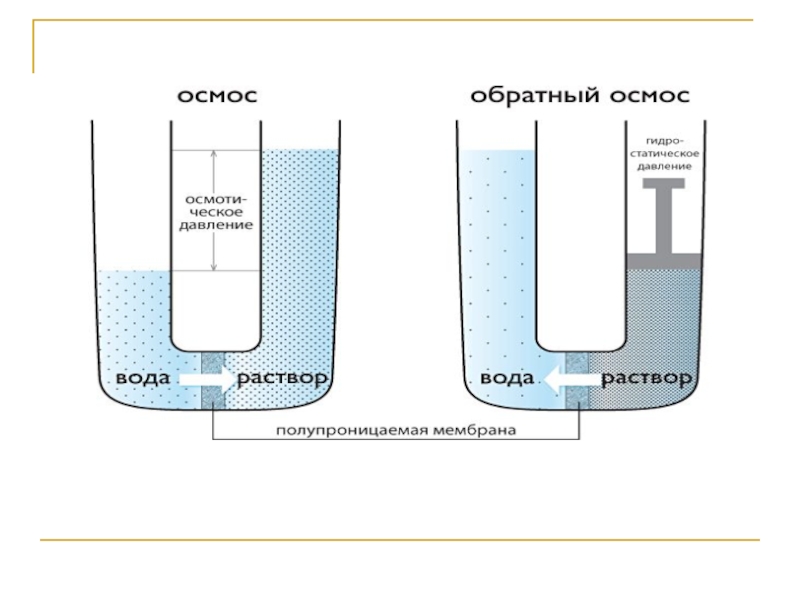
Слайд 28Осмос
Осмос –одностороннее проникновение молекул растворителя через полупроницаемую мембрану из растворителя
в раствор или из раствора с меньшей концентрацией в раствор
с большей концентрацией.Слайд 29Давление, которое нужно приложить, чтобы прекратить осмос, называется осмотическим давлением.
Гидростатическое давление:
р = h∙ρ∙g, где
h – высота поднятия жидкости,
м;ρ – плотность раствора, кг/м3;
g – ускорение свободного падения, м/с2.
Осмотическое давление - π – сила, обуславливающая осмос, отнесенная к единице поверхности мембраны.
Слайд 31Осмотическое давление
Величину осмотического давления определяют теоретически по закону Вант-Гоффа:
π =
С(х)∙R∙T (Па), где
C(х) – молярная концентрация растворенного вещества, моль/л;
R –
универсальная газовая постоянная = 8,314 Дж/мольК;T – абсолютная температура раствора, К.
Слайд 32Осмотическое давление биологических жидкостей
Осмотическое давление крови
740-780 кПа, 7,3 - 7,7 атм.
Раствор, имеющий одинаковое
с плазмой крови осмотическое давление, называют изотоническим раствором. Раствор, имеющий более высокое, чем плазма осмотическое давление, называют гипертоническим раствором.
Раствор, имеющий более низкое, чем плазма осмотическое давление, называют гипотоническим раствором.
Слайд 34В гипертоническом растворе наблюдается плазмолиз клеток (сморщивание);
В гипотоническом - цитолиз
(эритроциты -гемолиз);
В изотоническом – изоосмия.
Слайд 36Теория водных растворов сильных электролитов
Сильные электролиты α%>30%
Теория Дебая и Хюккеля
В растворах сильных электролитов ионы не совсем свободны, движение
их стеснено:- малым расстоянием между ионами;
- взаимным притяжением ионов друг к другу;
- наличием «ионной атмосферы» (каждый ион окружен противоположно заряженными ионами);
- образованием сольватных (гидратных) оболочек.
Слайд 37 Ионы, находящиеся в растворе сильного электролита, не
способны в полной мере к химическим реакциям.
Степень ионизации
называют кажущейся.В химических процессах участвуют только активные ионы. Активность- это эффективная концентрация ионов электролита, в соответствии с которой он участвует в химических реакциях. (Г.Льюис)
а(х)=С(х)f(х), моль/л, где
С(х)- молярная концентрация иона в растворе, моль/л
f(х)- коэффициент активности.
Коэффициент активности выражает отклонение раствора с концентрацией С(х) от поведения предельно разбавленного раствора.
При разбавлении раствора f(х) 1, а(х) С(х)
Слайд 38 Ионная сила раствора(J) - величина, измеряемая полусуммой произведения
концентраций всех находящихся в растворе ионов на квадрат их заряда.
J
=1/2b(x1)z12 + b(x2)z22 +…… b(xi)zi2 )lgf(x)= - A z(x)2 (√J/1+√J)
При J < 0,01
lgf(x)= - 0,5 z(x)2 √J
(Уравнение Дебая-Хюккеля)
«В разбавленных растворах сильных электролитов с одинаковой ионной силой коэффициенты активности катионов и анионов одинаковой зарядности равны независимо от их химической природы»