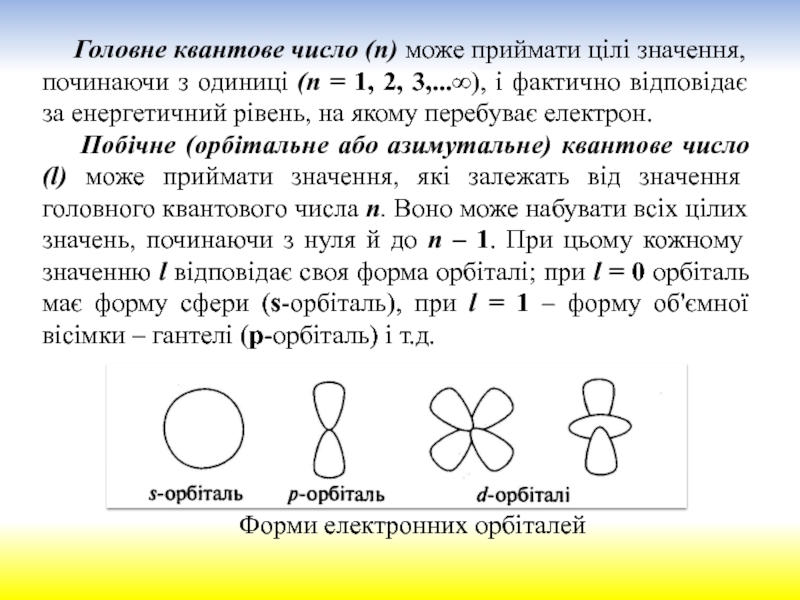
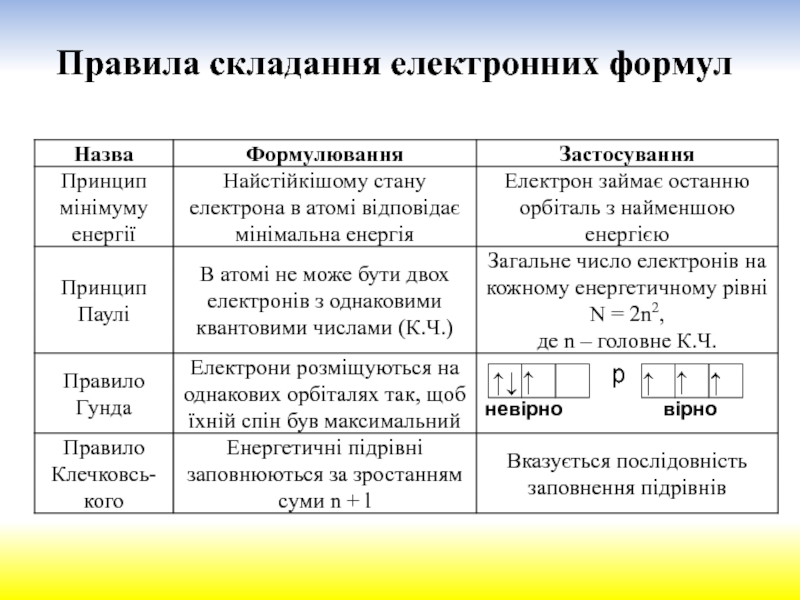
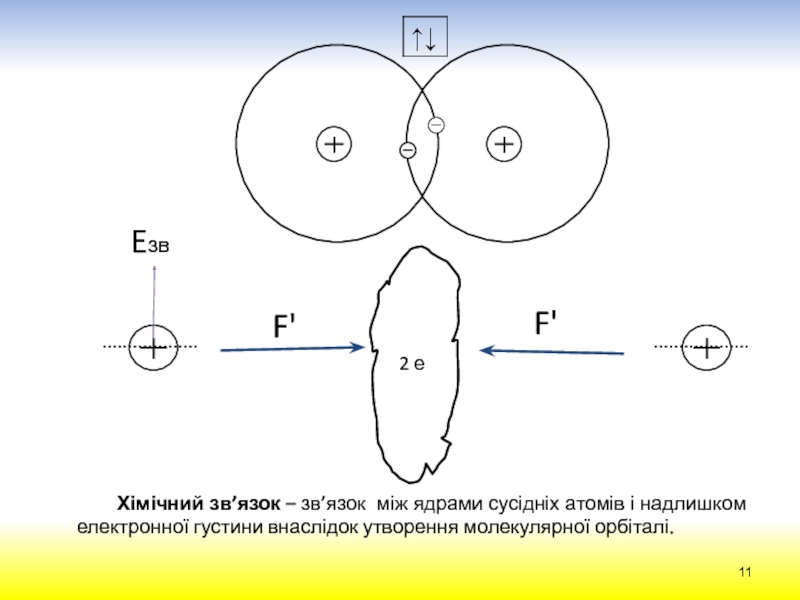
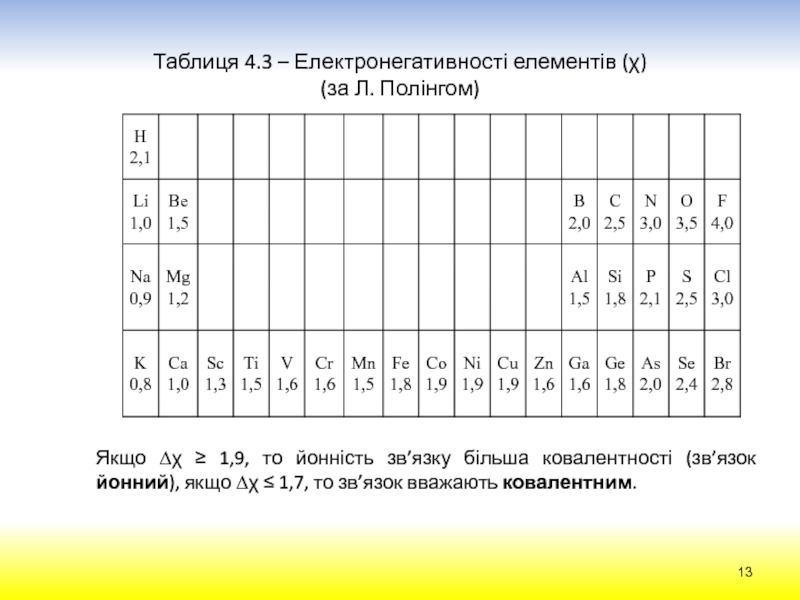
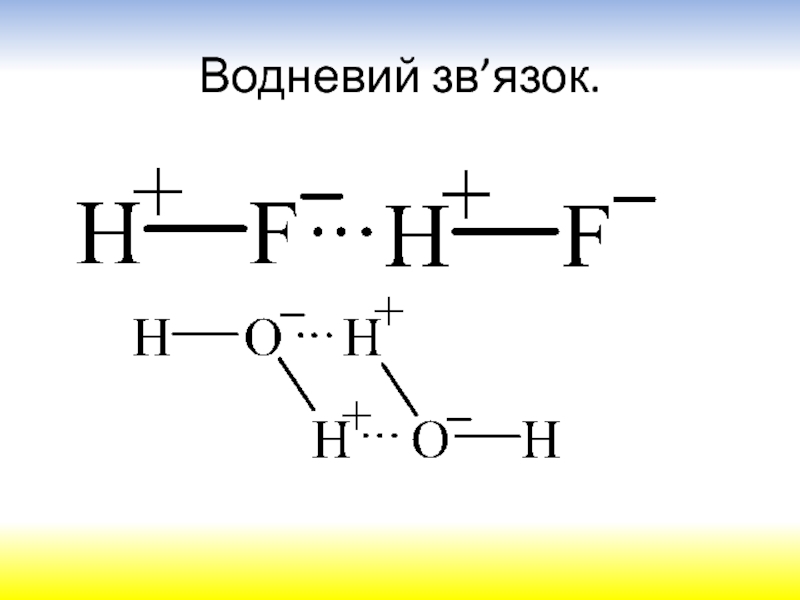
електрона в атомі можна передати за допомогою наукового поняття „хмара“
з тією чи іншою густиною в різних точках навколо ядра. Прийнято вважати, що електрон займає орбіталь (а не орбіту).Атомна електронна орбіталь – це стан електрона в атомі, що характеризується певними значеннями квантових чисел п, l і т, тобто певними розмірами, формою та орієнтацією в просторі електронної хмари.
Електрон – це елементарна частинка, складова атома, що рухається навколо ядра зі швидкістю ν і має масу спокою те.