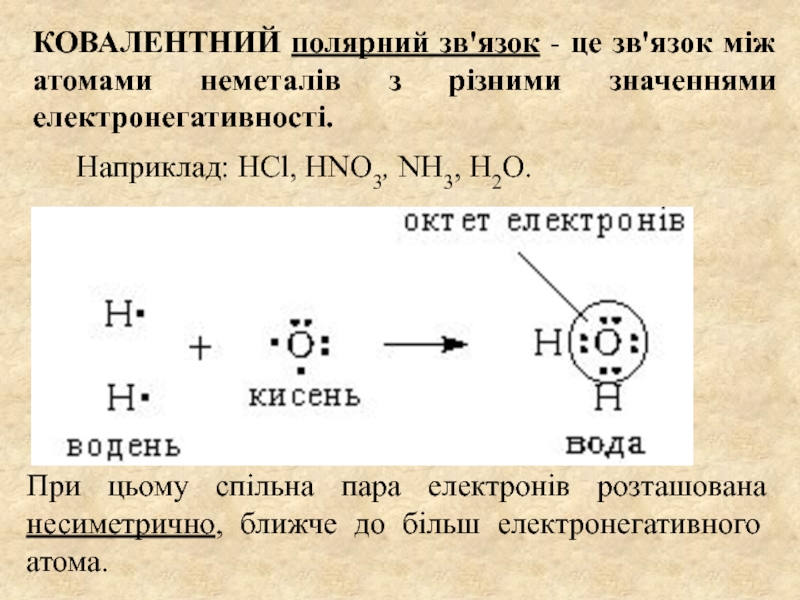
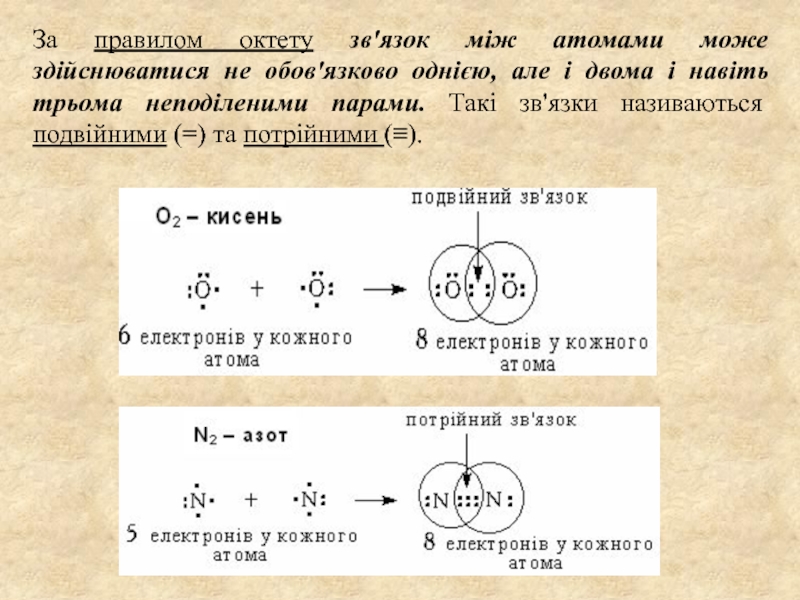
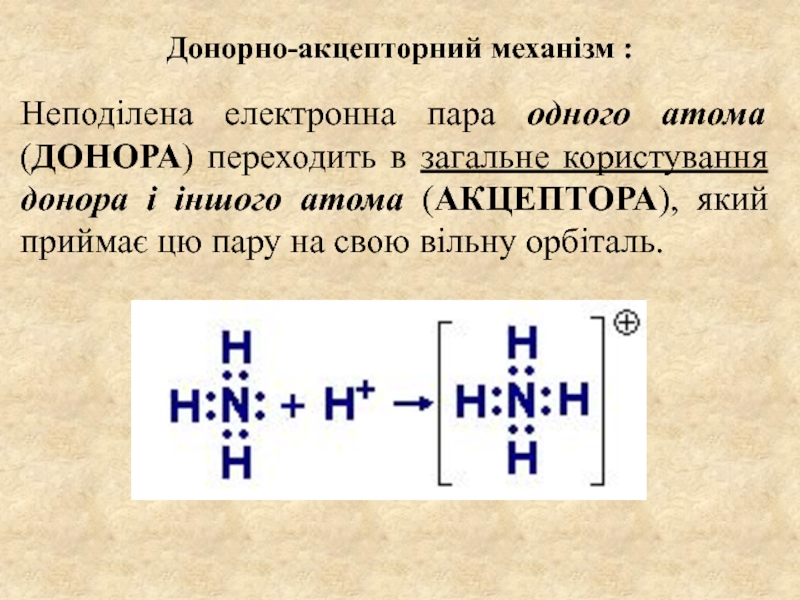
декількох атомів, в результаті якої утворюється хімічно-стійка двох- або багатоатомна
система (молекула або кристал).Зовнішні електронні оболонки всіх елементів, крім благородних газів, є НЕЗАповненими і в процесі хімічної взаємодії вони ЗАповнюються.
Ознаки утворення хімічного зв'язку:
• виділення енергії;
• зменшення відстані між ядрами атомів.