Слайд 1МЕТАНОЛ, ПРОПАНОЛ, БУТАНОЛ,
2-ЭТИЛГЕКСАНОЛ. СВОЙСТВА СПИРТОВ
Свойства спиртов обусловлены их функциональной
группой.
Эти свойства вызваны в основном наличием в молекулах спиртов полярных
связей Сδ+– Оδ- – Нδ+. Связи углерод– кислород и кислород – водород поляризованы. Реакции могут протекать по разрыву связи Оδ- – Нδ+ и менее полярной связи
Сδ+– Оδ-
1. Спирты взаимодействуют со щелочными и щелочно-земельными металлами
2. Превращение спиртов в эфиры неорганических кислот
С Нитратной кислотой образует нитратнометиловий эфир, или метилнитрат:
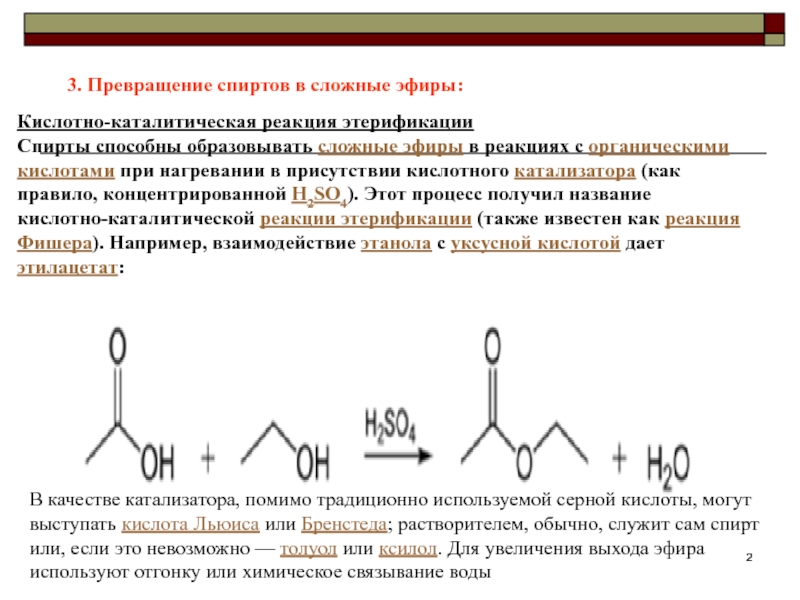
Слайд 23. Превращение спиртов в сложные эфиры:
Кислотно-каталитическая реакция этерификации
Спирты способны образовывать
сложные эфиры в реакциях с органическими кислотами при нагревании в
присутствии кислотного катализатора (как правило, концентрированной H2SO4). Этот процесс получил название кислотно-каталитической реакции этерификации (также известен как реакция Фишера). Например, взаимодействие этанола с уксусной кислотой дает этилацетат:
В качестве катализатора, помимо традиционно используемой серной кислоты, могут выступать кислота Льюиса или Бренстеда; растворителем, обычно, служит сам спирт или, если это невозможно — толуол или ксилол. Для увеличения выхода эфира используют отгонку или химическое связывание воды
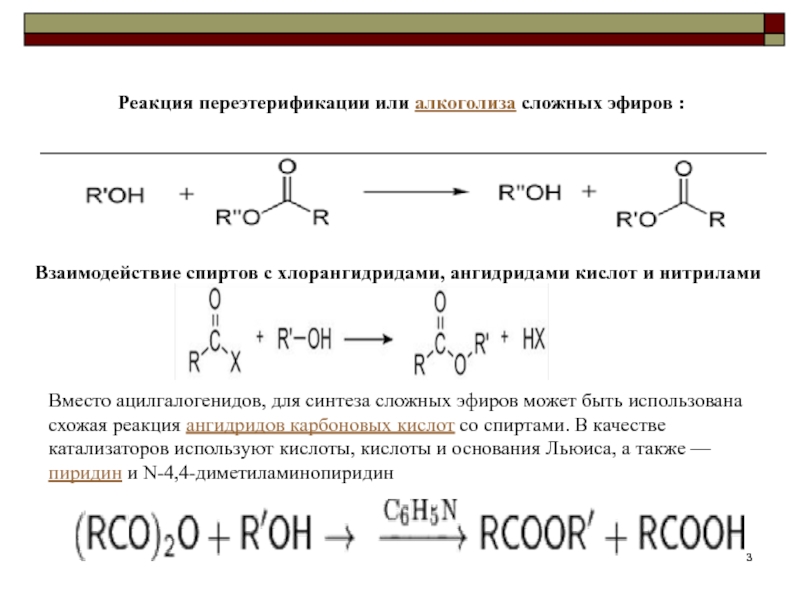
Слайд 3Реакция переэтерификации или алкоголиза сложных эфиров :
Взаимодействие спиртов с хлорангидридами,
ангидридами кислот и нитрилами
Вместо ацилгалогенидов, для синтеза сложных эфиров может
быть использована схожая реакция ангидридов карбоновых кислот со спиртами. В качестве катализаторов используют кислоты, кислоты и основания Льюиса, а также — пиридин и N-4,4-диметиламинопиридин
Слайд 4Превращение спиртов в галогеналканы
Гидроксильная группа в спиртах может быть
замещена на атом галогена несколькими способами:
- взаимодействием с галогенводородами (HCl,
HBr, HI);
-реакцией с тионилхлоридом;
-действием галогенидов фосфора (III) и (V) (РВr3, РСl5, РОСl3 или РI3) ;
-реакцией с квазифосфониевыми солями;
-превращением в алкилсульфонат с последующей реакцией замещения.
Слайд 5Превращение спиртов в простые эфиры
При осторожном нагревании в присутствии серной
кислоты происходит межмолекулярная дегидратация спиртов с образованием простых эфиров:
Существуют и
методы термокаталитической дегидратации спиртов. Например, первичные спирты в присутствии смешанного Ni−Al2O3−SiO2 катализатора и водорода при нагревании превращаются в простые эфиры[37]:
Слайд 6Общие химические методы получения спиртов
Существует множество методов получения спиртов, наиболее
общие:
реакции окисления --окислении углеводородов (реже — галогенпроизводных углеводородов), содержащих кратные
или активированные C−H связи;
Окислительные агенты для алканов и циклоалканов используются сильные неорганические окислители: озон, перманганат калия, оксид хрома (VI), хромовая кислота, диоксид селена, а также пероксид водорода и некоторые пероксикислоты.
Из-за возможности более глубокого окисления, метод имеет значение, как правило, только для получения третичных спиртов
Слайд 7
реакции восстановления — восстановление карбонильных соединений: альдегидов, кетонов, карбоновых кислот
и сложных эфиров;
Для восстановления альдегидов или кетонов, обычно, пользуются борогидридом
натрия или калия, а также алюмогидридом лития в протонном растворителе:
реакции гидратации — кислотно-катализируемое присоединение воды к алкенам (гидратация);
Слайд 8
реакции присоединения: синтез-газа, формальдегида, оксирана по кратным углеводородным связям;
Простейший
пример такой реакции — промышленный синтез метанола:
реакции замещения (гидролиза) —
реакции нуклеофильного замещения, при которых имеющиеся функциональные группы замещаются на гидроксильную группу;
Слайд 9МЕТАНОЛ, СВОЙСТВА
Метано́л (метиловый спирт, карбинол, гидроксид метила) — CH3OH, простейший
одноатомный спирт, бесцветная ядовитая жидкость.
Метанол — это первый представитель
гомологического ряда
Метиловый спирт - подвижная жидкость со слабым запахом похожим на запах обычного спирта. Плотность его 0,792 г / см 3. Температура кипения 64,5 0С,
С водой смешивается в любых соотношениях. Хороший растворитель для многих органических веществ.
Метиловый спирт ядовитое вещество, действующее на нервную и сосудистую системы человека. При попадании в организм человека 10 мл метанола может привести к тяжелому отравлению, до слепоты; попадания 25-30 мл метанола приводит к смертельному случаю
Слайд 10Применение метанола для производства продукции основного органического синтеза
1. Для производство
формальдегида :
Двумя методами
А) дегидрированием, совмещенным с частичным окислением
Т= 500—600°С, временя
контакта 0,01—0,03 с. Выход формальдегида на пропущенное сырье -80—85 %, степень конверсии метанола 85—90 %• Катализаторы: металлическая медь (в виде сетки или стружек) или серебро, осажденное на А1203. Последний катализатор оказался более эффективным и широко применяется в промышленности
2CH3OH + O2 → 2HCHO + 2H2O
---Б)окислением в избытке воздуха.
Формальдегид применяют для производства ряда полимеров (феноло-, карбамидо и меламиноформальдегидные полимеры, полиформальдегид) и в качестве промежуточного вещества для синтеза изопрена, пентаэритрита, гексаметилентетрамина (уротропин) и других ценных веществ.
Слайд 112.Для производства уксусной кислоты
CH3OH + CO → CH3COOH
Жидкофазное
карбонилирование при 220—250 °С и давлении 30 МПа в присутствии
сложного родиевого катализатора и небольших количеств иодметана.
Уксусная кислота широко применяется в пищевых целях, в качестве растворителя, промежуточного продукта для синтеза монохлоруксусной кислоты, растворителей — сложных эфиров уксусной кислоты (этилацетат, бутилацетат и др.), мономеров (винилацетат) и других ценных веществ.
Слайд 123.Для синтеза 2-метокси-2-метилпропана
Применение:
оксигенирующий компонент бензина
CH3OH + (CH3)2C=CH2 → (CH3)3COCH3
Реакция протекает в жидкой фазе при 50—85 °С и давлении
0,7—1,5 МПа в присутствии катионообменных смол
Слайд 134.Для производстваN-диметиланилина
C6H5NH2 + 2CH3OH → C6H5N(CH3)2 + 2H2O
Жидкофазное алкилирование
анилина при 200 °С и давлении 3,7 МПа в присутствии
каталитических количеств серной кислоты
Диметиланилнн является важным полупродуктом в производстве красителей, а также используется для получения тетрила — тринитрофенилметилнитрамина
сильного взрывчатого вещества.
Слайд 145. Для производства метиламинов
CH3OH + NH3 → CH3NH2 +
H2O
CH3OH + 2NH3 → (CH3)2NH + 2H2O
CH3OH + 3NH3 →
(CH3)3N + 3H2O
Условия процесса:
Гетерогенные катализаторы кислотного типа
Процесс в газовой фазе при 350—450°С.
Чаще всего применяют оксид алюминия, алюмосиликаты, фосфаты алюминия, фосфат аммония.
Применение метиламинов:
для производства инсектицидов, фунгицидов, ускорителей вулканизации, ПАВ, дубильных веществ, лекарственных средств, красителей, ракетных топлив, растворителей.
.
Слайд 15 6. Для производства хлорметана
CH3OH + HCl → CH3Cl
+ H2O
Реакция протекает в газовой фазе при 200—350 °С
в присутствии ZnCl2 на твёрдом носителе
Хлорметан применяется в органических синтезах ( метилирующее средство) , для получения низких температур ( хладоагент) и других целей.
CH3OH + HCl → CH3Cl + H2O
7. Прямое использование в качестве топлива.
8.Метанол применяется в производстве метил-третбутилового эфира – МТБЭ, являющегося одной из широко применяемых октано-повышающих присадок к бензинам.
Слайд 16 Сырьевые источники получения метанола. Перспективы использования различных видов сырья.
Раньше
метанол получали сухой перегонкой древесины (древесный спирт), но этот метод
полностью вытеснен синтезом из окиси углерода и водорода, который осуществлен в крупных масштабах во всех передовых странах.
Твердое топливо сохраняет в качестве сырья определенное значение. Разработка процесса газификации угля с целью получения синтез-газа, содержащего Н2, СО2, СО, может изменить структуру сырьевой базы производства метанола и таким образом неудобный для транспортирования уголь будет превращен в удобный для хранения, транспортирования и использования метанол.
Перспективным способом получения метанола является неполное окисления метана и его гомологов.
Слайд 17Современные промышленные способы получения метанола.
ОКИСЛЕНИЕ МЕТАНА
Давление -106 атм. и температура
реакции 3400С.
Соотношении метан : кислород = 9 : 1
Степень окисления метана составляет 22 %, причем 17 % прореагировавшего метана превращается в спирт,
0,75 % - в формальдегид, а остальное количество полностью окисляется до двуокиси углерода и воды.
Слайд 18Радикально-цепной механизм получения кислородсодержащих соединений.
Зарождение цепи
Активация кислорода
Образование перекиси
Обрыв цепи
Разложение перекиси
Слайд 192.Способ получения метанола из окиси углерода и водорода (синтез газа)
.
Наиболее удобный и экономичный
В связи с экзотермичностью процесса константа
равновесия падает с повышением температуры, составляя 2,316 - 10-4 при 300°С и всего 1,091-10-5 при 400°С. Приходится поэтому повышать давление, что способствует росту равновесной степени конверсии ввиду уменьшения объема газовой смеси в результате реакции.
Синтез метанола из СО и Н2 был впервые разработан Патаром в 1924 г., применившим в качестве катализатора ZnO.
Затем оксид цинка стали активировать оксидом хрома (8 масс. ч. ZnO на 1 масс. ч. Сг203).
Более активны, но требуют тонкой очистки реагентов оксидные медьхромовые и цинкмедьхромовые катализаторы.
Слайд 20Механизм образования метанола:
Побочно образуются: диметиловый эфир (за счет дегидратации
метанола), метан (как продукт гидрирования метанола и СО), диоксид углерода
и вода:
Получаются также: другие спирты, альдегиды, ацетона.
Селективность реакции по метанолу в присутствии указанных катализаторов является высокой, превышая 95%.
Слайд 21Выбор параметров процесса
■ Температура зависит от активности катализаторов и
может изменяться в пределах 250—420 °С.
■ В зависимости от
этого выбирают давление, которое, в соответствии с термодинамическими характеристиками, должно быть тем больше, чем выше температура, и может изменяться от 5 до 20—35 МПа.
■ Снижение давления благоприятно для уменьшения энергетических затрат на сжатие газа. Этому же способствует снижение рециркуляции непревращенного газа, т. е. увеличение фактической степени конверсии реагентов.
■ Приближение к равновесной степени конверсии невыгодно из-за падения производительности и селективности. Поэтому фактическую степень конверсии синтез-газа ограничивают величиной 15—20%, что достигается при времени контакта 10—40 с.
■ Долгое время процесс проводили при высоких давлении и температуре (20—35 МПа и 370—420 °С) с оксидным цинк-хромовым катализатором.
■ В настоящее время благодаря тонкой очистке синтез-газа стали применять более активные катализаторы на основе СиО-Сг203 и ZnO-CuO-Cr203 с добавками промоторов, что позволило снизить температуру до 250—300°С и давление до 5—10 МПА.

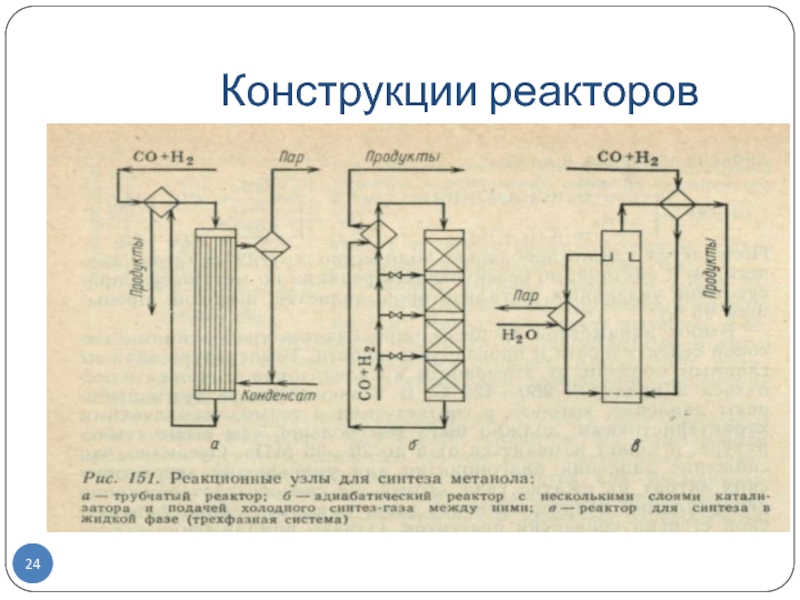
Слайд 22Реакционный узел при синтезе метанола
зависит от способа отвода тепла
и проведения реакции.
Трубчатые реакторы :(рис. 151,а), в трубах находится катализатор
и движется реакционная масса, охлаждаемая кипящим в межтрубном пространстве водным конденсатом. Тепло реакционных газов используют для подогрева исходной смеси.
Достигается наиболее высокий эксергетический к. п. д. и генерируется да 1 т пара высокого давления на 1 т метанола, но высока металлоемкость аппарата.
Адиабатические реакторы с несколькими (обычно с четырьмя) слоями катализатора:
Теплоплообменные устройства отсутствуют, для съема тепла и регулирования температуры подают холодный синтез-газ между слоями катализатора через специальные ромбические распределители, обеспечивающие эффективное смешение горячего и холодного газа.
Профиль температуры в таком реакторе ступенчатый, постепенное повышение в слоях катализатора сменяется резким падением при смешении с холодным газом. Предварительно подогревают лишь часть исходного синтез-газа, а остальное реакционное тепло утилизируют для получения пара высокого давления. С точки зрения эксергетического к. п. д., более выгодна несколько измененная схема, когда для подогрева исходного газа используют только необходимую часть реакционных газов, а основная их масса идет в котел-утилизатор.

Слайд 23Синтез метанола в трехфазной системе (рис. 151, в).
В жидкой фазе
инертного углеводорода с суспендированным в жидкости гетерогенным катализатором и барботированием
синтез-газа через эту суспензию.
Тепло реакции отводят за счет циркуляции жидкости через парогенератор или при помощи внутренних теплообменников с кипящим водным конденсатом.
Метанол (и часть углеводорода) уносятся непревращенным синтез-газом; их тепло используют для подогрева исходного газа.
Преимущество этого способа состоит в более благоприятном для синтеза состоянии равновесия при жидкофазной реакции, что позволяет достигнуть концентрации метанола в реакционном газе 15 % (об.) вместо 5 % (об.) при обычном синтезе, доведя степень конверсии синтез-газа до 35 вместо 15 %. Этим снижаются рециркуляция газа и энергетические затраты.
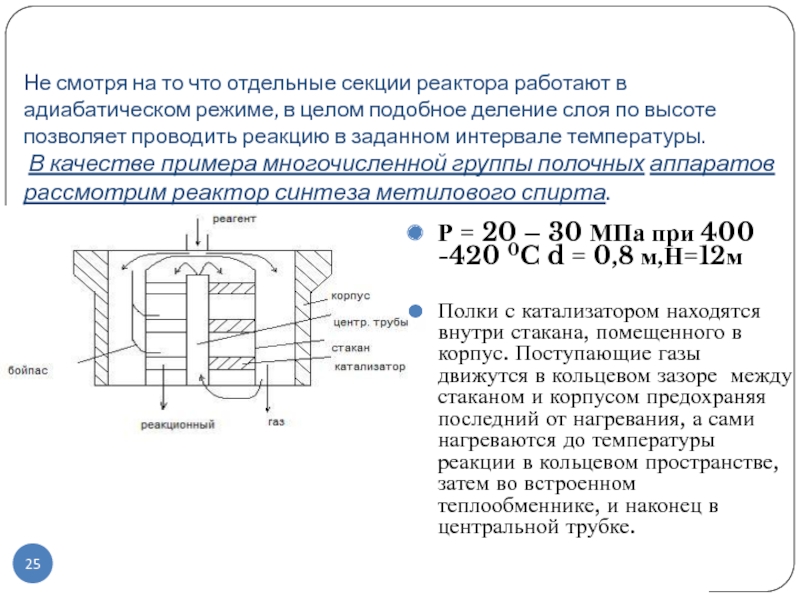
Слайд 25Не смотря на то что отдельные секции реактора работают в
адиабатическом режиме, в целом подобное деление слоя по высоте позволяет
проводить реакцию в заданном интервале температуры.
В качестве примера многочисленной группы полочных аппаратов рассмотрим реактор синтеза метилового спирта.
Р = 20 – 30 МПа при 400 -420 0C d = 0,8 м,Н=12м
Полки с катализатором находятся внутри стакана, помещенного в корпус. Поступающие газы движутся в кольцевом зазоре между стаканом и корпусом предохраняя последний от нагревания, а сами нагреваются до температуры реакции в кольцевом пространстве, затем во встроенном теплообменнике, и наконец в центральной трубке.
Слайд 26Промышленный синтез метилового спирта включает три основные стадии:
1) получение смеси
окиси углерода и водорода (синтез-газ);
2) получение метилового спирта-сырца;
3) выделение и
очистка метилового спирта.
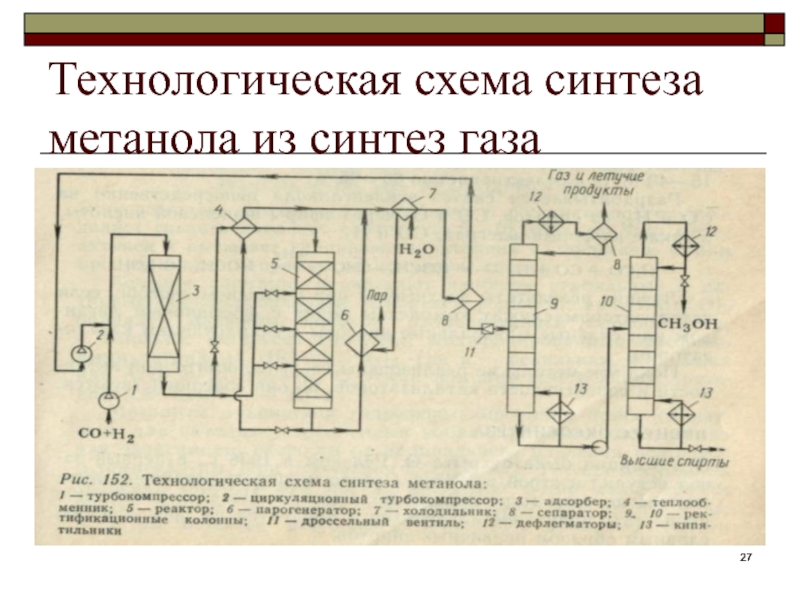
Слайд 27Технологическая схема синтеза метанола из синтез газа
Слайд 28ОПИСАНИЕ СХЕМЫ
Очищенный синтез-газ сжимают турбокомпрессором 1 до 5—10 МПа и
смешивают с циркулирующим газом, который дожимают до рабочего давления циркуляционным
турбокомпрессором 2. Смесь проходит адсорбер 3, предназначенный для очистки газа от пентакарбонила железа. Это вещество образуется при взаимодействии СО с железом аппаратуры и разлагается в реакторе с образованием мелкодисперсного железа, катализирующего нежелательные реакции получения СН4 и С02. По этой причине, а также из-за водородной коррозии реактор выполняют из легированной стали. Газ после адсорбера разделяют на два потока: один подогревают в теплообменнике 4 и подают на синтез в верхнюю
часть реактора 5, а другой вводят в реактор 5 между слоями катализатора в холодном виде для регулирования температуры и отвода тепла. Газ проходит сверху вниз через все слои катализатора и выходит из реактора при «300°С.
Этот газ тоже разделяют на два потока: один проходит теплообменник 4 и служит для подогрева части исходной смеси до температуры синтеза, а другой направляют в парогенератор 6, где его тепло используют для получения пара высокого давления. Потоки газа после этого объединяют и охлаждают в холодильнике 7, где метанол конденсируется и отделяется от газа в сепараторе 8 высокого давления. Газ с верха сепаратора дожимают циркуляционным компрессором 2 и возвращают на синтез.
Конденсат с низа сепаратора дросселируют до давления, близкого к атмосферному, и в ректификационной колонне 9 отделяют метанол от растворенных газов

Слайд 29и летучих продуктов (диметиловый эфир), которые идут на сжигание. В
следующей ректификационной колонне 10 отгоняют метанол от небольшого количества тяжелых
примесей (высшие спирты), которые также направляют на сжигание. Полученный товарный метанол имеет высокую степень чистоты (до 99,95 % основного вещества) и получается с общим выходом до
95 % при учете всех потерь.
Слайд 30.
жидкость (т. кип. 82,5°С), смешивающаяся с водой.
Его пары дают
с воздухом взрывоопасные смеси в пределах концентраций 2—12% (об.).
Образует
с водой азеотропную смесь, содержащую 88 % спирта и кипящую при 80,3°С.
Изопропанол нашел применение в качестве растворителя, заменяющего во многих случаях этанол. Кроме того, из него получают сложные эфиры, ацетон и т. д.
Получают исключительно синтетическим путем, а именно гидратацией пропилена.
Изопропанол СН3СНОНСН3
Слайд 31 ПРОПАНОЛ
Пропиловый спирт (пропан-1-ол, 1-пропанол) C3H7OH — одноатомный спирт. Существует
изомер 1-пропанола — изопропиловый спирт (пропан-2-ол, 2-пропанол).
Пропиловый спирт обладает всеми
химическими свойствами одноатомных спиртов.
Слайд 32Промышленные способы получения н-пропанола, и изобутанола
•Гидроформилирование ( оксосинтез) этилена с
последующим гидрированием
CH2=CH2 + CO + 2H2 → C3H7OH
Первый
этап: T- 80—120 °С, давление 2 МПа, катализатор: карбонил родия.
Второй этап: Восстановление альдегидов в мягких условиях — при 50—150°С (на никелевых и медьхромоксидных катализаторах) или при 200—250°С (с сульфидами металлов)
Гидрирование -завершающая стадия превращения в спирты альдегидов, получаемых оксосинтезом из олефинов, СО и Н2:
Слайд 33Побочные реакции
Образование полуацеталей и ацеталей
Альдольная конденсация
Слайд 34Гидроформилирование( оксосинтез) -----в гетерофазной среде, барботируя смесь СО и Н2
через жидкую реакционную массу.
Эти газы плохо растворимы в органических
жидкостях, и для преодоления диффузионных сопротивлений очень важно достаточное перемешивание смеси. (применение избытка смеси СО + Н2; коэффициент циркуляции (отношение рециркулята к свежему синтез-газу) составляет (2/3): 1.)
Смесь СО + Н2 обычно берут в стехиометрическом отношении (1:1), требуемом для оксосинтеза.
Селективность реакции растет при понижении температуры. большинство побочных реакций являются последовательными по отношению к образованию альдегидов. Чтобы снизить их роль, важно создать условия, при которых скорость гидроформилирования была бы высокой, а скорость конденсации альдегидов небольшой. Это достигается за счет неполной конверсии олефинов и применения растворителей — побочных продуктов реакции (кубовые остатки от перегонки, содержащие тримеры альдегидов, спирты и др.), а также различных углеводородов (толуол и пентан-гексановые фракции).
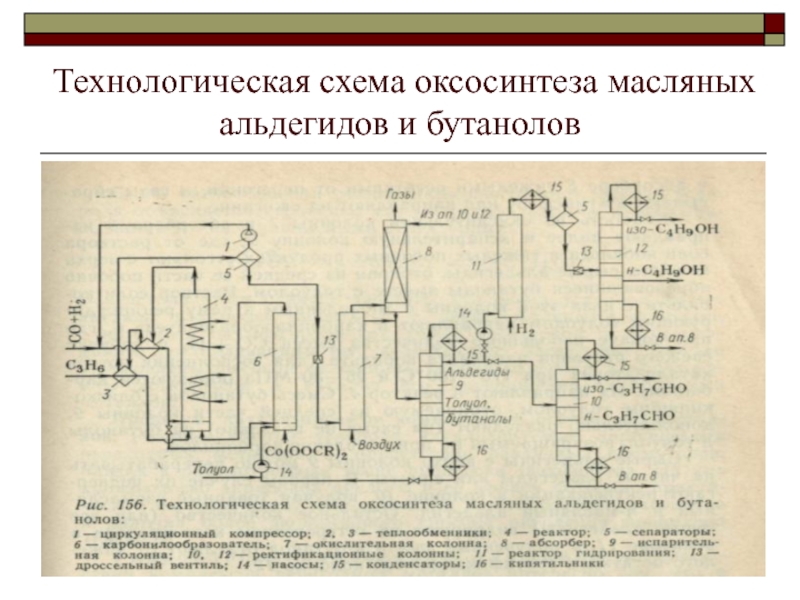
Слайд 35Технологическая схема оксосинтеза масляных альдегидов и бутанолов
Слайд 36Жидкая пропиленовая фракция, а также свежий синтез-газ под давлением 25—30
МПа и рециркулирующий синтез-газ, сжатый до этого же давления циркуляционным
компрессором /, подогревают соответственно в теплообменниках 2 и 3 за счет тепла горячей реакционной массы. Затем они поступают в реактор 4, куда из карбонилообразователя 6 подают раствор карбонилов кобальта в толуоле и тяжелых остатках от перегонки продуктов. В реакторе 4 при Т—160°С происходит образование альдегидов и побочных веществ, причем выделяющееся тепло отводят водой или кипящим водным конденсатом (в зависимости от температуры) с получением пара низкого давления.
Тепло реакционной массы используют в теплообменниках 2 и 3, а в сепараторе 5 отделяют жидкость от синтез-газа, который вместе с частью непревращенного пропилена возвращают на реакцию компрессором /. Жидкость из сепаратора дросселируют до 0,2—0,4 МПа и при 40—70 °С окисляют небольшим количеством воздуха в окислительной колонне 7 (декобальти-зёр). Вместе с воздухом, обедненным кислородом, в газовую фазу в этой колонне переходят СО, Нг и пропилен, находившиеся в растворенном состоянии при высоком давлении, а также пары альдегидов, унесенные газом. Последние поглощают в абсорбере 8 тяжелыми остатками от перегонки, а газы сбрасывают в атмосферу или направляют на сжигание

Слайд 37Жидкость из окислительной колонны 7 и абсорбера 8 направляют далее
в испарительную колонну 9, где от раствора соли кобальта в
тяжелых побочных продуктах отгоняют с верха колонны сырые альдегиды, отбирая из средней ее части побочно образовавшиеся бутанолы вместе с толуолом. Раствор соли кобальта с низа этой колонны с добавленным к нему рециркулирующим толуолом направляют в карбонилообразователь 6, где при подаче небольшого количества смеси СО + Н2 и добавке свежего раствора нафтената кобальта (для восполнения потерь катализатора) при 170—180°С и 25—30 МПа образуются карбонилы. Их направляют в реактор 4. Смесь бутанолов с близко-кипящим толуолом, отбираемую из средней части колонны 9, дополнительно разделяют (на схеме не показано) на бутанолы и толуол, возвращаемый на приготовление карбонилов.
Сырые альдегиды с верха колонны 9 можно перерабатывать на чистые альдегиды или спирты. В первом случае их подвергают ректификации в колонне 10, получая товарные изомасляный и масляный альдегид. Остальное количество (или все сырые альдегиды) гидрируют на гетерогенном катализаторе в реакторе 11, а полученные изо- и м-бутанол отделяют от тяжелого остатка в ректификационной колонне 12.

Слайд 38ПРОИЗВОДСТВО ИЗОПРОПАНОЛА
Газофазная гидратация с фосфорнокислотным катализатором. CH3-CH=CH2 + H2O →
CH3CH(OH)CH3
Ввиду более высокой реакционной способности пропилена температура реакции 200°С,
когда равновесие более благоприятно для гидратации. Поэтому давление при синтезе можно снизить до 2—3 МПа.
При этом, чтобы предотвратить чрезмерное образование диизопропилового эфира, приходится ограничивать степень конверсии водяных паров уровнем 4—5%, что позволяет после конденсации получать 15—20 %-й спирт.
степень конверсии пропилена достигается регулированием состава исходной смеси: при синтезе изопропанола, в отличие от гидратации этилена, используют избыток водяного пара и доводят степень конверсии пропилена до 10—12 %. Все это существенно улучшает технико-экономические показатели производства по сравнению с прямой гидратацией этилена и тем более с сернокислотным методом.
Слайд 392.При жидкофазной гидратации пропилена ----катализатор --- сульфокатионит (сульфированный сополимер стирола
с дивинилбензолом; размер частиц 0,2—0,9 мм). Он активен для гидратации
пропилена уже при 130—150°С. При Р—10 МПа и мольном отношении Н20 : С3Н6 = (12,5—15) : 1 степень конверсии пропилена достигает 75—80%-
Реактор с четырьмя слоями катализатора (рис. 63) при прямоточном движении (сверху вниз) газообразного пропилена и воды, омывающей зерна катализатора. Для регулирования температуры снимают выделяющееся тепло за счет подачи части воды в недостаточно подогретом состоянии между слоями катализатора. Одновременно это позволяет создать близкий к оптимальному для обратимой экзотермической реакции профиль температуры, понижающейся по мере протекания реакции.
Другой жидкофазный процесс основан на применении в качестве катализатора поли -вольфрамовой кислоты при 240—270СС и 15—20 МПа, когда степень конверсии пропилена составляет 60—70%, а селективность по изопропанолу доходит до 98 %
Рис. 63. Реакционный узел для гидратации пропилена на сульфокатионите
Слайд 40
Аналогичным образом прямой гидратацией н-бутенов можно получать втор-бутанол.
Существует и
способ прямой гидратации изобутена на сульфокатионите, являющийся составной частью переработки
С4-фракций и служащий для извлечения изобутена.
Слайд 41Синтез н-бутанола из ацетальдегида.
При альдольной конденсации ацетальдегида образуется гидроксимасляный
альдегид, называемый просто альдолем:
Его используют как промежуточный продукт для
получения бутандиола-1,3, кротонового альдегида и н-бутанола. Предлагался также метод синтеза бутадиена через альдоль (метод Остромысленского), сейчас, потерявший значение:
Слайд 42Практическое значение имеет только синтез н-бутанола. Его экономичнее получать оксосинтезом
из пропилена, СО и Н2
Конденсацию ацетальдегида проводят при 20—300С
в присутствии 0,05 % щелочи. Чтобы избежать образования высших продуктов конденсации, степень конверсии ацетальдегида ограничивают 40—60%
При этом в реакционной массе находится
не сам альдоль, а его циклический ацеталь с исходным ацетальдегидом (производное 1,3-диоксана
Ацеталь разлагается при перегонке на альдоль и ацетальдегид Для синтеза кротонового альдегида и далее н-бутанола, подкисляют реакционную массу уксусной или фосфорной кислотой; тогда при перегонке не только разлагается ацеталь, но и происходит дегидратация альдоля в кротоновый альдегид. После отгонки ацетальдегида кротоновый альдегид перегоняют в виде азеотропной смеси с 10 % воды. Выход альдегида достигает 90 %.
Спирты применяют как растворители, в том числе в виде сложных эфиров уксусной кислоты (особенно н-бутилацетат). н-Бутанол, кроме того, используют для получения трибутилфталата (пластификатор), трибутилфосфата (экстрагент).
Слайд 43Производство 2-этилгексанола
Сложные эфиры которого широко применяют как пластификаторы полимеров, как
смазочные масла и присадки.
Получают альдольной конденсацией н-масляного альдегида с
последующей дегидратацией в 2-этилгексеналь и гидрированием последнего в 2-этилгексанола
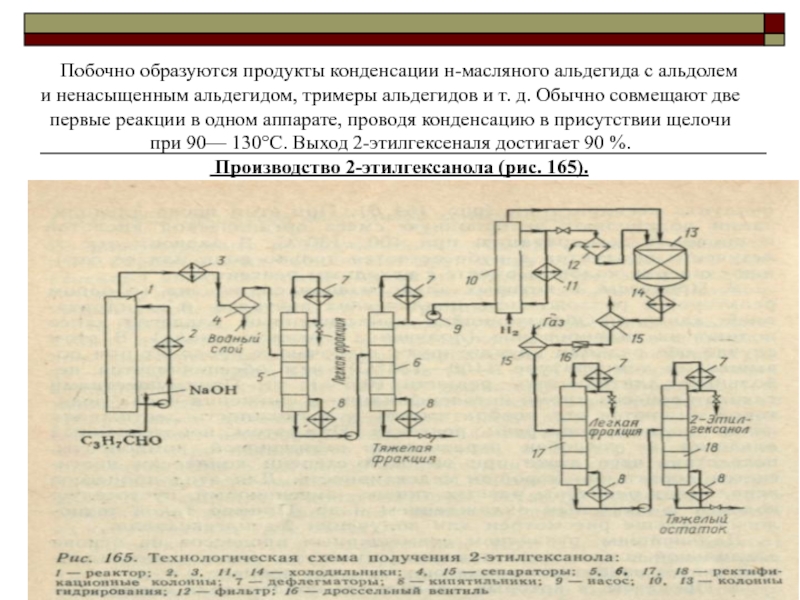
Слайд 44Побочно образуются продукты конденсации н-масляного альдегида с альдолем и ненасыщенным
альдегидом, тримеры альдегидов и т. д. Обычно совмещают две первые
реакции в одном аппарате, проводя конденсацию в присутствии щелочи при 90— 130°С. Выход 2-этилгексеналя достигает 90 %.
Производство 2-этилгексанола (рис. 165).
Слайд 45К н-масляному альдегиду, поступающему в реактор1, непосредственно перед введением в
реактор дозируют 40%-й NaOH (0,05%). Температурный режим в реакторе (100—130°С)
поддерживают за счет выделяющегося тепла, избыток которого снимают путем циркуляции реакционной массы через выносной холодильник 2. В реакторе происходят альдолизация и дегидратация альдоля с образованием 2-этилгексеналя. Продукты реакции охлаждают в холодильнике 3, после чего они расслаиваются в сепараторе 4 на нижний (водный) и верхний (органический) слой. Воду направляют на отпаривание органических веществ и затем на очистку. Органический слой подвергают ректификации в колоннах 5 и 6, отгоняя вначале легкий погон (непревращенныймасляный альдегид, остатки воды и др.), а затем (в вакууме) 2-этилгексеналь, выводя из куба колонны 6 тяжелые побочные продукты.
2-Этнлгексеналь подвергают затем гидрированию. Чтобы избежать в дальнейшем потемнения эфиров 2-этилгексанола и полимерных материалов (к которым эти эфиры добавляют как пластификаторы), гидрирование нужно вести до высокой степени насыщения как двойных связей, так и альдегидных групп. По этой причине гидрирование проводят в две стадии в жидкой фазе под давлением 2—3 МПа.
Описание технологической схемы производства 2-этилгексанола

Слайд 46Первую ступень гидрирования проводят в колонне 10 с суспендированным в
жидкости смешанным металлоксидным катализатором. Тепло реакции отводится за счет нагревания
водорода, частичного испарения и циркуляции смеси через выносной холодильник 11. Вторая стадия (дегидрирование) ведется в адиабатических условиях в аппарате 13 со стационарным слоем катализатора Ni • Cr203, причем жидкость из реактора 10 предварительно освобождается от взвешенного катализатора в фильтре 12. После охлаждения газожидкостную смесь из реактора 13 разделяют в сепараторе 15, после которого водород дожимают до рабочего давления и возвращают в реактор первой стадии, а жидкость дросселируют и направляют на ректификацию Ректификация проводится под вакуумом в колоннах 17 и /5. Вначале отгоняют легкий погон и затем отделяют технически чистый 2-этилгексанол от тяжелого остатка, направляемого на сжигание. Выход продукта составляет 85—90 %
Слайд 47Более новые способы синтеза 2-этилгексанола состоят в совмещении оксосинтеза масляных
альдегидов с альдольной конденсацией и дегидратацией (альдокс-процесс), когда к карбонилам
кобальта добавляют щелочь, катализирующую две последние реакции.
Предложен и другой процесс, совмещающий гидроформилирование, альдольную конденсацию, дегидратацию и гидрирование. Это удается осуществить в присутствии щелочи и при катализе карбонилами кобальта, модифицированными трибутилфосфином.
Слайд 48Применение спиртов в качестве топлива
Для топливных целей в настоящий момент
используются в промышленных объёмах три спирта: метанол, этанол и бутанол,
что связано, прежде всего, с их коммерческой доступностью и возможностью массового производства из растительного сырья (кроме метанола. При этом возможно использование спиртов в виде горючего в чистом виде, в виде различных смесей с бензином или дизельным топливом а также в качестве оксигенирующих добавок (до 10 %) с целью повышения октанового числа и снижения токсичности отработанных газов Также отдельным направлением является использование метанола для переэтерификации жиров в производстве биодизеля
Основные причины, послужившие активному изучению спиртов в качестве альтернативного горючего, это:
-рост цен на нефть и газ,
-исчерпаемость этих ресурсов в ближайшем будущем;
-спирты обладают высокими эксплуатационными характеристиками, а продукты сгорания содержат меньше вредных веществ;
-спирты могут изготавливаться биохимическим методом из отходов пищевой, деревообрабатывающей и целлюлозно-бумажной промышленности, тем самым попутно решая проблему утилизации.

Слайд 49Массовое использование вышеуказанных спиртов в качестве
моторного топлива, помимо чисто
экономических причин, имеет ряд недостатков:
-метанол и этанол обладают по сравнению
с бензином меньшей энергоэффективностью и, соответственно, обеспечивают больший расход;
-низкие температуры кипения спиртов могут служить причиной образования паровых пробок, что может существенно усложнить работу двигателя;
-гигроскопичность спиртов, а также их растворимость в воде может привести к резкому снижению мощности при попадании влаги в топливную систему;
-спирты обладают существенно более высокими коррозионными характеристиками по сравнению с углеводородами;
-относительно высокая скрытая теплота сгорания метанола и этанола может служить причиной проблемы при смешении этих спиртов с воздухом и дальнейшей транспортировки через впускной коллектор двигателя.