Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Окислительное фосфорилирование. Тканевое дыхание
Содержание
- 1. Окислительное фосфорилирование. Тканевое дыхание
- 2. Общая схема катаболизма
- 3. Карта основныхпутейметаболизма
- 4. Катаболизм основных пищевых веществ1-3 пищеварение; 4-8 специфические
- 5. Связь реакций общего пути катаболизма с ЦПЭ1-5
- 6. Слайд 6
- 7. Катаболизм органических веществ в тканях сопровождается потреблением
- 8. Окисляемые различные органические вещества(S – субстраты), представляют
- 9. Окислительное фосфорилирование – основная частьбиологического окисления или
- 10. Впервые механизм окислительного фосфорилированиябыл предложен П.Митчеллом. Согласно
- 11. Митохондрии По современнымпредставлениям внутренняямитохондриальная мембранасодержит ряд мультиферментных
- 12. По современным представлениям внутренняя митохондриальная мембрана содержит
- 13. ПРИНЦИП РАБОТЫ ДЫХАТЕЛЬНОЙ ЦЕПИ В целом работа
- 14. Общая схема окислительного фосфорилированияТаким образом восстановленные формы
- 15. ФЕРМЕНТНЫЕ КОМПЛЕКСЫ ДЫХАТЕЛЬНОЙ ЦЕПИВсего цепь переноса электронов
- 16. Комплексы дыхательной цепи I комплекс -
- 17. Митохондриальная цепь переноса электронов
- 18. Функции комплексов дыхательной цепиI комплекс – 1.
- 19. IV комплекс – 1. Принимает электроны от
- 20. Пути поступления электронов и протонов в дыхательную цепь переносчиков (ферментов от первичных доноров)
- 21. Работа комплексов дыхательной цепи Ферменты дыхательной цепи
- 22. Стандартные окислительно-восстановительные потенциалы некоторых сопряженных пар
- 23. 3. Здесь атомы водорода (от НАДН и
- 24. 5. Перенос ионов водорода через мембрану (выкачивание)
- 25. Энергетические соотношения в дыхательной цепи митохондрий и
- 26. Рис. Изменение свободной энергии (Ео) при переносе
- 27. 6. Как завершение всех предыдущих событий
- 28. Сопряжение тканевого дыхания и синтеза АТФ1.
- 29. Рис. Сопряжение дыхания и синтеза АТФ в
- 30. 3. Каждый из трех комплексов ЦПЭ (I,
- 31. о Витамине СВит С
- 32. Сопряжение дыхания и синтеза АТФ в митохондриях
- 33. При участии АТФ-АДФ транслоказы, расположенной во внутренней
- 34. На всех этапах процесса часть энергии рассеивается в виде тепла
- 35. Аналоги АТФ: ГТФ ЦТФ УТФ
- 36. Дыхательный контрольПеренос электронов по ЦПЭ и синтез
- 37. Синтез АТФ регулируетсяРабота дыхательных ферментов регулируется с
- 38. Возрастание протонного градиента возникает при исчерпании запасов
- 39. Таким образом скорость синтеза АТФ точно соответствует
- 40. Разобщение дыхания и синтеза АТФ Некоторые липофильные вещества
- 41. Терморегуляторная функция дыханияПри переносе электронов по ЦПЭ
- 42. Кроме того дополнительное образование теплоты может происходить
- 43. У новорожденных и зимнеспящих животных разобщение связано
- 44. Рис. Роль термогенина в митохондрииКроме динитрофенола, жирных
- 45. Ингибиторы дыханияНекоторые лекарственные вещества, химические агенты и
- 46. Рис. Ингибиторы ферментов дыхательной цепи
- 47. Гипоэнергетические состоянияПричинами гипоэнергетических состояний может быть следующее:
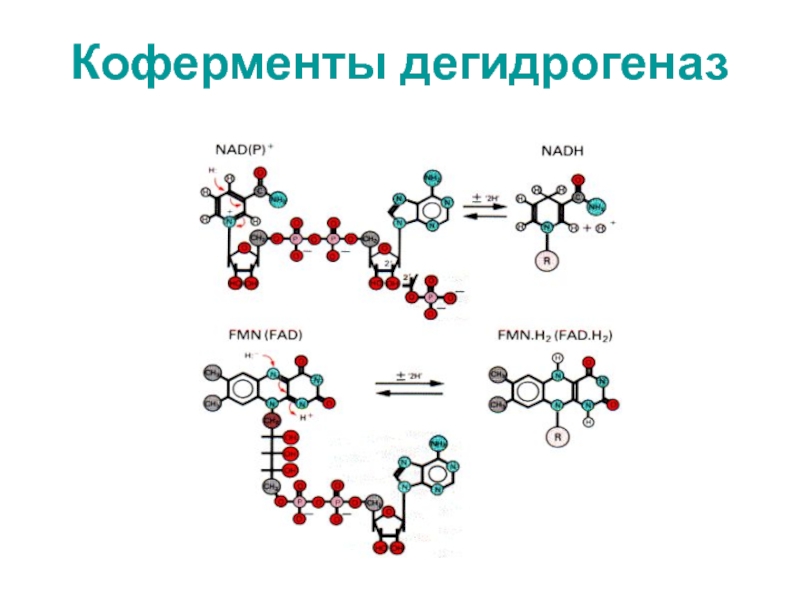
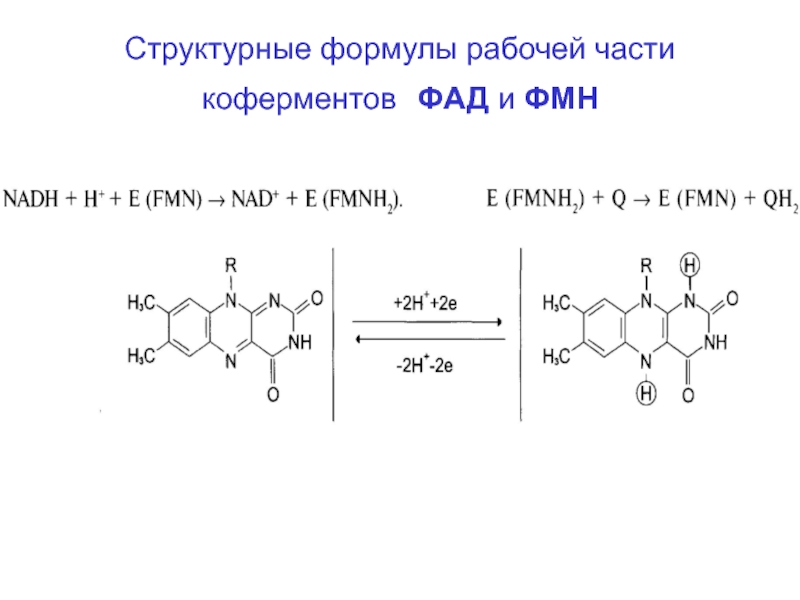
- 48. Состав компонентов дыхательной цепиНАД содержит витамин В3
- 49. Компоненты дыхательной цепи
- 50. Коферменты дегидрогеназ
- 51. Структурные формулы рабочей части коферментов НАД и НАДФ
- 52. Структурные формулы рабочей части коферментов ФАД и ФМН
- 53. Структура убихинона (кофермента Q)
- 54. Цитохромы - это гемопротеины - белки,содержащие в
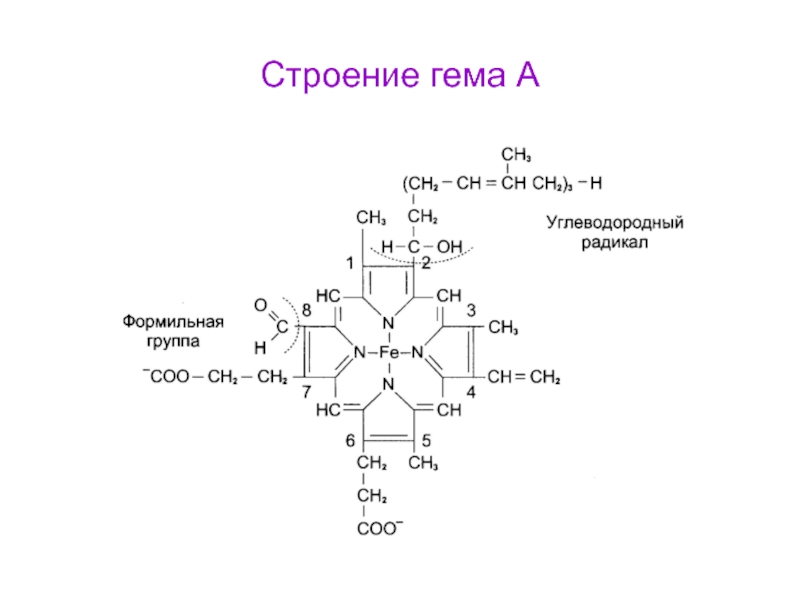
- 55. Строение гема А
- 56. Атом железа в геме может менять валентность,
- 57. В цитохромах С и С1 дополнительные ковалентные
- 58. Цитохромоксидаза включает комплекс цитохромов а и а3(комплекс
- 59. Структура гема цитохромов b, c, c1
- 60. Катаболизм основных пищевых веществ1-3 пищеварение; 4-8 специфические
- 61. Связь реакций общего пути катаболизма с ЦПЭ1-5
- 62. Скачать презентанцию
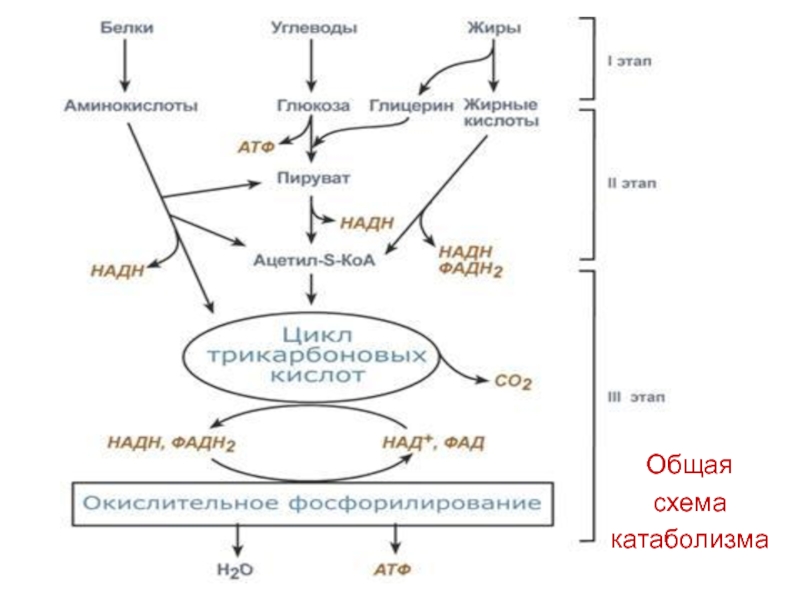
Общая схема катаболизма
Слайды и текст этой презентации
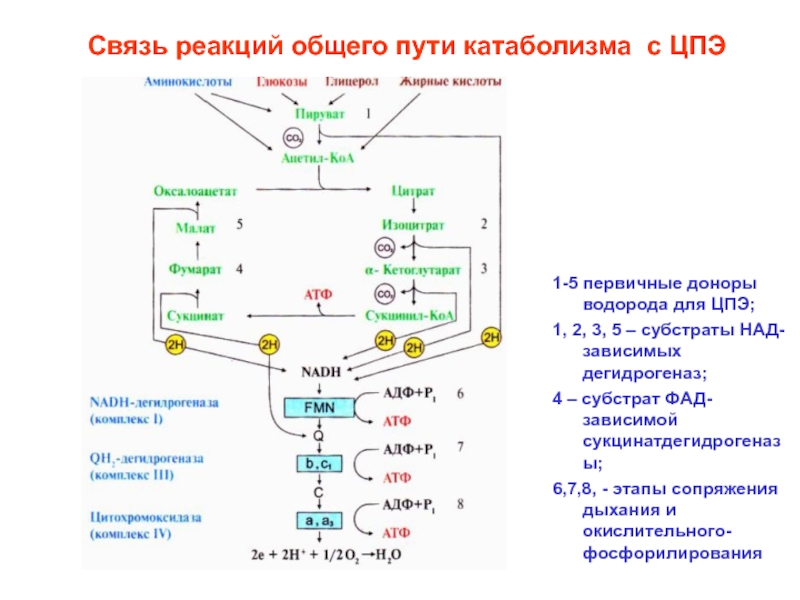
Слайд 5Связь реакций общего пути катаболизма с ЦПЭ
1-5 первичные доноры водорода
для ЦПЭ;
1, 2, 3, 5 – субстраты НАД-зависимых дегидрогеназ;
4 –
субстрат ФАД-зависимой сукцинатдегидрогеназы;6,7,8, - этапы сопряжения дыхания и окислительного- фосфорилирования
Слайд 7Катаболизм органических веществ в тканях
сопровождается потреблением О2 и
выделением
СО2.
Этот процесс называют тканевым дыханием.
Кислород в этом процессе используется как
акцептор водорода от окисляемых (дегидрируемых)
субстратов, в результате чего синтезируется вода.
Процесс окисления можно представить следующим
уравнением:
SH2 + ½ O2 → S + H2O
Слайд 8Окисляемые различные органические вещества
(S – субстраты), представляют собой метаболиты
катаболизма,
их дегидрирование является
экзорганическим процессом.
Энергия, высвобождаемая в ходе реакций окисления,
либо полностью рассеивается в виде тепла, либо
частично тратится на фосфорилирование AТФ с
образованием АТФ.
Организм превращает около 40% энергии, выделяющейся
при окислении, в энергию макроэргических связей АТФ.
Большинство анаэробов биоты использует этот
способ или очень сходный с ним как основной источник
энергии, необходимый для синтеза внутриклеточной АТФ
(объяснить: в качестве терминального акцептора водорода может
быть не кислород, а другое соединение)
Слайд 9Окислительное фосфорилирование – основная часть
биологического окисления или тканевого дыхания, т.е.
процессов,
идущих в организме с участием кислорода.
АДФ+Рi = АТФ
Окислительное фосфорилирование
– это многоэтапный процесс, происходящий во
внутренней мембране митохондрий и
заключающийся в окислении восстановленных
эквивалентов (НАДН и ФАДН2) и сопровождающийся
синтезом АТФ.
Слайд 10Впервые механизм окислительного фосфорилирования
был предложен П.Митчеллом. Согласно этой гипотезе
перенос
электронов, происходящий на внутренней
митохондриальной мембране, вызывает выкачивание
ионов Н+
из матрикса митохондрий в межмембранноепространство. Это создает градиент концентрации
ионов Н+ между внутренней и внешней поверхностями
внутренней мембраны митохондрий. Ионы
водорода (протоны) из межмембранного пространства в
норме способны возвращаться в матрикс митохондрий
только одним способом – через специальный фермент,
– АТФ-синтазу (или АТФ-синтетаза).
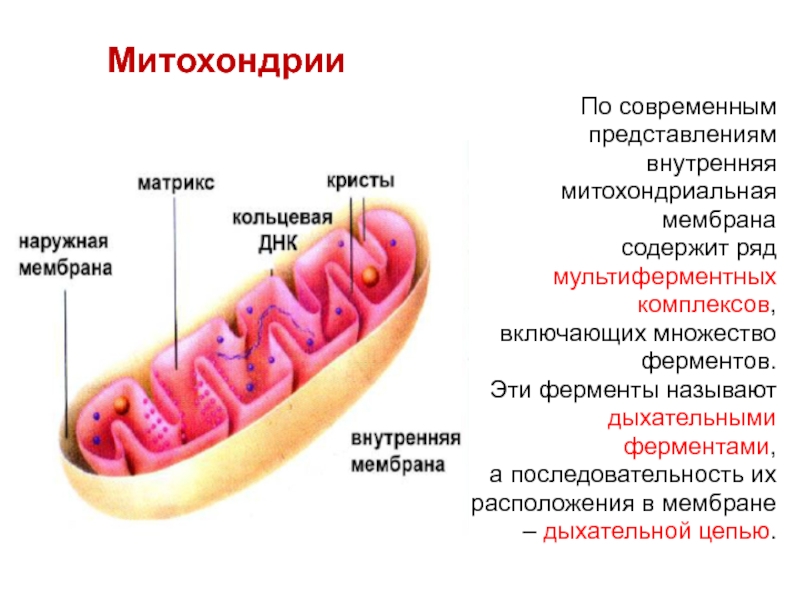
Слайд 11Митохондрии
По современным
представлениям
внутренняя
митохондриальная
мембрана
содержит ряд
мультиферментных
комплексов,
включающих множество
ферментов.
Эти ферменты называют
дыхательными
ферментами,
а последовательность их
расположения в
мембране – дыхательной цепью.
Слайд 12По современным представлениям внутренняя
митохондриальная мембрана содержит ряд
мультиферментных комплексов,
включающих
множество ферментов. Эти ферменты называют
дыхательными ферментами, а последовательность
ихрасположения в мембране – дыхательной цепью.
Сущность дыхательной цепи состоит в том, что
водороды (Н+, ӗ) снятые с окисляемых субстратов не
сразу попадают на кислород, а переносятся рядом
переносчиков, при этом энергия электронов и протонов
используется для синтеза АТФ, совершения
осмотической работы и тепла.
Слайд 13ПРИНЦИП РАБОТЫ ДЫХАТЕЛЬНОЙ ЦЕПИ
В целом работа дыхательной цепи заключается
в следующем:
1. Образующиеся в реакциях катаболизма НАДН и ФАДН2
передают атомы водорода (т.е. протоны водорода и электроны) на ферменты дыхательной цепи. 2. Электроны движутся по дыхательной цепи и теряют энергию.
3. Эта энергия используется на выкачивание протонов Н+ из матрикса в межмембранное пространство.
4. В конце дыхательной цепи электроны попадают на кислород и восстанавливают его до воды.
5. Протоны Н+ стремятся обратно в матрикс и проходят через АТФ-синтазу.
6. При этом они теряют энергию, которая используется для синтеза АТФ.
Слайд 14Общая схема окислительного фосфорилирования
Таким образом восстановленные формы НАДН и ФАДН2
окисляются ферментами дыхательной цепи, благодаря
этому происходит присоединение фосфата к
АДФ, т.е. фосфо-рилирование. Поэтому весь процесс получил название
окислительное фосфорилирование,
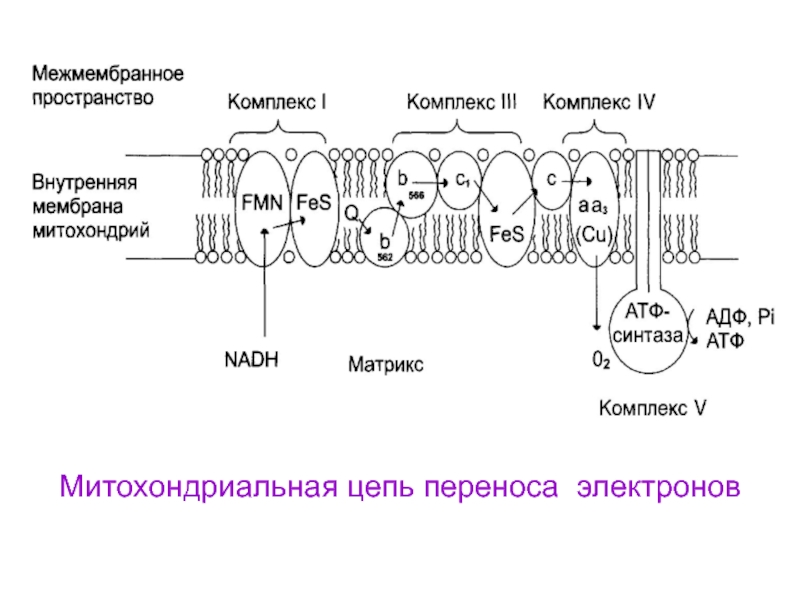
Слайд 15ФЕРМЕНТНЫЕ КОМПЛЕКСЫ ДЫХАТЕЛЬНОЙ ЦЕПИ
Всего цепь переноса электронов включает в себя
около 40 разнообразных белков и один небелковый
переносчик . Все
они организованы в 4 больших мембранно-связанных мульферментных комплексов (I, II, III, IV).
Блок схема дыхательной цепи (ЭТЦ)
И существует еще один комплекс V, который не
участвует в переносе электронов, это – АТФ-синтаза
Слайд 16Комплексы дыхательной цепи
I комплекс - НАДН-дегидрогеназа,
II
комплекс - включает в себя ФАД-зависимые ферменты
(как
таковой не существует, его выделение условно), III комплекс – комплекс цитохромов b-c1
IV комплекс – цитохромы аа3 или цитохромоксидаза
V комплекс – фермент АТФ-синтаза
Слайд 18Функции комплексов дыхательной цепи
I комплекс –
1. Принимает электроны от
НАДН и передает их на коэнзим Q (убихинон).
2. Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
II комплекс –
1. Восстановление ФАД в окислительно-восстановительных реакциях.
2. Обеспечение передачи электронов от ФАДН2 на железосерные белки внутренней мембраны митохондрий. Далее эти электроны попадают на коэнзим Q.
III комплекс –
1. Принимает электроны от коэнзима Q и передает их на цитохром с.
2. Переносит два Н+ на наружную поверхность внутренней митохондриальной мембраны.
V комплекс – фермент АТФ-синтаза
Слайд 19
IV комплекс –
1. Принимает электроны от цитохрома с и
передает их на кислород с образованием воды.
2. Переносит 4
иона Н+ на наружную поверхность внутренней митохондриальной мембраны. V комплекс – фермент АТФ-синтаза
используя энергию протонов, синтезирует АТФ из АДФ
и Н3РО4
Слайд 20
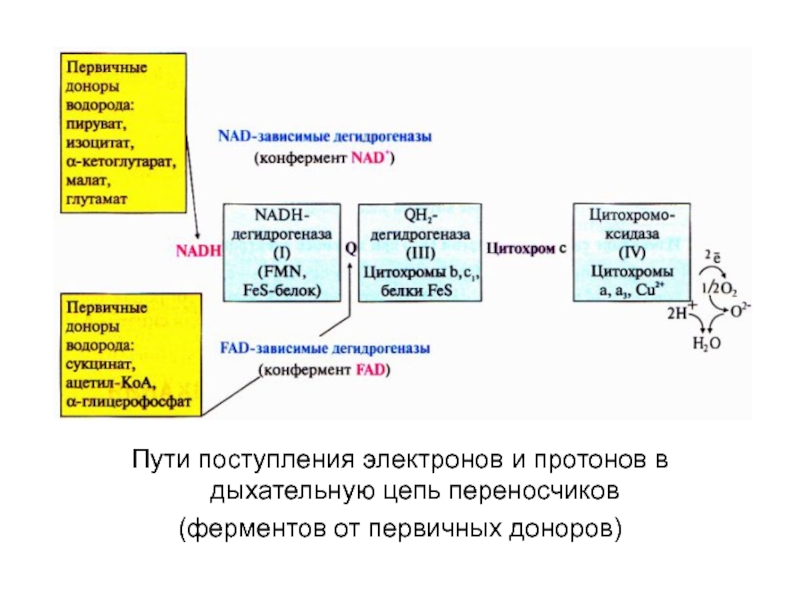
Пути поступления электронов и протонов в дыхательную цепь переносчиков
(ферментов от первичных доноров)
Слайд 21Работа комплексов дыхательной цепи
Ферменты дыхательной цепи расположены в строго
определенной
последовательности: каждый
последующий белок обладает большим сродством к
электронам, чем
предыдущий (он более электроположителен, т.е. обладает более
положительным ок.-восст. потенциалом). Это
обеспечивает однонаправленное движение электронов.
2. Все атомы водорода, отщепленные дегидрогеназами от
субстратов в аэробных условиях, достигают
внутренней мембраны митохондрий в составе НАДН
или ФАДН2.
Слайд 233. Здесь атомы водорода (от НАДН и ФАДН2)
передают свои
электроны в дыхательную
ферментативную цепь, по которой электроны
движутся (50-200
шт/сек) к своему конечному акцептору – кислороду.
В результате образуется вода.
4. Поступающие в дыхательную цепь электроны богаты
свободной энергией. По мере их продвижения по цепи они теряют энергию. Часть энергии электронов используется I, III, IV комплексами дыхательных
ферментов для перемещения ионов водорода через
мембрану в межмембранное пространство. Другая
часть рассеивается в виде тепла.
Слайд 24
5. Перенос ионов водорода через мембрану (выкачивание)
происходит не случайно,
а в строго определенных
участках мембраны. Эти участки называются участки
сопряжения (или, не совсем точно, пункты
фосфорилирования).
Они представлены I, III, IV комплексами дыхательных
ферментов. В результате работы этих комплексов
формируется градиент ионов водорода между внутренней
и наружной поверхностями внутренней митохондриальной
мембраны. Такой градиент обладает потенциальной
энергией. Градиент получил название электрохимический
или протонный градиент ("дельта мю"). Он имеет две
составляющие – электрическую и концентрационную и
обозначается - ∆μ или ∆μН+.
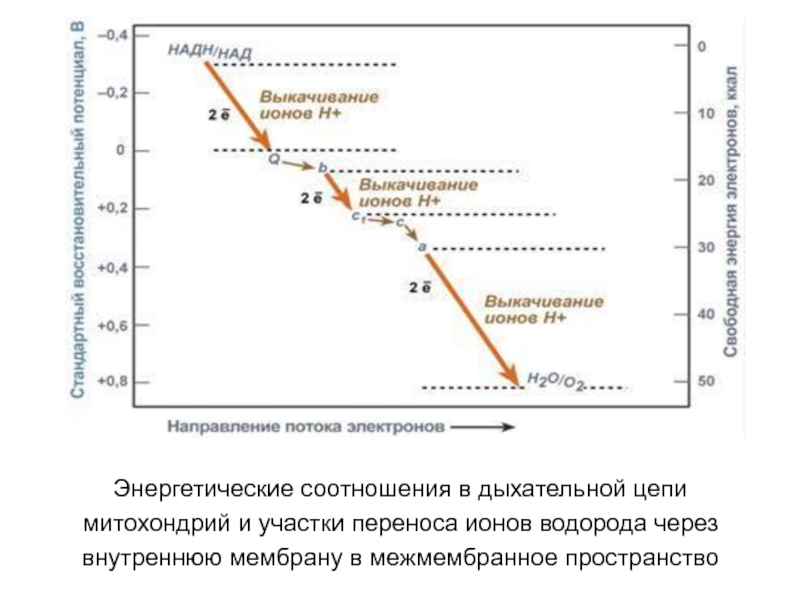
Слайд 25Энергетические соотношения в дыхательной цепи
митохондрий и участки переноса ионов
водорода через
внутреннюю мембрану в межмембранное пространство
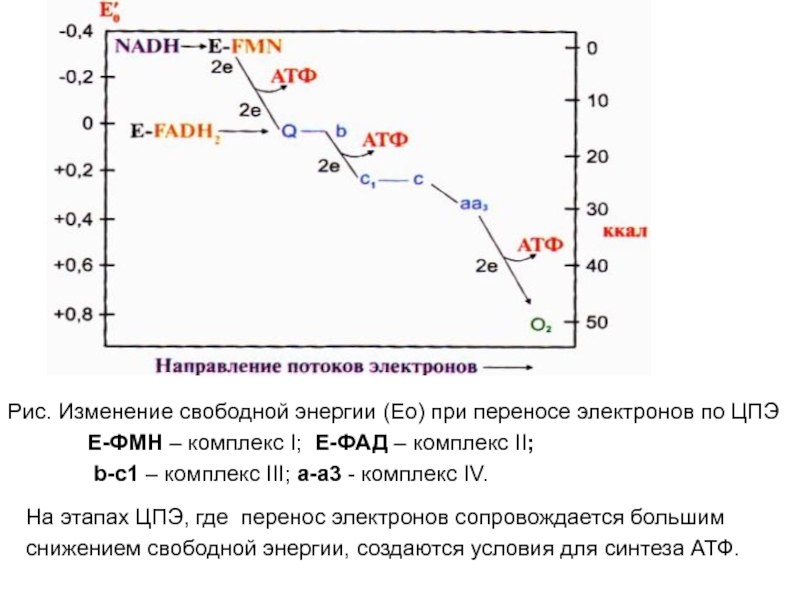
Слайд 26Рис. Изменение свободной энергии (Ео) при переносе электронов по ЦПЭ
Е-ФМН
– комплекс I; Е-ФАД – комплекс II;
b-c1 –
комплекс III; а-а3 - комплекс IV. На этапах ЦПЭ, где перенос электронов сопровождается большим
снижением свободной энергии, создаются условия для синтеза АТФ.
Слайд 27
6. Как завершение всех предыдущих событий и
необходимый их
результат происходит наработка АТФ.
Ионы водорода теряют свою энергию, проходя
(возвращаясь)
через АТФ-синтетазу. Часть этой энергии тратится на синтез АТФ, другая
рассеивается в виде тепла.
Слайд 28Сопряжение тканевого дыхания и
синтеза АТФ
1. Перенос электронов по ЦПЭ
при участии комплексов I, III и IV
сопровождается выделением наибольшего
количества энергии. Часть этой энергии используется для переноса Н+
из матрикса в межмембранное пространство, в результате
чего возрастает протонный электрохимический потенциал
∆μН+, основной составляющей которого является протонный градиент.
2. При достижении определенного протонного градиента
происходит активация АТФ-синтетазы (комплекс V ), в ней
открывается канал, через который протоны возвращаются в
матрикс из межмембранного пространства, а энергия ∆μН+
используется для синтеза АТФ
Слайд 29Рис. Сопряжение дыхания и синтеза АТФ в митохондриях
I – НАДН-дегидрогеназа;
III – QН2- дегидрогеназа;
IV- цитохромоксидаза; V- АТФ-синтетаза.
Энергия протонного химического
потенциала используется для синтеза АТФ, если протоны возвращаются через ионные каналы
АТФ-синтазы
Слайд 303. Каждый из трех комплексов ЦПЭ (I, III и IV
) обеспечивает
необходимый протонный градиент для активации
АТФ-синтетазы и синтеза
одной молекулы АТФ. Количество молекул АТФ, образованных при восстановлении одного
атома кислорода до Н2О при прохождении двух электронов по
ЦПЭ, эквивалентно количеству использованного фосфора
Н3РО4 (Р) и выражается коэффициентом окислительного
фосфорилирования (Р/О).
Если водород поступает в ЦПЭ от кофрементов НАДН, то
Р/О имеет максимальное значение, равное 3.
Если водород поступает в ЦПЭ от коферментов ФАД-
зависимых дегидрогеназ, то Р/О равен 2.
Реальное значение Р/О несколько ниже т.к. часть энергии
электрохимического потенциала рассеивается в форме теплоты).
Слайд 33При участии АТФ-АДФ транслоказы, расположенной
во внутренней мембране митохондрий, АТФ
транспортируется в цитоплазму в обмен на АДФ.
В цитоплазме АТФ
используется как источник энергии в различных процессах.
4. Таким образом, трансформация энергии в организме
проходит следующие этапы:
Слайд 36Дыхательный контроль
Перенос электронов по ЦПЭ и синтез АТФ тесно
сопряжены,
т.е. могут происходить только
одномоментно и синхронно.
При увеличении расхода АТФ
в клетке увеличивается количество АДФ (субстрата АТФ-синтазы)
увеличивается скорость синтеза АТФ. При этом снижается
протонный градиент, что стимулирует окисление
первичных доноров и увеличивает скорость переноса
электронов по ЦПЭ. Перенос электронов сопровождается
увеличением поглощения О2, транспорта протонов из
матрикса в межмембранное пространство и повышение
протонного градиента, необходимого для активации
АТФ-синтазы.
Слайд 37Синтез АТФ регулируется
Работа дыхательных ферментов регулируется с
помощью эффекта, который
получил название
дыхательный контроль.
Дыхательный контроль – это прямое влияние
электрохимического градиента на скорость движения
электронов по дыхательной цепи (величины дыхания).
В свою очередь, величина градиента напрямую зависит
от соотношения АТФ и АДФ, количественная сумма
которых в клетке постоянна
([АТФ] + [АДФ] = const).
Реакции катаболизма направлены на поддержание
постоянно высокого уровня АТФ и низкого АДФ.
Слайд 38Возрастание протонного градиента возникает при
исчерпании запасов АДФ и накоплении
АТФ, т.е. когда
АТФ-синтаза лишена своего субстрата и ионы Н+ не
проникают в матрикс митохондрии. При этом
ингибирующее влияние градиента усиливается и
продвижение электронов по цепи замедляется.
Ферментные комплексы остаются в восстановленном
состоянии. Следствием является уменьшение
окисления НАДН и ФАДН2 на I и II комплексах и
замедление катаболизма в клетке.
Слайд 39Таким образом скорость синтеза АТФ точно
соответствует потребностям клетки в
энергии.
Ускорение тканевого дыхания и окислительного
фосфорилирования при повышении концентрации АДФ
называется дыхательным контролем.
В реакциях ЦПЭ часть энергии не превращается в
Энергию макроэргических связей АТФ, а рассеивается
в виде тепла
Слайд 40Разобщение дыхания и синтеза АТФ
Некоторые липофильные вещества (2,4-динитрофенол,
некоторые жирные кислоты)
могут переносить ионы
водорода через внутреннюю мембрану митохондрий в
матрикс, минуя
канал АТФ-синтазы. В результате этогоснижается протонный градиент и прекращается синтез
АТФ. Это явление называется разобщением, а вещества
разобщителями дыхания и фосфорилирования.
Подобным образом действуют протонофоры,
увеличивающие проницаемость мембран для ионов
Na+ и К+. При действии разобщающих факторов большая
часть энергии выделяется в виде теплоты, количество
АДФ и поглощение кислорода увеличивается.
Слайд 41Терморегуляторная функция дыхания
При переносе электронов по ЦПЭ часть энергии
рассеивается
в виде теплоты, которая используется
теплокровными животными для поддержания
температуры
тела. При использовании АТФ для совершения полезной работы значительная часть
энергии также превращается в теплоту. При снижении
температуры тела включается механизм дрожания
(несогласованного сокращения отдельных групп мышц).
При этом за счет АТФ-азной активности актомиозина
происходит гидролиз АТФ до АДФ и Н3РО4, что
стимулирует тканевое дыхание. Полезной работы при
этом не происходит, большая часть энергии переходит в
теплоту и температура тела повышается.
Слайд 42Кроме того дополнительное образование теплоты
может происходить путем разобщения дыхания
и
фосфорилирования в процессе адаптации к холоду.
При охлаждении в жировой ткани
из симпатических нервных окончаний освобождается норадреналин,
который активирует ТАГ-липазу. При активации липазы
в клетках повышается концентрация свободных жирных
кислот, которые способны разобщать тканевое
дыхание и окислительное фосфорилирование,
участвуя в транспорте протонов через
митохондриальную мембрану.
Слайд 43У новорожденных и зимнеспящих животных
разобщение связано с наличием разобщающего
белка
– термогенина (до 15% от всех белков митохондрий) в
бурой
жировой ткани . Термогенин близок по структуре к
АТФ/АДФ-антипортеру. Он может переносить анионы
жирных кислот, но не обладает способностью к транспорту
нуклеотидов.
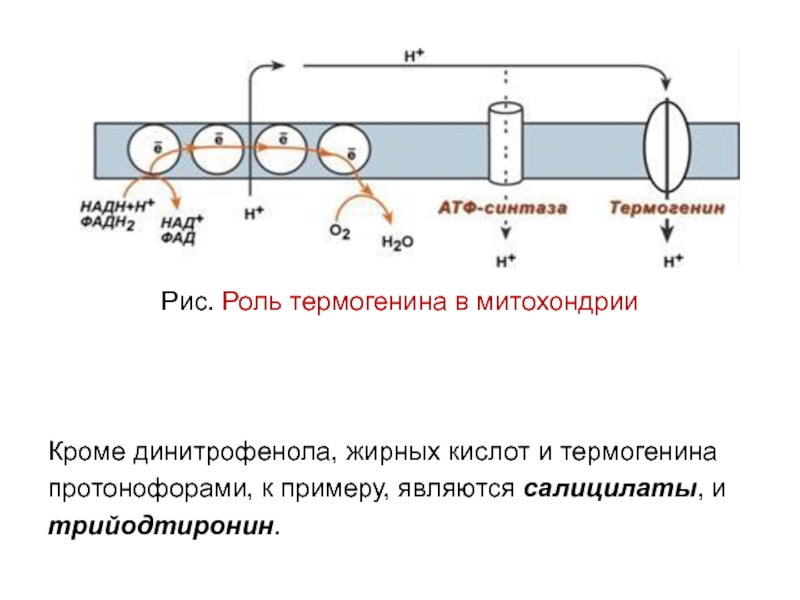
Слайд 44Рис. Роль термогенина в митохондрии
Кроме динитрофенола, жирных кислот и термогенина
протонофорами, к примеру, являются салицилаты, и
трийодтиронин.
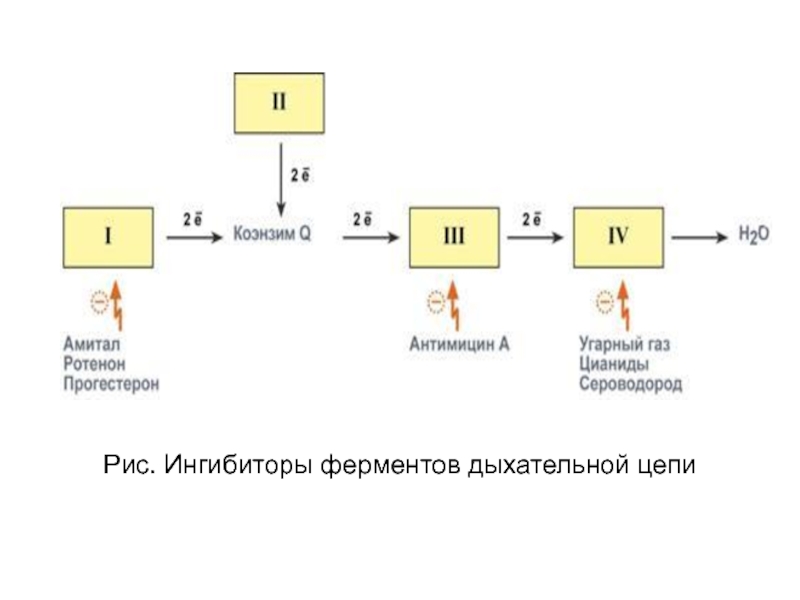
Слайд 45Ингибиторы дыхания
Некоторые лекарственные вещества, химические
агенты и антибиотики вызывают ингибирование
ферментов,
либо собственно дыхательной цепи:
1. действующие на I комплекс, например,
амитал, ротенон, прогестерон,
2. действующие на III комплекс, например, антимицин А,
3. действующие на IV комплекс, например, сероводород
(H2S), угарный газ (СО), цианиды (-CN).
либо окислительного фосфорилирования:
антибиотик олигомицин ингибирует процесс фосфорилирования на уровне АТФ-синтазы.
Слайд 47Гипоэнергетические состояния
Причинами гипоэнергетических состояний может быть следующее:
1. гиповитаминозы
экзогенные и/или эндогенные – снижается
скорость и эффективность окислительных реакций.
Возникаетобычно при нехватке витаминов группы В – В1, В2, никотиновой
кислоты (РР), В6, пантотеновой кислоты и аскорбиновой кислоты.
2. дефицит белка в пище – снижается синтез всех ферментов и
ферментов катаболизма в частности.
3. снижение потребления углеводов и липидов как основных
источников энергии.
4. дефицит кислорода – отсутствие акцептора для электронов
вызывает "переполнение" дыхательных ферментов, повышение
электрохимического градиента, накопление НАДН и ФАДН2 в
клетке и прекращение катаболизма.
5. дефицит железа – компонента цитохромов, миоглобина и
гемоглобина, и меди – компонента цитохромоксидазы.
Слайд 48Состав компонентов дыхательной цепи
НАД содержит витамин В3 или РР (никотиновая
кислота)
ФМН и ФАД – витамин В2 (рибофлавин),
Убихинон Q
– жироподобное вещество,Цитохромы – содержат гем (протопорфириновое кольцо с ионом железа,
Цитохром аа3 - содержат гем (протопорфириновое
кольцо с ионом железа и еще атом меди,
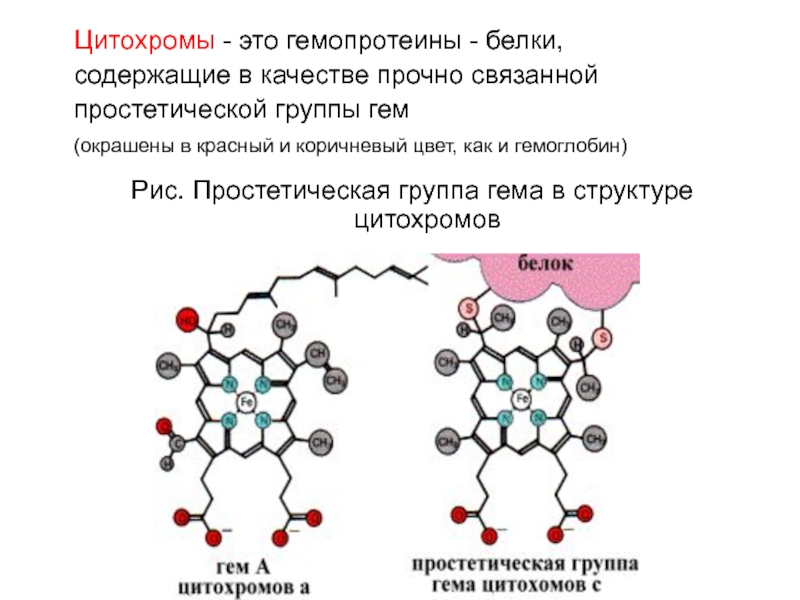
Слайд 54Цитохромы - это гемопротеины - белки,
содержащие в качестве прочно связанной
простетической
группы гем
(окрашены в красный и коричневый цвет, как и
гемоглобин) Рис. Простетическая группа гема в структуре цитохромов
Слайд 56Атом железа в геме может менять
валентность, присоединяя или
отдавая
электроны:
В дыхательной цепи цитохромы
служат переносчиками электронов и располагаются
соответственно величине ок.-восст. потенциала
следующим образом: b, с1, с, а, а3.
Гемовые группы цитохромов связаны с белковой
частью донорно-акцепторными связями между
ионом железа и соответствующими
аминокислотными остатками:
Слайд 57В цитохромах С и С1 дополнительные ковалентные
связи формируются между
тиогруппами цистеина и
боковыми винильными группами гема.
QН2-дегидрогеназа (комплекс III) представляет
собой
комплекс цитохромов b и С1. Этот фермент катализирует окисление
восстановленного кофермента Q и перенос электронов
на цитохром С.
Электроны последовательно переносятся
атомами железа цитохромов b и С1,
а затем поступают на цитохром С .
Протоны после окисления QH2 переносятся в
межмембранное пространство митохондрий.
Слайд 58Цитохромоксидаза
включает комплекс цитохромов а и а3
(комплекс IV). Цитохромоксидаза кроме
гема (с Fe) содержит
ионы меди, которые способны
менять валентность и
таким способом
участвовать в переносе электронов:
Цитохромоксидаза переносит электроны с
цитохрома С на кислород. В переносе электронов
участвуют сначала ионы железа цитохромов а и а3,
а затем ион меди цитохрома а3. Молекула
кислорода связывается с железом в геме цитохрома а3.
Следовательно, переход электронов на кислород с
иона меди цитохрома а3, происходит на молекуле фермента.
Каждый из атомов молекулы кислорода присоединяет по два
электрона и по два протона, образуя при этом молекулу воды.
Слайд 60Катаболизм основных пищевых веществ
1-3 пищеварение;
4-8 специфические
пути катаболизма;
9-10 заключительный (общий путь) катаболизма;
11- ЦПЭ;
12- окислительное фосфорилирование
Слайд 61Связь реакций общего пути катаболизма с ЦПЭ
1-5 первичные доноры водорода
для ЦПЭ;
1, 2, 3, 5 – субстраты НАД-зависимых дегидрогеназ;
4 –
субстрат ФАД-зависимой сукцинатдегидрогеназы;6,7,8, - этапы сопряжения дыхания и окислительного- фосфорилирования