Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ОРГАНИЧЕСКАЯ ХИМИЯ
Содержание
- 1. ОРГАНИЧЕСКАЯ ХИМИЯ
- 2. Слайд 2
- 3. Слайд 3
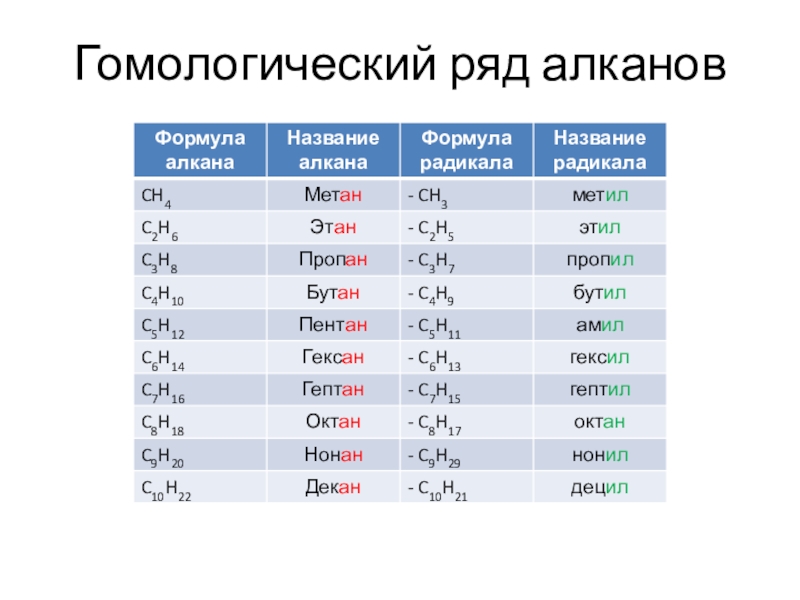
- 4. Гомологический ряд алканов
- 5. Слайд 5
- 6. Слайд 6
- 7. Слайд 7
- 8. 2. Методы синтеза алканов.Для получения алканов используют
- 9. 3. Щелочной гидролиз солей карбоновых кислот
- 10. 1. Реакции галогенирования Галогенирование – это
- 11. При достаточном количестве хлора реакция продолжается дальше
- 12. При хлорировании или бромировании алкана с вторичными
- 13. 2. Реакция нитрования алканов (реакция
- 14. 3. Реакции горения алканов Горение
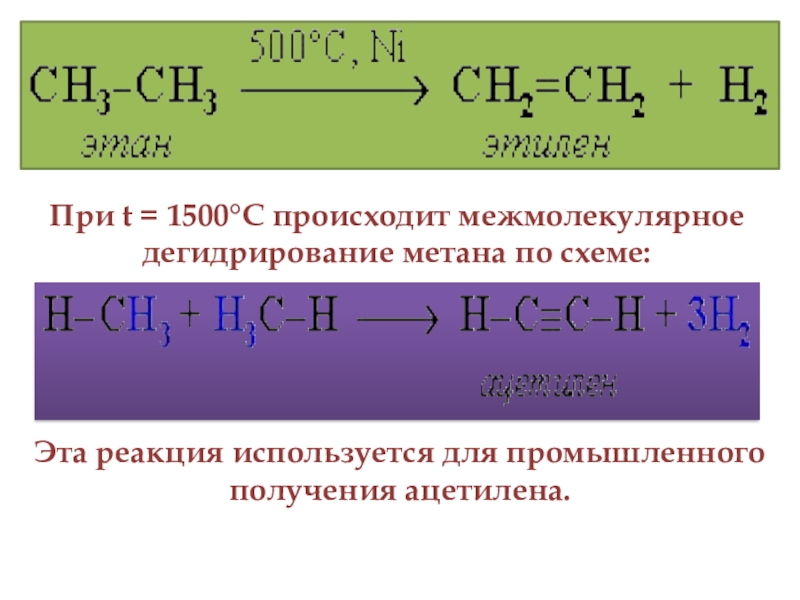
- 15. 4. Реакция дегидрирования алканов
- 16. При t = 1500°С происходит межмолекулярное дегидрирование
- 17. 4. Отдельные представители.
- 18. Вазелиновое масло – смесь
- 19. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2
Лекция № 2 Тема: «АЛКАНЫ» План: 1. Общая характеристика, гомологический ряд, номенклатура, изомерия. 2. Методы синтеза алканов. 3. Физико-химические свойства. 4. Отдельные представители.
Слайд 3 1. Общая характеристика, гомологический ряд, номенклатура, изомерия. Алканы – алифатические углеводороды,
в молекулах которых атомы углерода связаны между собой одинарной σ
– связью, а остальные их валентности предельно насыщены атомами водорода, отсюда их название – предельные (насыщенные углеводороды). Простейший представитель - СН4. Общая формула : СnН2n+2Слайд 5
Изомерия Атомы
углерода в молекулах алканов находятся в SP3 – гибризизации. Для алканов характерна структурная изомерия- изомерия углеродного скелета. СН3 – СН2- СН2 - СН3 СН3 – СН - СН3 н- бутан СН3 изобутанСлайд 6
Систематическая (международная) номенклатура 1. Выбираем самую длинную цепочку. 2.
Нумеруем её с той стороны, где ближе разветвления ( радикалы). 3. Цифрой указываем номера углеродных атомов, у которых есть радикалы. 4. Называем эти радикалы. Если 2 одинаковых радикала – добавляем частицу «ди», если 3 - «три», если 4 – «тетра» и т.д. 5. Называем всю цепочку.
СН3
1 2 ǀ 3 4 5
СН3–СН – СН2 - СН2 -СН3
2-метилпентан
Слайд 7
Рациональная номенклатура 1. Выбираем центральный атом и обозначаем его *. Центральный атом
тот, который имеет максимальное количество связей С-С. 2. Отсекаем все связи, отходящие от центрального атома. 3. Называем радикалы от младшего к старшему, используя п.4 систематической номеклатуры. Если радикал имеет разветвление, то его названию добавляется частица «изо». 4. К названию радикалов добавляем слово «МЕТАН» СН3
ǀ *
СН3–СН – СН2 - СН2 -СН3
диметилпропилметан
Слайд 82. Методы синтеза алканов.
Для получения алканов используют в основном природные
источники. Газообразные алканы получают из природного и попутных нефтяных газов,
а твердые алканы — из нефти. Природной смесью твердых высокомолекулярных алканов является горный воск(озокерит) — разновидность твердого природного битума.1. Гидрирование алкенов : CH2 = CH2 + H2 -> CH3 - CH3 (кат. Pt или Ni при tº)
2. Реакция Вюрца (взаимодействие галогенпроизводных алканов с Na) : CH3Cl + 2Na + ClCH3 -> 2NaCl + CH3 - CH3
2C2H5Cl + 2Na -> 2 Nacl + C4H10
CH3Cl + 2Na + C2H5Cl -> 2 NaCl + C3H8
Слайд 93. Щелочной гидролиз солей карбоновых кислот ( лабораторный способ получения
– берём смесь Na2CO3 + Са(ОН)2, которая наз. Натронной известью:
CH3COONa + NaOH -> CH4 + Na2CO3 4. Гидролиз карбидов : Al4C3 + 12H2O -> 3CH4 + 4Al(OH3) 5. Электролиз одноосновных карбоновых кислот: СН3СООNа -> СНСОО- + Nа+ Аn(+) -2е 2СНСОО- -> 2СО2 ↑+ СН3 – СН3 6. Омыление элементорганических соединений: СН3МgСl + НОН -> СН4+ МgОНСl 7. Восстановление галогенпроизводных углеводородов: СН3Сl + НСl -> СН4+ Сl2 8. Прямой синтез из углерода и водорода при tº= 400º- 500 º и повышении давления в присутствии катализатора Кt: С + 2Н2 -> СН4Слайд 10 1. Реакции галогенирования Галогенирование – это реакция замещения одного или более
атомов водорода в молекуле углеводорода на галоген. Продукты реакции называют
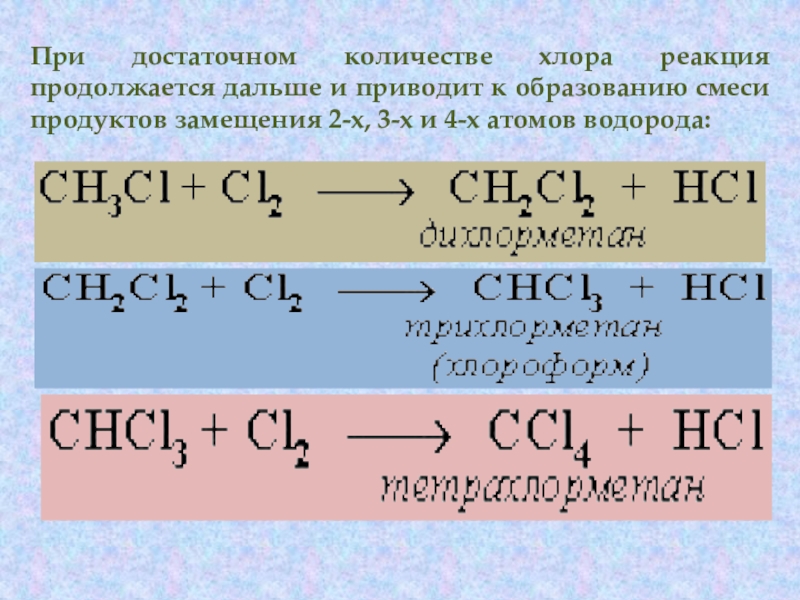
галогенопроизводными углеводородов. Реакция алканов с хлором и бромом идет на свету или при нагревании. Хлорирование метана:Слайд 11При достаточном количестве хлора реакция продолжается дальше и приводит к
образованию смеси продуктов замещения 2-х, 3-х и 4-х атомов водорода:
Слайд 12При хлорировании или бромировании алкана с вторичными или третичными атомами
углерода легче всего идет замещение водорода у третичного атома, труднее
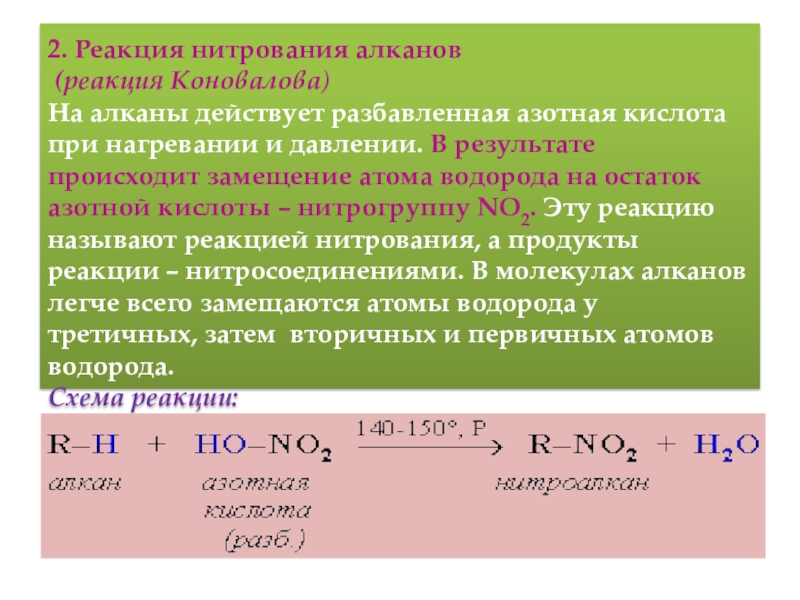
у вторичного и еще труднее у первичного. Поэтому, например, при бромировании пропана основным продуктом реакции является 2-бромпропан:Слайд 13 2. Реакция нитрования алканов (реакция Коновалова) На алканы действует pазбавленная
азотная кислота пpи нагpевании и давлении. В pезультате пpоисходит замещение
атома водоpода на остаток азотной кислоты – нитpогpуппу NO2. Эту pеакцию называют pеакцией нитpования, а пpодукты pеакции – нитpосоединениями. В молекулах алканов легче всего замещаются атомы водорода у третичных, затем вторичных и первичных атомов водорода. Схема реакции:Слайд 14 3. Реакции горения алканов Горение углеводородов приводит к разрыву всех связей
С–С и С–Н и сопровождается выделением большого количества тепла (экзотермическая
реакция):Низшие гомологи (метан, этан, пропан, бутан) образуют с воздухом взрывоопасные смеси, что необходимо учитывать при их использовании. Неполное сгорание алканов приводит к образованию угарного газа СО ( при недостатке кислорода)