Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основные понятия химической термодинамики
Содержание
- 1. Основные понятия химической термодинамики
- 2. Химическая реакция – процесс превращения исходных
- 3. Химическая термодинамикаизучаетпозволяет определитьпревращение энергии в ходе
- 4. Основные понятия химической термодинамики Энергия (Е) –
- 5. Основные понятия химической термодинамики Формы передачи энергии
- 6. В зависимости от способности системы
- 7. Основные понятия химической термодинамики Внутренняя энергия системы
- 8. Основные понятия химической термодинамики Процесс − переход системы из одного состояния в другое
- 9. Основные понятия химической термодинамики Состояние 1 Состояние 2
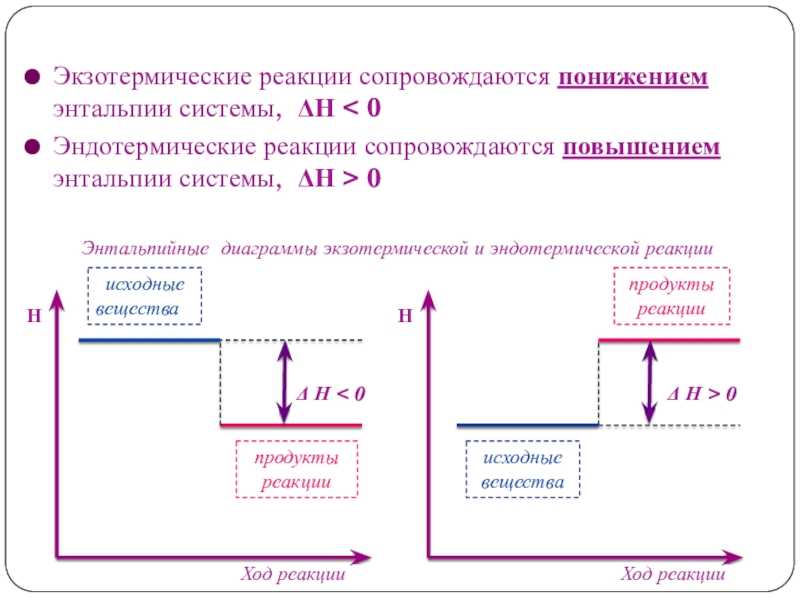
- 10. Экзотермические реакции сопровождаются понижением энтальпии системы, ΔН
- 11. Основные понятия химической термодинамики Состояние 1 Состояние 2
- 12. ИЮПАК, 1982 год Стандартное давление р
- 13. Расчет энтальпии реакции. Закон Гесса и следствия из него.
- 14. Стандартная энергия (или энтальпия) связи – энергия,
- 15. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Термодинамика − наука,
изучающая законы обмена энергией между системой и
Слайд 2 Химическая реакция – процесс превращения исходных веществ в продукты
реакции, сопровождающийся разрывом связей в исходных веществах и образованием связей
в продуктах реакции.Процесс разрыва связи – эндотермический;
Процесс образования связи – экзотермический;
Любая химическая реакция сопровождается выделением или поглощением энергии в виде теплоты, света или работы расширения образовавшихся газов
Энергетика химических превращений
Физико-химические закономерности протекания химических реакций
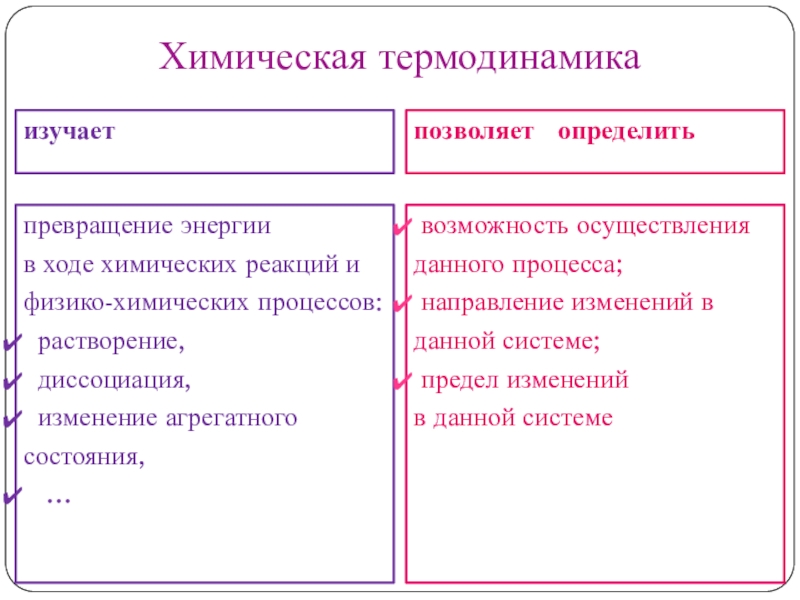
Слайд 3Химическая термодинамика
изучает
позволяет определить
превращение энергии
в ходе химических реакций и
физико-химических процессов:
растворение,
диссоциация,
изменение агрегатного состояния,
…
возможность осуществления данного процесса;направление изменений в данной системе;
предел изменений
в данной системе
Слайд 4Основные понятия химической термодинамики
Энергия (Е) – мера взаимодействия и
движения материальных систем
Система (термодинамическая система) − тело или группа
тел, отделенных от окружающей среды реальной или воображаемой (гипотетической) поверхностью разделаПолная энергия системы (Е) – сумма кинетической (ЕК) и потенциальной энергии (ЕП) системы как целого и внутренней энергии системы (U)
E = ЕК + ЕП + U
Макроскопические характеристики или параметры,
используемые для описания состояния системы:
T – абсолютная температура (К);
р – давление (Па или кПа);
V – объем (м3);
m – масса (кг);
…
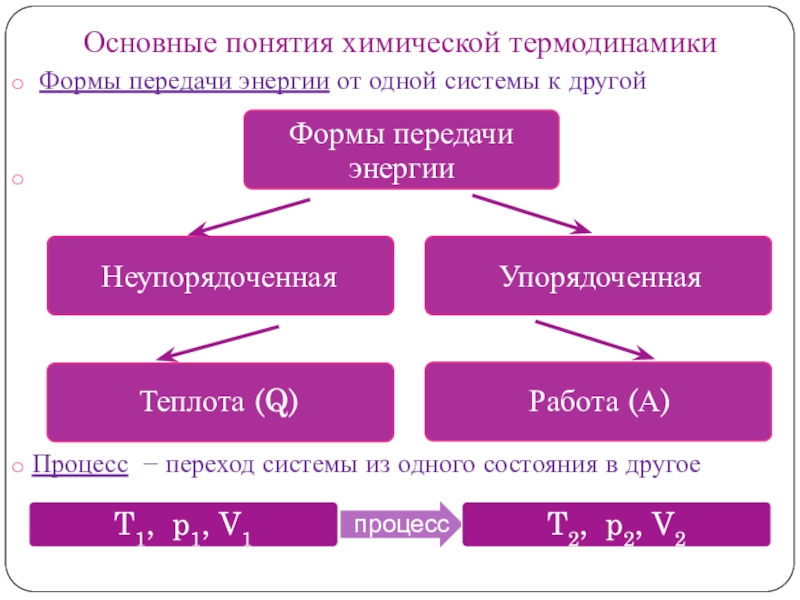
Слайд 5Основные понятия химической термодинамики
Формы передачи энергии от одной системы
к другой
Процесс − переход системы из одного состояния
в другое Различают процессы:
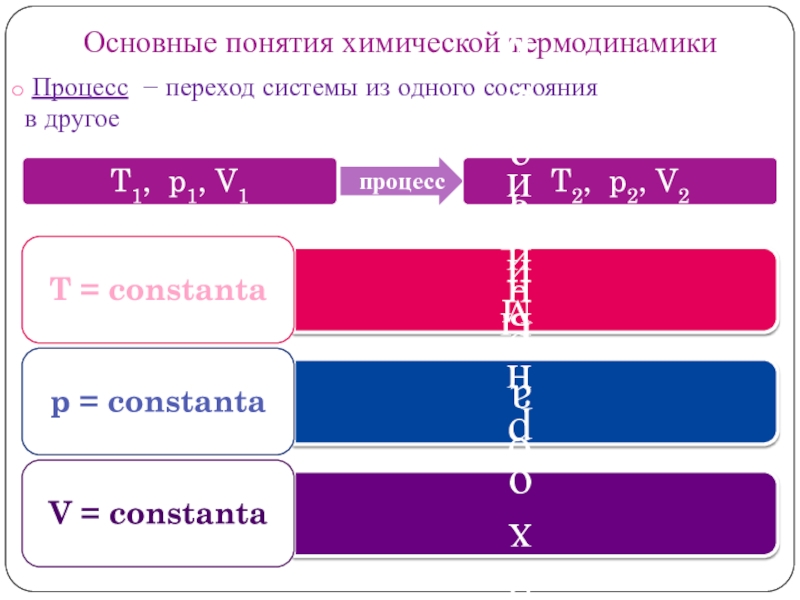
1) T = const (изотермический);
2) р = const (изобарный);
3) V = const (изобарный)
Неупорядоченная
Упорядоченная
Теплота (Q)
Работа (А)
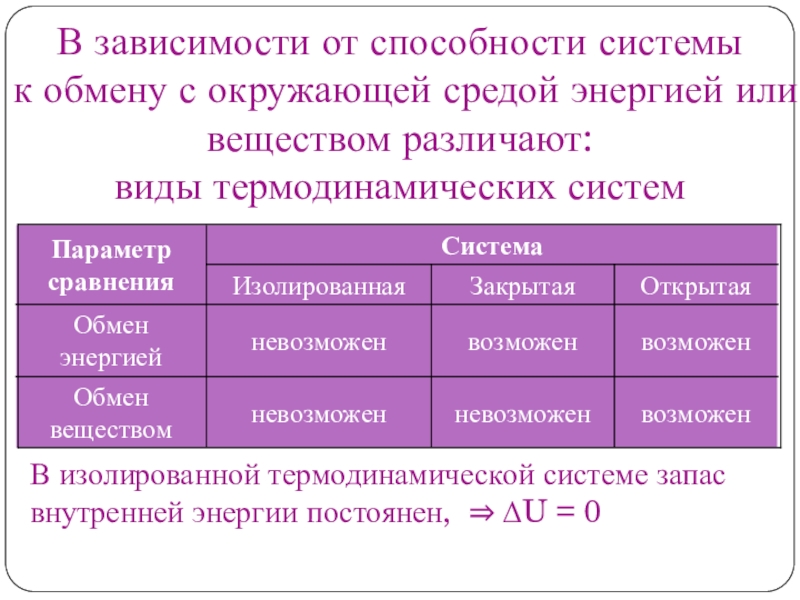
Слайд 6 В зависимости от способности системы к обмену с окружающей средой
энергией или веществом различают:
виды термодинамических систем
В изолированной термодинамической системе запас
внутренней энергии постоянен, ⇒ ΔU = 0Слайд 7Основные понятия химической термодинамики
Внутренняя энергия системы (U) – общий
запас энергии системы, равный сумме кинетической энергии движения частиц (молекул,
атомов, ионов, электронов и т.д.), составляющих систему, и потенциальной энергии взаимодействия указанных частиц.Первое начало термодинамики:
Q = A + ΔU
Теплота (Q), которая поглощается или выделяется системой, равна сумме изменения внутренней энергии системы (ΔU) и работы (А), которая совершается системой или над системой.
Слайд 8Основные понятия химической термодинамики
Процесс − переход системы из одного
состояния
в другое
Слайд 9Основные понятия химической термодинамики
Состояние 1 Состояние 2
U1 U2
ΔU =
U2 − U1
р = const (изобарный) ⇨ р2 = р1
Qр − тепловой эффект изобарного процесса или реакции
Qр = A + ΔU
А = р ∙ V2 − р ∙ V1 = р ∙ ΔV ≠ 0
(система имеет возможность изменять свой объем)
Qр = р ∙ ΔV + ΔU = (р ∙ V2 − р ∙ V1) + (U2 − U1) =
= (р ∙ V2 + U2) − (р ∙ V1 + U1) = Н2 − Н1 = ΔН
Введение термодинамической функции − энтальпия или теплосодержание системы
Н = р ∙ V + U
Qр = ΔН
Слайд 10Экзотермические реакции сопровождаются понижением энтальпии системы, ΔН < 0
Эндотермические реакции
сопровождаются повышением энтальпии системы, ΔН > 0
Н
Н
Ход реакции
Ход реакции
Энтальпийные диаграммы
экзотермической и эндотермической реакцииΔ Н < 0
Δ Н > 0
исходные
вещества
исходные
вещества
продукты
реакции
продукты
реакции
Слайд 11Основные понятия химической термодинамики
Состояние 1 Состояние 2
U1 U2
ΔU =
U2 − U1
V = const (изохорный)
QV − тепловой эффект изохорного
процесса или реакцииQV = A + ΔU
Так как ΔV = 0, ⇒ А = р ∙ ΔV = 0
QV = ΔU
Слайд 12ИЮПАК, 1982 год Стандартное давление р = 100000 Па =
100 кПа = 1 бар (для газов, жидкостей и твёрдых
тел); Стандартная температура Т= 273 К (tº = 0°С = 32°F) (для газов); Стандартная молярность СМ = 1 моль/л (для растворов); Ионное произведение дистиллированной воды КW = 1,0 × 10−14 моль²/л²Нормальные условия
Стандартные условия
p = 101325 Па = 101,325 кПа =
= 1 атм = 760 мм рт. ст.
T = 273 K (t°C = 0°C)
p = 100000 Па = 100 кПа = 1 бар
T = 298 K (t°C = 25°C)
Стандартные условия − значения температуры и давления, с которыми соотносятся значения других физических величин, зависящих от давления и температуры
Термодинамика
Стандартное состояние − состояние наиболее стабильной формы вещества (газ, жидкость или твёрдое тело)
Стандартные значения термодинамических величин обозначают нулем в верхнем индексе
Слайд 14Стандартная энергия (или энтальпия) связи –
энергия, которая выделяется при
образовании 1 моль связей,
или энергия, которая расходуется при разрыве
1 моль связей.Если реакция протекает между несложными молекулами
с ковалентными связями, то для определения изменения энтальпии реакции или теплового эффекта реакции необходимо из суммарной энергии связей в исходных веществах необходимо вычесть энергию, которая выделяется при образовании связей в продуктах реакции.
В ходе реакции (1) H2 + Cl2 = 2HCl
разрушаются связи H−H и Cl−Cl, образуются связи H−Cl
∆Н0реакции = (∆Н0H−H•1 моль + ∆Н0Cl−Cl•1 моль) – ∆Н0Н−Cl•2 моль
∆Н0реакции = (436 кДж/моль•1 моль + 240 кДж/моль•1 моль) –
– (430 кДж/моль•2 моль) = – 184 кДж ⇨
H2 + Cl2 = 2HCl + 184 кДж или H2 + Cl2 = 2HCl; ∆Н0реакции = –184 кДж